腹腔镜下不同左肝切除方式治疗左肝胆管结石的对比研究
2020-08-12胥丹朱春燕韩保俊黄凤德蒲羽
胥丹,朱春燕,韩保俊,黄凤德,蒲羽
(四川绵阳四0四医院 肝胆外科,四川 绵阳 621000)
左肝胆管结石是临床上常见的良性胆道疾病,反复发作的慢性炎症可导致肝脓肿、肝纤维化甚至肝内胆管癌的发生,往往需要通过手术才可“去除病灶、取尽结石”[1]。随着微创理念的普及和技术的成熟,腹腔镜左肝切除成为治疗左肝胆管结石重要的外科手段,除具有创伤小、出血少、患者恢复快等优势外[2],得益于左肝自身较小的体积,术中游离范围和断肝面积较小,手术安全性较右肝更容易把控,近些年取得了快速推广,其具体操作方式也不断创新、改进。目前,根据入肝血流阻断方式和切肝范围的不同选择,腹腔镜左肝切除进一步演化出三种操作方式:左肝蒂阻断解剖性左半肝切除术、左肝蒂阻断左肝部分切除术和Pingle法阻断左肝部分切除术,三种方式均拥有不同的特点及利弊,如何扬长避短并科学界定各自的适用范围,值得我们深入探讨。本研究回顾四川绵阳四0四医院腹腔镜左肝切除术患者的病例资料,总结相关操作经验,希望为合理选择三种方式治疗左肝胆管结石提供一定参考。
1 资料和方法
1.1 一般资料
纳入标准:(1)术前经两种影像学检查确诊为左肝胆管结石,可同时合并胆囊结石或胆总管结石;(2)单纯胆管切开取石难以彻底处理肝内病灶;(3)Child分级B级及以上,无严重内科合并症、凝血异常等;(4)经术前讨论拟定手术方案为腹腔镜左肝切除术;(5)术后病检未提示存在恶性病灶。
2015年5月至2018年11月共97例符合上述标准的左肝胆管结石病例,其中男44例,女53例,男女比1:1.2;平均年龄(54.8±11.9)岁。根据入肝血流阻断方式和切肝范围的不同选择,术前有25例行腹腔镜下左肝蒂阻断解剖性左半肝切除术、33例行腹腔镜下左肝蒂阻断左肝部分切除术、39例行腹腔镜下Pingle法阻断左肝部分切除术三种手术方案,分别对应区域阻断+解剖性切除组、区域阻断+部分切除组和全肝阻断+部分切除组,三组基线资料的比较详见表1。左肝部分切除术包括了除解剖性左半肝切除术以外所有的左肝切除病例,需要特别说明的是,对于非解剖性左半肝切除术,由于未以肝中静脉为指引断肝,肝实质离断面往往过于偏向左侧,离断面上缘及下缘仅能到达肝左静脉和左侧肝蒂,而非肝左静脉根部和左右肝管分叉这些真正的半肝解剖标志,残留了较多的左肝组织,故将其归入左肝部分切除组。本研究经医院伦理委员会审核批准,患者及家属知情同意。主刀均为本科室具有十年以上腹腔镜经验的医师。
1.2 手术方法
区域阻断+解剖性切除组:采用五孔法,有胆囊病变者先切除胆囊,再切开肝外胆管并联合胆道镜取石,其后解剖肝门部,分别游离、结扎左肝动脉和门静脉左支(见图1A)。观察并标记左肝缺血线(见图1B),以缺血线稍左侧为标志,用超声刀自肝下缘切入肝实质。进入肝内后寻找肝中静脉末梢,必要时可联合术中超声定位肝中静脉,断肝时头侧方向以肝中静脉为指引(见图1C),背侧方向则以肝中静脉与肝静脉韧带平面为导向。利用超声刀头行“钳榨法”断肝,到达左右肝管分叉时,若已证实左肝管无结石或左肝管结石已取净,可直接使用Endo-GIA离断左侧肝蒂(见图1D);若左肝管存有结石,应先切开左肝管并联合肝外胆管切口联合取石,再使用Endo-GIA处理左侧肝蒂。向头侧离断肝实质到达肝左静脉根部时,使用Endo-GIA将肝左静脉离断(见图1E),切除左半肝后,肝中静脉即可完全展现(见图1F),以双极电凝[3]或Prolene线缝合妥善处理出血及漏胆,肝外胆管切口安置T管,肝断面留置腹腔引流。
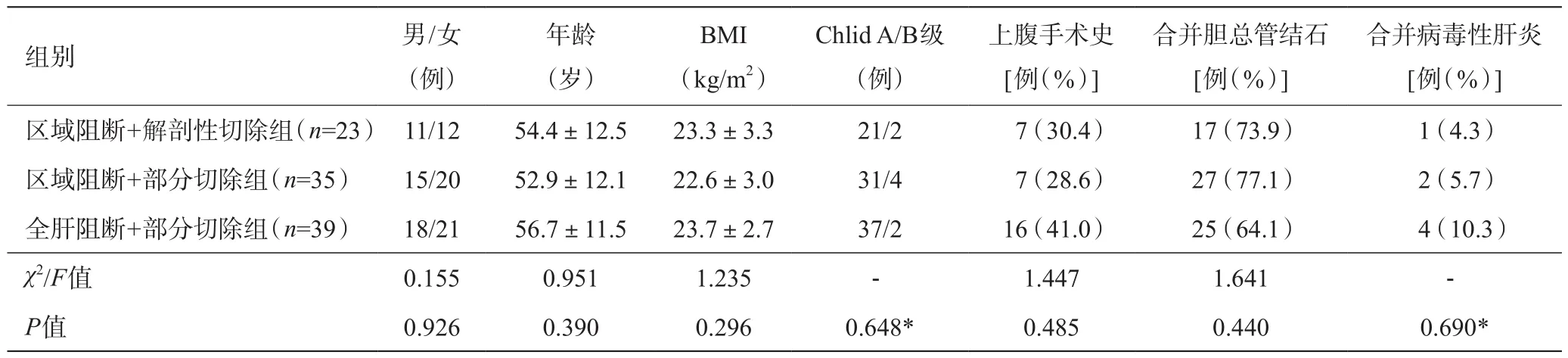
表1 三组基线资料的比较
区域阻断+部分切除组:胆囊切除、胆道探查取石后,肝门Glisson鞘内分离出左肝动脉和门静脉左支,使用阻断带阻断左侧入肝血流,根据术前MRI/CT并结合术中超声规划切肝路径,自左肝前下方切入肝实质,并以肝表面切缘与Arantius韧带的连线作为断肝平面。同样采用超声刀头进行“钳榨法”断肝,到达左侧肝蒂及左肝静脉时,使用Endo-GIA分别予以离断,解除左肝阻断,妥善处理肝断面,安置T管和腹腔引流管。
全肝阻断+部分切除组:胆囊切除、胆道探查取石后,无需解剖肝门部,将一根细尿管环绕肝十二指肠韧带,套紧后再使用合成夹固定细尿管,以此进行全入肝血流阻断,每15 min需解除阻断5 min,切肝路径规划、切肝方式、切肝后处理同区域阻断+部分切除组。
1.3 观察指标

图1 区域阻断+解剖性切除组手术图示
记录三组的微创成功率、手术操作时间、失血量、输血率、术后进食时间、术后住院时间、并发症发生情况,以及术后炎症指标(白细胞计数、C反应蛋白)和肝脏生化指标(谷丙转氨酶、总胆红素、白蛋白)。采用微信群随访12~42个月,每半年复查一次彩超、肝功能,同时了解有无胆管炎发作。
1.4 统计学分析
SPSS 22.0统计软件对各组数据进行统计分析。计量资料用( ±s)表示,三组比较采用单因素方差分析,进一步两两比较采用LSD检验,方差不齐时则采用非参数检验,重复测量的计量资料采用单变量方差分析进行比较,不满足球形检验时采用多变量方差分析;计数资料用[例(%)]表示,采用χ2检验进行比较。当P<0.05时其差异具有统计学意义。
2 结果
2.1 手术中转情况
术前拟行腹腔镜左肝切除术共97例,中转开腹7例,顺利实施90例,总体中转开腹率7.2%。7例中转病例中,4例曾接受腹腔镜(或开腹)胆囊切除联合胆总管探查手术,3例曾先后接受腹腔镜(或开腹)胆囊切除和开腹胆总管探查手术,皆因上腹部广泛粘连、解剖不清而中转开腹,均顺利完成手术。三组之间比较,区域阻断+解剖性切除组和区域阻断+部分切除组中转开腹率相近(8.7%vs8.6%),而全肝阻断+部分切除组最低(5.1%),但差异无统计学意义(P>0.05),见表2。
2.2 手术总体情况
90例顺利实施腹腔镜左肝切除病例中,总体手术时间(232.5±52.3)min,术中失血量(273.9±153.8)mL,输血率8.9%,术后进食时间(1.9±0.7)d,术后住院时间(10.4±2.8)d。三组之间比较,术中失血量、输血率、术后进食时间、术后住院时间差异均无统计学意义(P>0.05);手术时间区域阻断+解剖性切除组最长,区域阻断+部分切除组次之,全肝阻断+部分切除组最短,其差异有统计学意义(P<0.05),进一步两两比较,手术时间全肝阻断+部分切除组与区域阻断+解剖性切除组差异有统计学意义(P<0.05)。见表2。

表2 三组具体手术情况
2.3 炎症及肝功能指标变化
除区域阻断+部分肝切除组总胆红素外三组白细胞计数、C反应蛋白、谷丙转氨酶、总胆红素先升高后降低;白蛋白水平先下降后上升。其中区域阻断+部分切除组白细胞计数、全肝阻断+部分切除组总胆红素于术后第3天达到最高值,术后第5天下降,其余三组指标的极值均出现在术后第1天,而后逐渐改善。术后第5天,除白蛋白外各炎症及肝功能指标区域阻断+解剖性切除组均低于区域阻断+部分切除组和全肝阻断+部分切除组;除C反应蛋白外各炎症及肝功能指标全肝阻断+部分切除组均高于区域阻断+解剖性切除组和区域阻断+部分切除组。采用重复测量的方差分析进一步比较,白细胞计数、C反应蛋白、谷丙转氨酶、总胆红素及白蛋白在各时间点效应间的差异有统计学意义(P<0.05);谷丙转氨酶、总胆红素不同手术方式和各时间点存在交互作用(P<0.05),提示三组谷丙转氨酶、总胆红素随时间改变的趋势存在显著差异,其余指标不同手术方式和各时间点不存在交互作用(P>0.05)。详见表3。
2.4 术后并发症情况
三组均无死亡及再手术,术后无切口感染、肝功能衰竭、胆道及消化道出血发生,共有21例出现并发症,总体发生率23.3%。三组比较,区域阻断+部分切除组并发症发生率最低,为18.8%;区域阻断+解剖性切除组次之,为23.8%;全肝阻断+部分切除组最高,为27.0%,差异无统计学意义(P>0.05)。进一步比较,区域阻断+解剖性切除组胸部并发症发生率明显高于另两组,而全肝阻断+部分切除组腹部并发症发生率则明显高于另两组,但差异并无统计学意义(P>0.05)。发生术后并发症病例中,1例腹腔出血经内科治疗3 d好转,6例胆漏经7~30 d带管保守治疗好转,9例肺部感染、1例胸腔积液、1例腹腔感染经积极抗感染治疗,住期院间均痊愈,1例结石残留、2例结石复发均无症状,于门诊随访观察。

表3 三组炎症指标及肝功能变化情况

表4 三组并发症发生情况
3 讨论
由于左肝管解剖结构的特殊性,左侧肝胆管结石较右侧更为常见,反复的炎性刺激常导致胆管狭窄、囊性扩张等情况出现[4-5],单纯胆管切开难以取净结石,往往需要联合左肝切除才可达到清除病灶的目的。随着微创医学的发展,腹腔镜逐渐取代开腹成为左肝胆管结石外科治疗的新趋势,国内已有大量三级医院开展实施,其可行性及安全性得到了广泛证实[6-7],但如何彻底清除病灶、降低复发风险,同时减少健肝损伤、缩短病程周期,目前尚存分歧,争论焦点主要在入肝血流阻断方式的选择和是否进行解剖性左半肝切除两个方面,本研究以此为切入点,深入探讨腹腔镜下不同左肝切除方式治疗左肝胆管结石的具体选择。
3.1 入肝血流阻断方式的选择
为控制术中出血、保障手术安全,切肝前常需进行有效的入肝血流阻断,Pringle法全入肝血流阻断和选择性左侧入肝血流阻断是目前常用的两种方式。在腹腔镜下Pringle法一般通过细尿管环绕肝十二指肠韧带、收紧并以合成夹固定的方式实现[8],其便捷性及有效性值得肯定,但Pringle法施行的是包括右侧入肝血流在内的整体阻断,可诱发多种细胞因子介导的缺血再灌注损伤[9],直接或间接对(右)健侧肝细胞功能造成损害,从而延迟术后肝功能恢复时间,在合并肝硬化、手术时间长、多次阻断等特殊情况下,甚至会导致术后肝功能衰竭的发生[10-11]。但在临床实践中,由于Pringle法无需进行肝门部解剖,操作简单、耗时短暂,并且左肝切除预期时间不长,总体阻断时间和次数可控,加之左肝胆管结石少有合并肝硬化,故术后实际并发肝功能衰竭十分罕见,个别病例即使合并重症胆管炎,术前抗感染、护肝、PTCD等治疗后,肝功能也能在短期内获得改善。本研究全组病例术后均无肝功能衰竭发生,全肝阻断组同其他两个区域阻断组比较,肝功能生化指标恢复虽然较慢,但手术时间更短、术中出血量更少,在进行腹腔镜左肝部分切除时,Pringle法拥有一定优势。
选择性左侧入肝血流阻断则通过肝门解剖、游离并结扎肝左动脉及门静脉左支来达到区域阻断的目的,一方面保证了右侧入肝血流,防止右侧(健侧)肝脏缺血再灌注损伤的发生,另一方面避免了全入肝血流阻断造成的胃肠道淤血、水肿[12-13],此外,阻断后所显露的半肝缺血线,还有助于解剖性左半肝切除路径的把握。但左肝蒂的鞘内分离较为繁琐,需要术者熟知肝门部结构及变异,并拥有灵活的腔镜操作技能;近年来有文献报道了左侧肝蒂的鞘外阻断,操作时先打开肝门板,自左右肝管分叉向左下方整体掏出左肝蒂,予以结扎或直接使用Endo-GIA横断[14],可缩短游离鞘内血管的操作时间,但需要注意的是若结石位于左肝管内,使用Endo-GIA横断时可能因无法彻底封闭左肝蒂而导致难以控制的出血,因此,鞘外横断式阻断一定要在确保左肝管通畅的情况下实施。我们在实际操作中还发现,由于左右肝之间存在丰富的动脉和门脉交通支,单一的左侧入肝血流阻断有时达不到理想的阻断效果,左肝切除范围越大、离断面越靠近半肝分界线,这一现象越明显,故切肝前应常规预置肝门阻断带,必要时可迅速联合Pringle法以获取满意的阻断效果。
3.2 是否进行解剖性左半肝切除
腹腔镜左肝部分切除(尤其左外叶切除)是治疗左肝胆管结石最为常用的手术方式,也是腹腔镜肝切除最为基础的术式,术中以镰状韧带和Arantius韧带为标志把握切肝路径,并根据结石累及部位适时调整切肝范围,手术总体安全性高、可操作性强,若再配合使用Endo-GIA处理左侧肝蒂和肝左静脉[15],将进一步简化手术、缩短操作时间、降低出血风险。目前,腹腔镜左肝部分切除已成为微创肝切除手术中最为普及的术式,但随着病例数量的增加,结石残留、术后复发等问题逐渐显现,究其原因,主要在于术中未能彻底祛除结石或病灶(如狭窄、囊性扩张的肝内胆管)[16]。由于手术规划是根据术前MRI/CT制定,阴性结石及细微病灶一旦遗漏,将使手术医师选择错误的切肝路径,直接导致切肝范围过小、病肝残留。术中联合超声可有效搜寻、定位左肝结石及病灶,协助手术医师及时调整切肝路径[17],本研究解剖性半肝切除组和另外两个肝部分切除组对比,结石残留率和复发率并无差异,这跟适时联合术中超声不无关系。令人遗憾的是,限于腹腔镜专用术中超声的价格及使用成本,国内地方三级医院普及率并不高,熟练使用的肝胆科医师更少,成为制约腹腔镜左肝部分切除手术质量提高的重要因素。
解剖性左半肝切除是以肝叶为单位的规则性肝切除手术,由于是对左半肝的整体切除,一方面彻底清除了位于左肝的结石及病灶,另一方面也同步去除了缺乏血供和流出道的肝脏组织,符合肝脏解剖生理要求和病理学特点[18],对降低术后结石残留、复发,减少肝断面坏死、感染等并发症,能起到积极的作用[19]。然而,为实现左半肝的解剖性切除,需要一系列复杂、精细的操作:首先进行肝门部解剖,选择性阻断左侧入肝血流,以获取半肝缺血线,其利弊及操作要点前文已阐述;再切入肝实质寻找肝中静脉,以准确把握肝内切肝路径,切入区应在缺血线略偏向于左肝一侧,有助于寻找肝中静脉并避免肝断面意外进入右肝,必要时可联合术中超声协助搜寻、定位;最后以肝中静脉为肝内指引离断肝实质,为良好显露并防止偏离肝中静脉,应沿肝中静脉上缘而非左侧壁进行追踪。由于操作难度较大、步骤较多、时间较长,腹腔镜解剖性左半肝切除需要医师更为充分的耐心和细致的操作,相对于左肝部分切除,在手术时间、术中出血、并发症发生率(胸部并发症发生率的升高抵消了腹部并发症发生率的降低)等方面并无优势可言,本研究的对比数据也证实这些特点。因此,只有当结石累及左内叶、部分切除无法保证治疗彻底性时,才具有选择腹腔镜解剖性左半肝切除的必要性。
3.3 小结
腹腔镜下三种方式行左肝切除各有特色及利弊:区域阻断+解剖性切除最具治疗彻底性,对健肝(右肝)功能影响也最小,理论上发生于左肝各区段的结石及病灶均可采用,但其难度大、操作时间长,更适合处理累及左内叶尤其IVa段的结石及病灶;全肝阻断+部分切除操作相对简单、手术时间短,局限于II、III、IVb的结石及病灶均可选用,联合术中超声更能提高结石及病灶定位的准确性,并为切肝路径的制定或调整提供现实依据,可降低术后残石率和复发率;区域阻断+部分切除集合了上述两种方式的部分特点,但鉴于区域阻断较Pringle法更为繁琐、耗时,手术医师应根据自身能力、患者病情酌情选用。
