红叶乌桕组培育苗关键技术研究
2020-08-12舒婷
舒婷
(福建省林业科技试验中心,福建 漳州 363600)
红叶乌桕(Euphorbia cotinifolia)又名紫锦木,大戟科大戟属半常绿灌木或小乔木。其小枝红色,叶柄长,叶片薄,宽椭圆形至近圆形,红色至紫红色,原产墨西哥及南美洲,在我国的广西、广东等省(区)有引种[1]。红叶乌桕可观叶、观形、观果,适于城市绿化应用,因此具有巨大的生态和经济效益[2-3]。目前,红叶乌桕的繁殖方式主要有种子育苗和扦插育苗[4-5],存在苗木变异性大、育苗周期长、产量低等难题,严重制约其产业化的发展。建立红叶乌桕组织培养快繁体系是解决种苗供应的有效途径之一。
近年来,有关红叶乌桕组织培养技术的研究在国内外已有报道[6-7],但存在易污染、易褐化和增殖率不稳定等问题,特别在组培育苗增殖培养过程中会出现轻微褐化和死苗现象,并随着6-BA浓度的增加,褐化现象越来越严重。如何解决红叶乌桕组培过程中褐化问题成为组培育苗技术的关键。本研究通过优化消毒时间、调整MS盐浓度和植物生长调节剂浓度,有效降低培养成本、简化操作过程,为红叶乌桕组培育苗提供理论依据和技术支撑。
1 材料和方法
1.1 试验材料
试验材料为福建省鑫闽种业有限公司种植的红叶乌桕,采摘时间为当年4月份。选取株型优美、生长健壮、无病虫害污染的新萌嫩枝,剪去叶片,保留叶柄1 cm左右,伤口处会有乳白色液汁流出,需先在自来水下冲洗1遍,再用肥皂水浸泡15 min,之后用毛笔轻轻刷洗茎段,特别是腋芽处,最后放在自来水底下冲洗1 h,备用。
1.2 试验方法
1.2.1红叶乌桕无菌体系的建立
把清洗过的红叶乌桕嫩枝在超净工作台上用75%(体积比)酒精浸泡20 s后,马上用无菌水冲洗3遍,然后放入0.1%(质量比)升汞中消毒6~9 min,再用无菌水冲洗4~5遍。将外植体切成2~3 cm、带1~2个腋芽的小段,接种到不添加激素的基本培养基上。每5 d统计外植体的污染数量,20 d后统计外植体的污染率和萌发率。污染率=污染数/接种数×100%;萌芽率=萌芽数/接种数×100%。每瓶接种1个外植体,每组接种10瓶,重复6次。
1.2.2诱导培养
将经过20 d生长后的红叶乌桕无菌嫩枝转接到诱导培养基中,设置3种基本培养基:3/4MS、MS、改良的MS,其中改良的MS是将NH4NO3减半,同时添加质量浓度70 mg/L的NaH2PO4,其余成分不变。各处理分别添加质量浓度为0.5 mg/L的6-BA和质量浓度均为0.2 mg/L的NAA和IBA,培养后统计分析不定芽诱导萌发情况,筛选出最适合的诱导培养基。每瓶接种1个外植体,每组接种10瓶,重复6次。
1.2.3增殖培养
将诱导形成不定芽的基部稍微切除,分别接种到增殖培养基中,以改良MS为基本培养基,添加6-BA 0.5~1.5 mg/L、NAA 0.2~0.4 mg/L、蔗糖 30 g/L、卡拉胶7 g/L。培养30 d后统计增殖系数和观察生长情况。每个处理接种30个不定芽,重复3次。
1.2.4褐化处理
将增殖的红叶乌桕丛芽切成带2~3个小丛芽的团块,分别转接到添加核黄素和L-半胱氨酸两种抗氧化剂的培养基中,对比红叶乌桕的褐化情况,统计并分析结果。
1.2.5生根培养
在增殖获得的丛芽中,将1.5~2.0 cm红叶乌桕单株切下,接种到生根培养基中进行不定根诱导,以1/2改良MS为基本培养基,添加NAA 0.5~1.5 mg/L、IBA 0~0.2 mg/L、活性炭 0.1 g/L、蔗糖 30 g/L、卡拉胶7 g/L。30 d后统计根数、苗高及生根率情况。每个处理接种30个不定芽,重复3次。
1.2.6培养条件
培养温度为24~26℃,光照强度1 500~2 000 lx,光照12 h/d,每个处理都是先暗培养5 d后再进行光培养。
1.3 统计与分析
采用DPS数据处理软件进行数据处理与分析。
2 结果与分析
2.1 不同的消毒时间对红叶乌桕外植体诱导的影响
由表1可知,使用质量分数为0.1%升汞对红叶乌桕幼嫩茎段分别消毒6、7、8、9 min,随着消毒时间的延长,红叶乌桕幼嫩茎段的污染率明显降低,消毒8 min时,萌发率最高,之后,随着消毒时间的延长,消毒效果的差异不显著,萌芽率明显降低。因此,红叶乌桕幼嫩茎段最适消毒条件为用质量分数为0.1%升汞溶液消毒8 min。
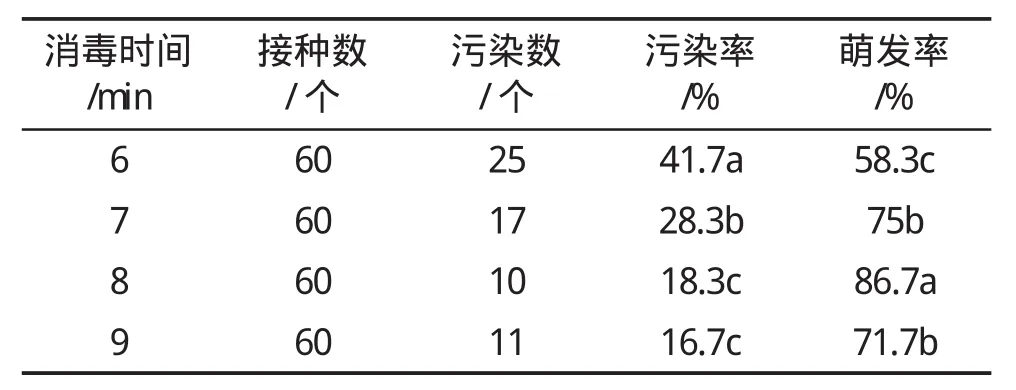
表1不同的消毒时间对红叶乌桕外植体诱导的影响
2.2 不同的启动培养基对红叶乌桕萌芽率的影响
将红叶乌桕无菌茎段接种于启动培养基上,15 d后切口处形成绿色愈伤组织,并逐渐分化出红色小芽苗,同时侧芽展开形成红色小芽。不同的启动培养基和激素种类对红叶乌桕茎段诱导萌芽有不同的影响。
由表2可知,在改良MS培养基上红叶乌桕茎段萌芽效果最好,分别为95%、90%,均显著高于MS和3/4MS基本培养基,说明3种启动培养基中,改良MS最适合红叶乌桕启动培养。质量浓度相同的两种生长素,红叶乌桕在添加NAA的启动培养基里萌芽率显著高于IBA。因此,最适合红叶乌桕最佳启动培养基为:改良MS+6-BA 0.5 mg/L+NAA 0.2 mg/L。

表2不同的启动培养基对红叶乌桕萌芽率的影响
2.3 不同浓度的激素组合对红叶乌桕丛芽增殖的影响
将红叶乌桕茎段诱导出的不定芽接种于增殖培养基中,剪切后的芽苗生长加快,增殖明显。30 d后观察其生长增殖情况并进行统计分析。
由表3可知,6-BA和NAA的用量对红叶乌桕的增殖都有显著影响,当6-BA在低浓度时,愈伤组织小,有丛芽生长但增殖系数低;随着6-BA浓度的增加,增殖系数先增加后减低,当6-BA为1.0 mg/L时,增殖系数最高,为4.01,并且愈伤组织生长状态较好,分化出的小芽单株明显,健壮;当6-BA浓度为1.5 mg/L时,基本愈伤大,芽丛密集,单株矮小并且不明显,有效芽苗少。对比A4、A5、A6处理可知,随着NAA浓度的增加增殖系数不断减低,低浓度的NAA比较适宜红叶乌桕增殖培养。综上,红叶乌桕增殖的培养基为:改良MS+6-BA 1.0 mg/L+NAA 0.2 mg/L。
2.4 不同的抗氧化剂对红叶乌桕褐化的影响

表3不同浓度的激素组合对红叶乌桕丛芽增殖的影响
红叶乌桕在增殖过程中会出现褐化现象,严重影响了幼苗的健康生长。研究表明,通过改变光照条件能明显改善褐化[7]。本研究将红叶乌桕增殖的丛芽接种于添加核黄素和L-半胱氨酸的培养基中,30 d后统计其褐化情况。
由表4可知,核黄素和L-半胱氨酸对褐化有显著的抑制作用,同时添加效果更好,并且不影响其正常生长。因此,在红叶乌桕增殖培养过程中应加入0.5 mg/L核黄素和0.5 mg/L L-半胱氨酸。
结合表3和表4可以证明,红叶乌桕增殖的最佳培养基为:改良MS+6-BA 1.0 mg/L+NAA 0.2 mg/L+核黄素0.5 mg/L+L-半胱氨酸0.5 mg/L。
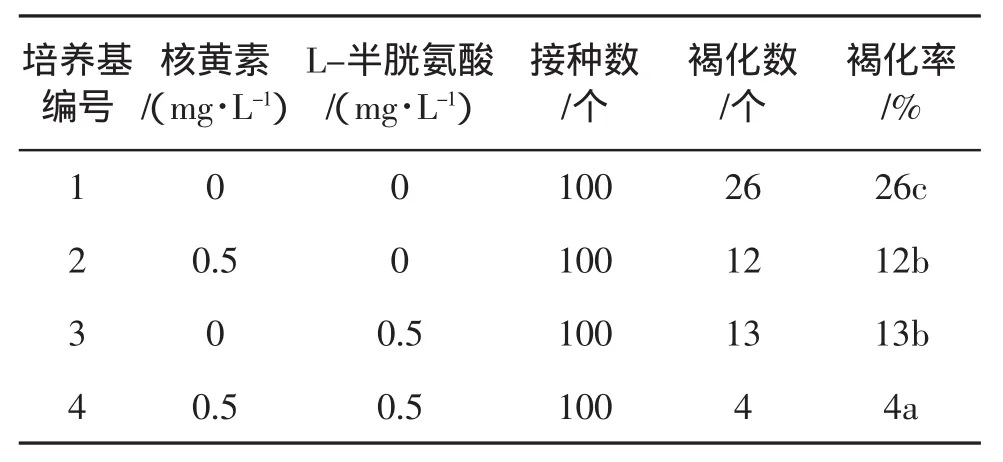
表4抗氧化剂对红叶乌桕褐化的影响
2.5 不同激素对红叶乌桕生根诱导的影响
由表5可知,红叶乌桕在9种培养基中均能生根。当NAA浓度为1.0 mg/L时,苗的长势很好,生根均匀并且生根率最高;当NAA浓度为1.5 mg/L时,虽然生根率相对较高,但是基部愈伤较大,严重影响苗的生长,苗高相对矮和弱;当NAA浓度为0.5 mg/L时,苗高适中,但是根数最少,苗的生根率最低。对比添加IBA的3个质量浓度培养基发现,苗的生根率随着浓度的增加先升高后减低。因此,红叶乌桕生根效果最佳的培养基为1/2改良MS+NAA 1.0 mg/L+IBA 0.1 mg/L。

表5不同激素对红叶乌桕生根诱导的影响
2.6生根苗的移栽
将红叶乌桕生根瓶苗移于温室里炼苗7 d,移栽前打开盖子在温室大棚预炼2 d,移苗前,将生根苗从培养瓶中取出,用清水洗去根部培养基,用800倍多菌灵浸泡1 min,然后把生根苗栽入泥炭土∶蛭石∶珍珠岩=3∶1∶1(体积比)育苗基质中,移栽初期保证棚内温度25℃左右,湿度90%以上,10 d后逐渐掀开棚膜通风,常规管理,移栽成活率可达92.5%,如图1。

图1红叶乌桕生根瓶苗移栽
3 结论与讨论
研究结果表明,红叶乌桕在组培育苗时,选择春季新萌嫩枝茎段为外植体,经75%酒精消毒20 s,再用0.1%HgCl2消毒8 min能有效降低污染率和死亡率,从而获得较高的诱导率,达86.7%,建立了红叶乌桕无菌体系。通过培养基优化试验,调整基本培养基,把MS里NH4NO3减半,同时添加70 mg/L的NaH2PO4,其他量不变,能够改善红叶乌桕芽苗的生长情况,提高萌芽率达95%。通过添加抗氧化剂核黄素和L-半胱氨酸能有效抑制红叶乌桕在增殖过程中出现的褐化现象,有效解决红叶乌桕组培育苗过程中的技术难点。以改良MS+6-BA 1.0 mg/L+NAA 0.2 mg/L+核黄素0.5 mg/L+L-半胱氨酸0.5 mg/L+蔗糖30 g/L+卡拉胶7 g/L为继代增殖培养基,增殖效果最好,增殖系数可达4.01;以1/2改良MS+NAA1.0 mg/L+IBA0.1 mg/L+蔗糖30 g/L+卡拉胶7 g/L为生根培养基,生根率最高,可达96.6%,并且根系发达,苗木生长健壮。用800倍多菌灵浸泡1 min生根苗,然后栽入泥炭土∶蛭石∶珍珠岩=3∶1∶1(体积比)的基质中,移栽成活率可达92.5%。本研究筛选合适的增殖培养基和生根培养基,建立红叶乌桕组织培养快繁技术体系,提高组培苗的繁殖系数和生根率,为实现组培育苗提供技术支持。
