RACK1、HSF1、E-cadherin 在宫颈癌中的表达及与临床特征、预后的关系
2020-08-12胡娟张洪波刘荣华
胡娟,张洪波,刘荣华
江汉大学附属医院/武汉市第六医院1妇产科,2检验科,武汉 430014
3华中科技大学同济医学院附属同济医院妇产科,武汉 430030
宫颈癌为女性生殖系统常见的恶性肿瘤,以阴道出血、阴道排液为主要症状,近年来随着肿瘤筛查的普及及治疗技术的进步,其发生率及病死率已有所下降,但仍有较多患者死于肿瘤复发及转移[1]。因此临床对于宫颈癌侵袭转移机制的研究及预后影响因素的探讨有重要价值。分子生物学指标为近年来宫颈癌预后研究的重点,不仅能够预测临床结局,且可利于疗效评估及靶向治疗[2]。激活的激酶C受体1(receptor for activated C kinase 1,RACK1)可与多种细胞内信号分子相互作用,参与细胞生长、分化等过程,在多种恶性肿瘤中高表达[3]。热休克转录因子1(heat shock transcription factor 1,HSF1)为机体重要的转录因子,能够调控肿瘤间质细胞生成,促进恶性肿瘤发生[4]。E-钙黏蛋白(E-cadherin)作为一种钙离子依赖性跨膜糖蛋白,可维持上皮细胞间黏附,其表达下调是引起肿瘤发生、侵袭和转移的主要诱因之一[5]。目前临床上缺乏宫颈癌联合检测RACK1、HSF1、E-cadherin表达的研究报道,本研究旨在探讨其在宫颈癌发生中的机制,并分析其与临床特征及预后的关系,为此类患者寻找新的防治靶点,现报道如下。
1 资料与方法
1.1 一般资料
收集2011年6月至2013年1月武汉市第六医院收治的宫颈癌患者的病历资料。纳入标准:①均经病理组织活检证实为宫颈癌;②病历资料完整。排除标准:①接受新辅助放化疗;②全子宫切除史;③全身系统明显病变。根据纳入和排除标准,共纳入宫颈癌患者68例,年龄31~73岁,平均(46.82±7.84)岁;病理类型:腺癌55例,鳞状细胞癌13例;临床分期:Ⅰ期10例,Ⅱ期14例,Ⅲ期44例;分化程度:低分化32例,中分化29例,高分化7例;有淋巴结转移50例,无淋巴结转移18例。选取同期28例宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)患者,年龄30~70岁,平均(44.93±8.82)岁。另选取23例因子宫肌瘤行全子宫切除术患者,年龄33~70岁,平均(45.90±9.17)岁。3组受试者的年龄比较,差异无统计学意义(P>0.05),具有可比性。分别选取宫颈癌患者、CIN患者、全子宫切除患者的宫颈癌组织、CIN组织及正常宫颈组织。
1.2 主要试剂和仪器
鼠抗人RACK1单克隆抗体、鼠抗人HSF1单克隆抗体、鼠抗人E-cadherin单克隆抗体均购自上海田源生物技术有限公司;苏木精购自上海科兴商贸有限公司;中性树脂胶购自北京鑫鼎鹏飞科技发展有限公司;免疫组织化学检测试剂盒购自上海户实医药科技有限公司;浓缩型二氨基联苯胺(diaminobenzidine,DAB)试剂盒购自北京索莱宝科技有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)购自绍兴迪申生物技术有限公司。A550石蜡切片机购自上海源叶生物科技有限公司;GD(J)W-010低温箱购自西安恒茂动力科技有限公司;GZX-DH.400-BS-Ⅱ电热恒温培育箱购自西化仪(北京)科技有限公司;HH.W21电热恒温水箱购自北京同德创业科技有限公司;ND11-DYY-8C电泳仪购自上海垒固仪器有限公司;9700聚合酶链反应(polymerase chain reaction,PCR)仪购自济南鑫贝西生物技术有限公司;LJ-CLP03光学显微镜购自北京科誉兴业科技发展有限公司。
1.3 检测方法
收集相关宫颈组织,放置于液氮中并转移至-80℃低温箱中待用。选用免疫组织化学染色法进行测定,石蜡标本进行4 μm层厚连续切片,放置于70℃烤箱中烘烤1.5 h。将切片进行二甲苯脱蜡,并予以100%、90%、80%、70%梯度酒精水化。于蒸馏水中漂洗3 min,以PBS冲洗3次。于切片中加入3% H2O2去离子水孵育10 min,抑制内源性过氧化物酶活性。以PBS冲洗3次,参照各抗体要求进行相应的热抗原修复,PBS冲洗3次。于切片中加入适当比例稀释的一抗(RACK1抗体稀释度为 1∶100,HSF1抗体稀释度为 1∶50,E-cadherin抗体稀释度为1∶100),放置于4℃冰箱中过夜。以PBS冲洗3次,加入通用性免疫球蛋白G(immunoglobulin G,IgG)抗体-辣根过氧化物酶(horseradish peroxidase,HRP)多聚体,室温环境下放置30 min。以PBS冲洗3次,于每个切片中加入2滴刚配制的DAB溶液进行显色,在显微镜下调控显色时间至阳性物质出现棕黄色反应时,以自来水冲洗并终止显色反应。取苏木素进行复染,以自来水再次返蓝,梯度酒精以脱水干燥,二甲苯透明,中性树脂进行封片。
1.4 结果判定
在高倍镜(400倍)下随机选择5个视野,单个视野观察200个以上细胞,RACK1阳性表达在细胞质、细胞核,HSF1阳性表达在细胞核,E-cadherin阳性表达在细胞核、细胞质。按染色强度及阳性细胞所占比例判定结果。阳性细胞所占比例:51%~100%计为3分,26%~50%计为2分,10%~25%计为1分,<10%计为0分。染色强度:棕褐色计为3分,棕黄色计为2分,浅黄色计为1分,无色计为0分。二者分数乘积≥3分即为阳性[6]。
1.5 随访
宫颈癌患者均以门诊复诊、电话等方式进行为期5年的随访,明确患者生存情况,统计5年生存率,其中失访1例,随访率为98.53%。
1.6 统计学分析
采用SPSS18.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组比较采用方差分析;计数资料以例数及率(%)表示,组间比较采用χ2检验或连续矫正法;采用Log-rank检验分析比较生存情况;采用Cox风险比例模型进行多因素分析;以P<0.05为差异有统计学意义。
2 结果
2.1 不同宫颈组织中RACK1、HSF1、cadherin阳性表达情况的比较
宫颈癌组织中RACK1、HSF1的阳性表达率均高于CIN组织及正常宫颈组织,E-cadherin的阳性表达率分别低于CIN组织及正常宫颈组织,差异均有统计学意义(P<0.05)。(图1、表1)

图1 免疫组织化学法检测宫颈癌、CIN、正常宫颈组织中RACK1、HSF1、E-cadherin的表达情况(SP染色,×400)
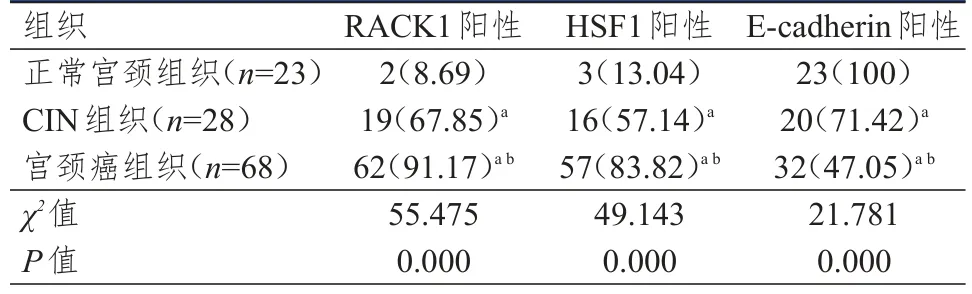
表1 不同宫颈组织中RACK1、HSF1、E-cadherin蛋白阳性表达情况的比较[n(%)]
2.2 不同临床特征的宫颈癌患者宫颈癌组织中RACK1、HSF1、E-cadherin阳性表达情况的比较
临床分期为Ⅲ期、深肌层浸润、低分化、有淋巴结转移的宫颈癌患者的宫颈癌组织中RACK1阳性表达率分别高于临床分期为Ⅰ~Ⅱ期、浅肌层浸润、中~高分化、无淋巴结转移宫颈癌患者的宫颈癌组织,差异均有统计学意义(χ2=9.157、7.955、3.961、14.371,P<0.05);临床分期为Ⅲ期、深肌层浸润、低分化、有淋巴结转移的宫颈癌患者的宫颈癌组织中HSF1阳性表达率分别高于临床分期为Ⅰ~Ⅱ期、浅肌层浸润、中~高分化、无淋巴结转移宫颈癌患者的宫颈癌组织,差异均有统计学意义(χ2=10.126、4.983、5.884、11.730,P<0.05);临床分期为Ⅲ期、深肌层浸润、低分化、有淋巴结转移的宫颈癌患者的宫颈癌组织中E-cadherin阳性表达率分别低于临床分期为Ⅰ~Ⅱ期、浅肌层浸润、中~高分化、无淋巴结转移宫颈癌患者的宫颈癌组织,差异均有统计学意义(χ2=13.421、21.454、37.370、14.985,P<0.05);不同年龄及病理类型宫颈癌患者的宫颈癌组织中RACK1、HSF1、E-cadherin阳性表达情况比较,差异均无统计学意义(P>0.05)。(表2)

表2 不同临床特征的宫颈癌患者宫颈癌组织中RACK1、HSF1、E-cadherin的阳性表达情况
2.3 宫颈癌预后影响因素的单因素分析
不同年龄、病理类型、临床分期、肌层浸润、分化程度、淋巴结转移、RACK1、HSF1、E-cadherin表达的宫颈癌患者的生存情况比较,差异均有统计学意义(P<0.01)。(表3)
2.4 宫颈癌预后影响因素的多因素分析
将2.3中分析差异有统计学意义的因素纳入多因素Cox比例风险模型,结果显示,年龄>50岁、腺癌、临床分期为Ⅲ期、深肌层浸润、低分化、有淋巴结转移、RACK1阳性表达、HSF1阳性表达均是影响宫颈癌预后的危险因素,E-cadherin阳性表达是宫颈癌预后的保护因素。(表4)
3 讨论
宫颈癌是妇科常见肿瘤,目前其发病率呈年轻化趋势,危及患者的生命安全。早期发现高危人群,并开展针对性的重点预防工作能够一定程度降低其发生率与病死率[7]。宫颈癌的发病机制目前尚无准确定论,准确评估其生物学行为与预后情况,对临床治疗的指导及生活质量的改善有重要价值[8]。国外研究认为,细胞癌变为多因素、多阶段过程,与系列基因异常表达相关[9]。

表3 宫颈癌预后影响因素的单因素分析(n=68)
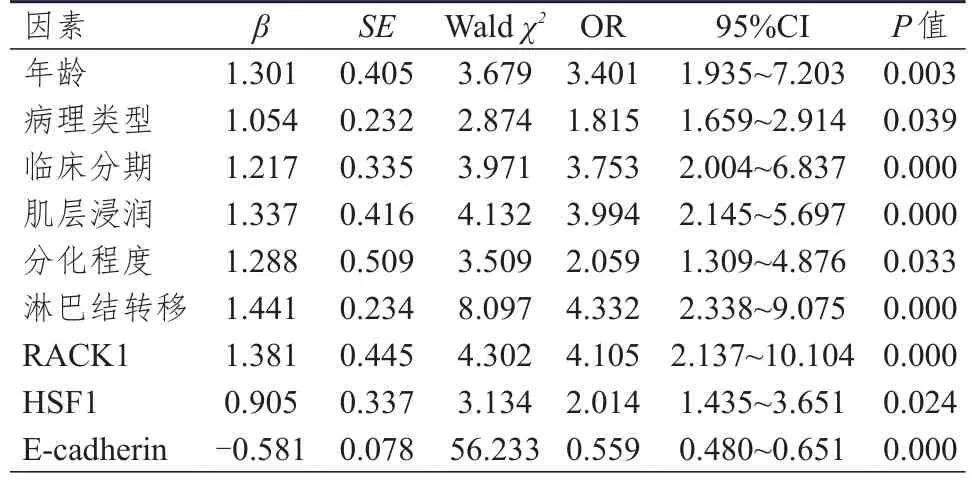
表4 宫颈癌预后影响因素的多因素分析
RACK1的结构特殊,能够与人类免疫缺陷病毒1型基因、蛋白激酶C等结合,参与细胞内多种信号的转导通路,调控肿瘤细胞的生长[10]。同时其作为核糖体的重要成分,可调节蛋白质产生。既往研究发现,RACK1于新生血管中高度表达,可调节肿瘤细胞对凋亡的抵抗,利于凋亡基因的降解及活化[11-12]。动物试验发现,RACK1过表达组裸鼠肿瘤生长速度明显快于未经处理的裸鼠[13]。本研究显示,宫颈癌组织中RACK1阳性表达率高于CIN组织,且其高表达与临床分期、肌层浸润、分化程度、淋巴结转移有关,与临床研究报道[14]相似,说明其可一定程度反映宫颈癌的分化程度与侵袭、转移等恶性特征。经Cox回归分析显示RACK1阳性表达是影响宫颈癌患者预后的独立危险因素,可作为预后判断的观察指标。
HSF1为热休克反应中的主要调节因子,可维持细胞内平衡,并参与机体老龄化、癌症等生理病理反应[15]。近年来,相关研究发现其不仅调节肿瘤细胞存活基因,且可诱导侵袭转移、细胞增殖[16]。余少敏等[17]研究认为,蛋白质翻译率和HSF1转录激活联系紧密,说明其可通过调控恶性代谢程序以促进肿瘤细胞蛋白生成,促进肿瘤进展。宫颈癌体外实验显示,通过影响RNA抑制HSF1表达,可降低热休克反应通路的相关热休克蛋白,促进肿瘤细胞的凋亡[18]。本研究发现,HSF1在正常宫颈组织、CIN组织及宫颈癌组织中的阳性表达率逐步升高,提示HSF1可能参与宫颈癌的发生发展,此外HSF1在高临床分期、深肌层浸润、低分化、有淋巴结转移宫颈癌患者宫颈癌组织中的阳性表达率高于低临床分期、浅肌层浸润、中高分化及无淋巴结转移患者,说明HSF1可能与宫颈癌浸润转移及恶性程度有关,有望成为评估其进展程度的新型标志物。预后分析显示,HSF1表达与宫颈癌患者预后有关,其高表达可提示预后不良,由此可推测HSF1的高表达可能参与宫颈癌癌基因的激活,影响预后。
E-cadherin作为一种抑癌基因,可于正常上皮细胞膜中稳定表达,系列因素可导致其表达减少或者缺失,引起复合体解散,并激活多条信号途径,减弱细胞间黏附能力,从而促进肿瘤的浸润与侵袭[19]。临床研究报道,多种肿瘤组织中的E-cadherin阳性表达率均明显低于正常组织,并认为E-cadherin的表达下降或者缺失能够改变细胞黏附活动性及动力学,影响上皮细胞连接,进而参与肿瘤的发生[20-21]。本研究发现,E-cadherin在宫颈癌组织中呈低表达,其在临床分期为Ⅲ期、深肌层浸润、低分化、有淋巴结转移宫颈癌患者的宫颈癌组织中的阳性表达率更低,说明通过监测E-cadherin表达情况不仅能够利于宫颈癌的筛查及诊断,且可反映癌变恶性程度。同时根据E-cadherin表达分析患者预后可见,其阳性表达者预后相对较好,是宫颈癌患者预后的保护因素。
综上所述,RACK1、HSF1、E-cadherin可作为宫颈癌患者临床特征与预后的参考指标。但本研究样本量较少,存在一定的抽样误差,有待更多累计研究考评。
