膜诱导技术治疗肢体肿瘤切除后骨干缺损的初期疗效分析
2020-08-10韩天宇纪振钢张昊宋夏楠梁娜周大鹏
韩天宇 纪振钢 张昊 宋夏楠 梁娜 周大鹏
肢体骨肿瘤切除后通常会留下较大的骨缺损。临床工作中虽然可以应用不同的技术来重建,包括金属假体、同种异体骨移植、骨搬运和血管化的自体腓骨移植等,恢复原始骨骼解剖结构和强度以承受肢体活动和继续生长的需求,但如何选择重建技术仍然具有很大的难度。特别是对于长期生存的年轻病人而言,生物学重建通常更为有利。然而,同种异体骨重建和血管化自体腓骨移植与诸多并发症密切相关,例如骨折、骨不连、感染和供体部位的并发症等[1⁃2]。Masquelet 等[3]报道了一种创新的两阶段技术,包括置入一个骨水泥间隔物,诱导形成膜,用自体松质骨重建缺损。本研究应用Masquelet 膜诱导技术治疗由于骨肿瘤切除后造成的长骨大段骨缺损,探讨其初期临床疗效。
资料与方法
一、纳入与排除标准
纳入标准:①发病于骨干的侵袭性骨肿瘤或恶性肿瘤;②侵犯范围广泛,达整段骨质周径2/3甚至全周径受累;③整段切除后骨缺损大于5 cm;④应用Masquelet膜诱导技术修复骨缺损;⑤临床检查和影像学检查完整。
排除标准:①第一阶段手术后尚未接受第二阶段手术者;②采取异体骨及自体腓骨移植手术者;③临床检查和影像学检查不完整。
二、一般资料
回顾性分析2014 年12 月至2018 年12 月我院应用Masquelet 膜诱导技术治疗的5例病人,其中男4例,女1例,年龄为15~60岁,平均为35.8岁。骨肿瘤类型:骨纤维异常增殖症1 例,造釉细胞瘤1 例,软骨肉瘤1例,动脉瘤样骨囊肿2例。骨缺损部位:股骨1例,胫骨2例,腓骨1例,尺骨1例。右侧受累3例,左侧受累2例。术前对病变进行穿刺活检。
三、手术方法
根据恶性骨肿瘤的治疗原则进行肿瘤切除,远、近端各超过肿瘤边缘2 cm。
(一)第一阶段
根据肌肉骨骼肿瘤切除原则进行肿瘤切除手术。肿瘤切除后,骨缺损断端使用带锁髓内钉或锁定钢板维持骨断端的稳定性。根据术前计划恢复肢体长度、力线和旋转,然后用金属尺测量瘤段的长度,预留好合适的骨缺损长度。
一旦获得稳定,就用骨水泥(Palacos®Lv Herae⁃us 公司,德国)填充骨缺损。根据骨缺损处骨末端的形状和大小,手工制作水泥,两端需要包绕正常骨端1~2 cm。可以使用塑料注射器塑形,并可将水泥聚合的热效应降至最低,在水泥上用盐水冲洗可降低骨骼和软组织热损伤的风险。避免过度填充骨水泥,不利于软组织包裹及第二阶段骨水泥的取出。仔细止血,留置引流管。关闭周围的肌肉,皮下组织和皮肤。术后给予抗生素预防感染。
(二)第二阶段
第一阶段术后至少4周进行第二阶段骨重建手术。沿上次手术切口疤痕切开,纵行切开骨水泥间隔物表面的诱导膜,注意保护。通过碎裂或整块去除水泥,适当处理骨端,直至骨端出血。应用髋臼锉从单侧(3 例)或两侧(2 例)髂前上棘取骨泥。当缺损较多时可以添加骨替代物,但不超过总量的1/3。植骨范围要超过正常骨端1~2 cm。缝合诱导膜,封闭植骨区域。仔细止血,留置引流管。关闭切口。
鼓励病人术后立即进行被动和主动辅助运动。术后常规抗感染、预防下肢深静脉血栓形成。根据骨形成愈合情况,逐渐进行肢体负重及功能锻炼。
四、疗效评定
病人在术后2 周和4 周复查正、侧位X 线片,之后每月复查一次,评估骨愈合情况,直到骨愈合。每3个月进行一次肿瘤学随访。采用Ilizarov方法研究与应用协会(Association for the Study and Applica⁃tion of the Method of Ilizarov,ASAMI)评价标准[4]评价综合疗效,美国肌肉骨骼肿瘤学会(Musculoskeletal Tumor Society, MSTS)评分系统评价病人功能恢复情况[5]。
结 果
病例1、2、4 系侵袭性病变,病例3 多次手术后复发;病例5 系恶性肿瘤,均侵犯骨干范围广泛,给予整段切除(图1)。5 例肿瘤病人的临床资料详见表1。在切除肿瘤后实施Masquelet 膜诱导技术时,骨缺损长度为8.5~11 cm,平均为9.5 cm。骨骼重建固定方式:使用锁定的髓内钉3例,钢板2例。两阶段间隔时间为4~10 周,平均为6.8 周。所有病例的手术切缘组织病理均证实为阴性。

表1 5例肿瘤病人的临床资料

图1 病例5,男,57岁,尺骨中段软骨肉瘤 a、b:术前正侧位X线片示尺骨中段膨胀性生长病变;c、d:肿瘤切除后骨水泥占位,钢板内固定;e、f:第二阶段手术时取出骨水泥占位器,占位器四周形成光滑完整的诱导膜及术后严密缝合诱导膜;g、h:术后复查正侧位X线片显示植骨充分紧密,形态完好;i、j:术后2年复查X线片,骨愈合良好,恢复尺骨形态,肿瘤无复发
5 例病人均获得随访,从第二阶段手术后开始计算,随访时间为10~34个月,平均为15.4个月。无局部复发,无感染发生。骨愈合时间为第二阶段后4.2~11.0个月,平均为6.4个月。根据ASAMI评定标准均为优秀,MSTS评分平均为27.4分(25~29分)。
一例胫骨骨干肿瘤(病例2,图2)切除后行髓内钉固定,周围出现骨吸收导致成骨较薄,但不影响功能遂未予处理。未发生与内固定相关的并发症,病例1(图3)发生股外侧皮神经损伤,在2个月后症状改善。

图2 病例2,男,18岁,胫骨中段动脉瘤样骨囊肿 a:植骨前诱导膜形成不完整,局部有缺损;b:诱导膜内充分植骨;c:缝合诱导膜;d、e:肿瘤切除,第二阶段植骨后正侧位X线片,显示植骨充分;f、g:植骨愈合,但前侧、外侧成骨菲薄
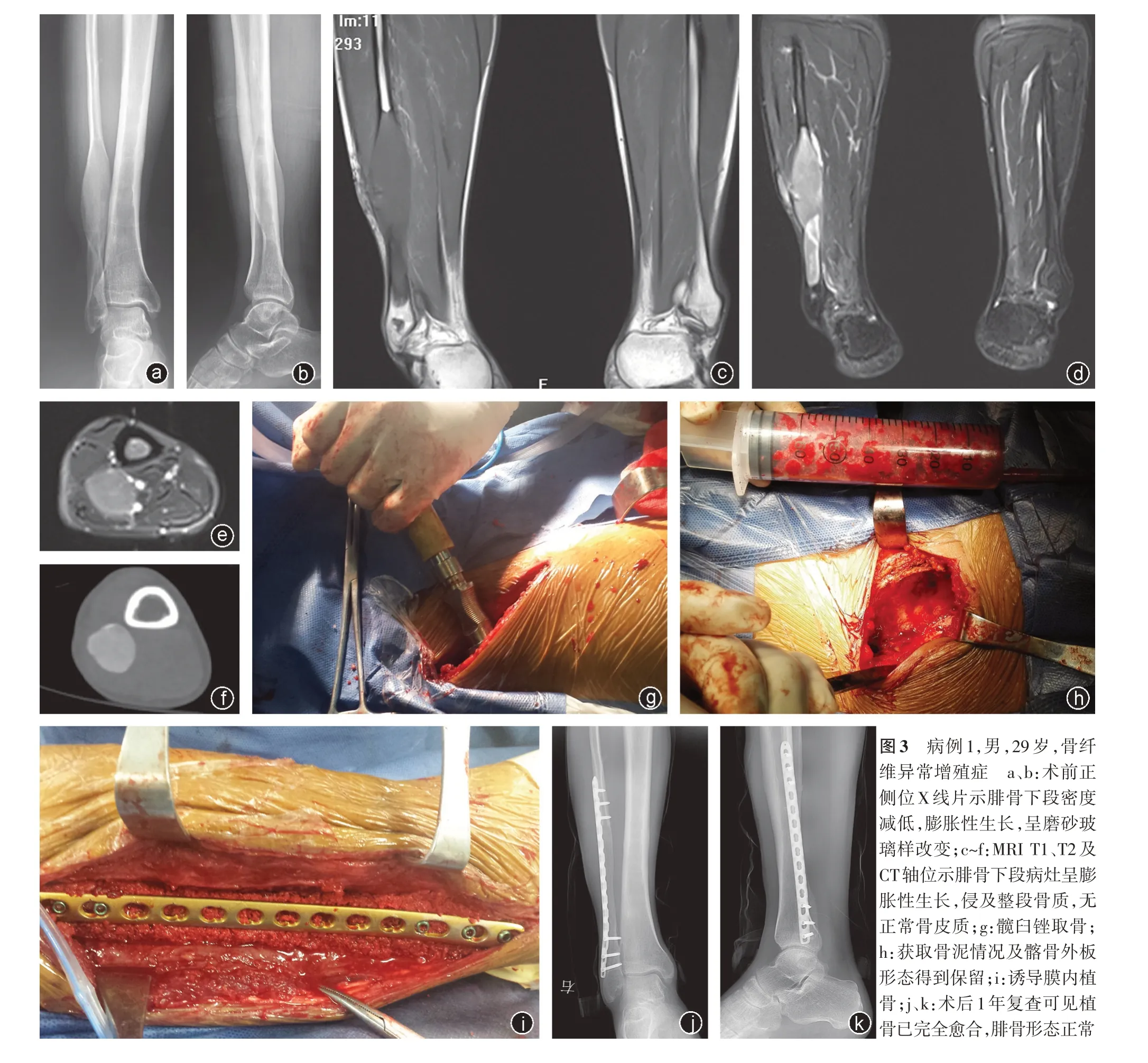
图3 病例1,男,29 岁,骨纤维异常增殖症 a、b:术前正侧位X 线片示腓骨下段密度减低,膨胀性生长,呈磨砂玻璃样改变;c~f:MRI T1、T2 及CT轴位示腓骨下段病灶呈膨胀性生长,侵及整段骨质,无正常骨皮质;g:髋臼锉取骨;h:获取骨泥情况及髂骨外板形态得到保留;i:诱导膜内植骨;j、k:术后1 年复查可见植骨已完全愈合,腓骨形态正常
讨 论
临床上,由于骨肿瘤切除而导致的大段长骨缺损仍然难以治疗。重建骨缺损的方法很多,可以分为非生物和生物重建两大类,各有利弊。非生物重建方式由于假体失败率高,仅适用于生存期较短的病人,以便立即承重行走[6]。而对于年轻病人而言,生物学重建通常更受青睐。
膜诱导技术是生物重建的新选择。这项技术最初是Masquelet 等[3]用于外伤性节段性骨缺损,效果令人满意。Biau等[7]报道一个12岁男孩行尤文肉瘤切除术后出现16 cm 的干骺端骨缺陷,应用该技术重建,表现良好。Villemagne 等[8]在2011 年报道了一组12 例长骨恶性肿瘤切除后应用膜诱导技术治疗的病例,取得了良好的治疗效果。
动物研究[9⁃11]表明,在植入甲基丙烯酸甲酯间隔物2、4、6和8周后,间隔物周围形成含有丰富血管的假滑膜上皮样组织,并具有高浓度的生长因子(血管内皮生长因子,转化生长因子β1)和骨诱导因子(骨形态发生蛋白质-2)。在诱导4 周后骨形态发生蛋白-2表达最高,此时证明诱导膜可以促进骨髓基质细胞向成骨细胞分化。而且,与由硅胶诱导的膜[12]相比,由骨水泥诱导的膜中不含有炎性细胞[13],可以防止移植物的吸收。该膜为骨缺损修复提供了必要条件:防止缺损处的软组织长入;用于骨传导的支架;维持缺损处足够的血管生成;并创造一个封闭的空间,保留成骨细胞和促骨生长物质。
与其他生物重建技术相比,膜诱导两阶段重建在技术上相对简单,不需要显微外科手术技术,可行性高。相较于带血管蒂腓骨移植和同种异体结合带血管蒂腓骨移植,手术时间明显缩短[14]。同种异体移植后感染率为7.5%~13%[15],带蒂腓骨移植感染率为10%~15%[16],而应用膜诱导技术重建的感染率介于二者之间。本研究中的病例暂未发生感染。低感染率可能与膜诱导技术手术时间相对较短,获取骨移植物快速便捷,并使用了添加抗生素水泥间隔物有关[17]。当然我们的病例数较少,还需要大量的病例去进一步证实。
我们在胫骨、股骨干重建中使用髓内装置进行初始重建,第二阶段以后负重的时间是根据临床检查和随访X 线片确定的,大多可以在第二阶段后平均3 个月时负重,便于迅速返回社会活动。而同种异体移植后的负重时间是12个月[18],带蒂腓骨移植为重建后5 个月[13]。更早的负重有助于功能锻炼,更加有益于那些需要接受化疗的病人。本研究的病例中未发生内固定失效、应力骨折等并发症。而同种异体骨移植重建后骨折的发生率为9%~19%,异体骨与宿主间不愈合率为17%~50%[14,16]。血管化的自体骨移植在非负重的上肢骨骨折率为30%~50%,尤其是负重骨骼不推荐单纯应用带蒂腓骨移植[16]。
本研究病例中包括部分侵袭性骨病,例如动脉瘤样骨囊肿(图2)、骨纤维异常增殖症(图3)等,治疗方式取决于其位置、大小(侵犯骨的直径范围)、骨皮质破坏程度、可操作性以及外科医生的经验等。治疗目标是治愈疾病,降低复发率。动脉瘤样骨囊肿的治疗通常采用病灶刮除,无论植骨与否,复发率大约是20%[19⁃20]。所以我们认为在病变表现为侵袭性比较强,侵犯整段骨质(图3所示)时,尤其是多次手术后复发的病例,应行整段切除,降低复发率。
使用Masquelet膜诱导技术治疗总体效果很好,但该技术同样具有缺点。主要缺点:它是分两步进行的,2个手术间隔至少4周,伴随需要二次住院、麻醉手术,围手术期风险增加[21];有移植物吸收的危险[10,17,22],第二阶段植骨时原则上应用松质骨,骨替代材料不超过植骨总量的1/3,当缺损较大,需要大量使用自体骨移植时,尤其是供骨量较少的青少年,这成为手术开展的限制因素。这组病例中出现1例(病例2)植骨部分吸收,但因为骨质连续性恢复,且采取髓内固定,病人负重活动后无不适遂未行进一步的植骨处理。分析原因可能是两阶段间隔时间为4周稍短,诱导膜形成不完整(图2 a);骨缺损较大,髂棘取骨量有限,添加骨替代材料过多,诱导膜内填充不充分,不利于成骨等所致,需下一步临床工作中改善。这些结果仅是初期的分析,需要更大的病例研究和更长的随访时间。
综上,膜诱导重建技术简单,与其他重建方法相比,该技术值得进一步研究以更好地运用于肢体肿瘤切除后的骨重建。
