大鼠软骨细胞与兔软骨细胞的培养与比较
2020-08-10张振罗辉宇曾炼
张振 罗辉宇 曾炼
骨性关节炎(Osteoarthritis, OA)作为一种慢性的关节退行性病变,其主要的病理改变是关节软骨损伤[1]。软骨细胞作为关节软骨的主要成分,参与了骨性关节炎发生、发展的全过程[2]。因此体外关节软骨细胞的培养是模拟软骨损伤的基础。然而目前关节软骨细胞的分离培养存在着操作步骤繁琐,细胞生物学特性难以持续保持以及经费投入较大等一系列的问题[3]。
Ⅱ型胶原是由具有三重螺旋结构的三个相同链构成的胶原纤维,通过分子间的相互交联而形成稳定的结构,这种网状结构可以抵抗细胞外基质中阴离子蛋白多糖聚合时所产生的肿胀压力,进一步保证关节软骨的完整性[4]。有研究表明退化的关节软骨细胞Ⅱ型胶原的表达量显著降低,同时证明了软骨细胞活力随Ⅱ型胶原表达的降低而逐渐下降[5]。在骨性关节炎的研究中发现,90%~95%Ⅱ型胶原组成的纤维网状结构的损伤可能是引起关节炎病变的扳机点[6]。正常的软骨细胞细胞外基质是由Ⅱ型胶原和蛋白聚糖构成,为维持结构的稳定性,细胞外基质的成分通过含血小板结合蛋白基序的解聚蛋白样金属蛋白酶5(a disintegrin and metalloproteinase with thrombospondin motifs 5, ADAMTS5)不断更新与重塑,但当细胞退化或损伤时,ADAMTS5 的表达量会不断增加,导致合成与降解的失衡,故而ADAMTS5可以作为评价软骨细胞功能活性的关键性指标[7⁃9]。
本课题组采用机械分离联合Ⅱ型胶原酶消化的方法处理SD大鼠幼鼠和新西兰兔膝关节软骨组织,测定不同代数的软骨细胞Ⅱ型胶原与ADAMTS5表达水平,观察并比较两种软骨细胞的培养特点。
材料与方法
一、实验主要试剂及仪器
DMEM 培养基(Gibco,美国)、胰蛋白酶(Gibco,美国)、Ⅱ型胶原酶(北京索莱宝科技有限公司,中国)、胎牛血清(FBS,Hyclone,南美)、台盼蓝(Sigma,美国)、甲苯胺蓝(Sigma,美国)、Ⅱ型胶原多克隆抗体(Abcam,美国)、Alexa Fluor 山羊抗鼠二抗(碧云天有限公司,中国)、Tizol 试剂盒(Invitrogen,德国)、逆转录试剂盒(Promega,美国)、SYBR Green qPCR试剂盒(Promega,美国);荧光倒置显微镜(OLYM⁃PUS,日本)、NanoPhotometer(Implen,德国)、二氧化碳培养箱(Thermo,美国)、低温台式离心机(Eppen⁃dorf,德国)、生物安全柜(力康生物医疗科技控股有限公司,中国)。
二、实验动物
10只出生2周、体重为10~14 g的SD大鼠幼鼠,2只出生4周、体重为400~450 g的新西兰兔,两者均雌雄各半,实验动物均来源于湖北医药学院实验动物中心[动物生产许可证:SCXK(鄂)2016⁃0008;动物使用许可证:SYXK(鄂)2016⁃0031],动物实验方案经湖北医药学院附属襄阳市第一人民医院伦理委员会批准,实验过程中对动物的处置符合中华人民共和国科学技术部颁发的《关于善待动物的指导意见》。
三、软骨细胞分离培养及观察
(一)SD大鼠幼鼠膝关节软骨细胞分离培养
选取2周龄的SD大鼠幼鼠10只,10%的水合氯醛腹腔注射麻醉后处死,消毒皮肤。无菌条件下剪开双侧膝关节,离断含有软骨组织的部位,置于盛有磷酸盐缓冲液(PBS)的培养皿中。用含青/链霉素双抗液的PBS冲洗2~3次,清除表面血污;用眼科剪及镊子逐层分离肌肉组织、骨性成分、软骨骨膜,仅保留透明软骨。分离所得软骨组织用PBS再次冲洗3~4 次后,移入生物安全柜,将软骨组织剪碎至1 mm3的大小,装入培养瓶,加入浓度为0.2%的Ⅱ型胶原酶,置于37 ℃、CO2体积分数为5%的恒温培养箱中消化1 h后,倒置显微镜观察,可见大量的软骨细胞和细胞外基质成分。机械吹打30 s 后,将细胞与未完全消化的软骨组织分离,静置5 min后,吸取上清液于15 ml离心管中,低温离心(1 500 rpm,10 min)。离心后所得的上清液重新加入培养瓶中。消化剩余的软骨组织分别于2 h、4 h后再次收集,用FBS体积分数为10%的DMEM 培养基重悬离心后沉淀的软骨细胞,轻轻吹打,使细胞悬液均匀分布,然后经300目不锈钢滤网过滤收获单细胞悬液,接种至10 ml培养瓶中置于恒温培养箱中培养,每隔2 d 换一次液,倒置显微镜观察并摄像。
(二)新西兰兔膝关节软骨细胞分离培养
选取4周龄新西兰兔2只,耳缘静脉注射空气处死,去皮消毒,无菌条件下分离两侧膝关节软骨,置于盛有PBS 培养皿中清洗表面血迹,后移入生物安全柜剪碎软骨组织至1 mm3大小装入培养瓶中,加入浓度为0.2%的Ⅱ型胶原酶消化2 h,显微镜观察,明显观察到大量软骨细胞分布于软骨组织周围,机械吹打30 s 后,将细胞与未消化的组织分开,静置5 min 后,吸取上清液于15 ml 离心管中,低温离心(1 500 rpm,10 min),弃上清,加入含10% FBS 的DMEM 培养基重悬,经300 目不锈钢滤网制成单细胞悬液,接种于10 ml 培养瓶中于培养箱中培养,倒置显微镜观察并摄像。
四、软骨细胞传代培养
5 d 后软骨细胞融合成片,排列成“铺路石”状,生长面积达培养瓶的80%~90%。弃去旧的培养液,用PBS液清洗3次,加入浓度为0.25%的胰蛋白酶置于恒温箱消化1~2 min 后,镜下观察贴壁细胞变得透亮,成圆形,个别细胞甚至漂浮,立即加入含10%FBS 的DMEM 培养基终止消化,吹打混匀,离心(1 000 rpm,3 min),弃上清,加入新的培养基重悬混匀,接种培养,按照1∶2比例传代,置于恒温箱培养。
五、细胞计数法测定软骨细胞生长曲线
用浓度为0.25%的胰酶消化原代培养的大鼠及兔软骨细胞,按照1×108/L 的相同密度接种于48 孔板,分9 组,每组设置3 个复孔,2 d 换液一次。从细胞培养的第2 天开始连续9 d,每天收集细胞,利用血球计数板进行计数,每个复孔计数2次,取细胞数的平均值作为结果,以培养时间为横轴,细胞数(对数)为纵轴,利用GraphPad Prism(Prism5,San Diego,美国)绘制大鼠软骨细胞的生长曲线。
六、实时定量PCR 测定软骨细胞中CollagenⅡ及ADAMTS5 mRNA的表达
取1⁃5 代培养的大鼠及兔软骨细胞,按照1×105/ml 的密度接种于6 孔板中,待培养48 h 后,每孔加入1 ml Trizol 裂解细胞。根据试剂说明书,提取总RNA,并使用NanoPhotometer 对RNA 进行定量。取2 μg 总RNA 通过逆转录试剂盒逆转为cDNA,使用SYBR Green荧光染料进行qPCR,过程如下:反应混合物包括4 μl cDNA 模板,10 μl GoTaq®qPCR Master Mix(Promega,美国),以及引物0.4 μl和5.2 μl无核酶水。程序设置包括95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火延伸1 min,设置40 个循环,以GAPDH 作为内参(表1),计算各组中CollagenⅡ及ADAMTS5的mRNA相对表达。

表1 大鼠及新西兰兔GAPDH、CollagenⅡ、ADAMTS5 基因序列
七、甲苯胺蓝染色
取第2 代软骨细胞按照1×108/L 的密度接种于12 孔板中,细胞培养2 d 后,融合面积达60%~70%。去除原培养液,用冰的PBS 冲洗2~3 次,加入体积分数为4%的多聚甲醛4 ℃固定2 h,去离子水冲洗5 min,加入质量分数为1%的甲苯胺蓝染色液2 ml,置于摇床常温浸染1~2 h,去原液,无水乙醇脱色,去离子水终止,倒置显微镜观察、摄像。
八、Ⅱ型胶原的免疫荧光染色
取第2 代的软骨细胞按照1×108/L 的密度接种于12孔板中,待细胞正常贴壁后,弃去原液,用PBS缓冲液漂洗3 min;加入体积分数为4%的多聚甲醛固定15 min,PBS 漂洗3 min;再加入质量分数为0.5%的TritonX⁃100 室温透膜20 min,随后再用PBS润洗3 次,每次静置5 min,弃去PBS,加入体积分数为10%的脱脂牛奶室温封闭30 min,吸去封闭液,加入足量的一抗4 ℃孵育过夜;第2 天回收一抗后用PBS润洗3次,每次静置5 min,避光滴加稀释好的荧光二抗(稀释比1∶100),常温避光孵育1 h,PBS 漂洗3 min;加入DAPI 避光孵育5 min 复染核,PBS 漂洗5次,每次4 min,洗去多余的DAPI染液,封固,荧光显微镜观察并摄像。
九、统计学分析
应用SPSS 19.0统计软件(IBM公司,美国)进行统计学分析,计量资料用均数±标准差()表示,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
一、细胞形态的比较
倒置显微镜观察原代分离培养出的大鼠软骨细胞贴壁前成圆形,漂浮于培养基中,细胞形态较小。培养6~12 h 后细胞贴壁,折光性高呈透亮状态,胞核为椭圆形,位于胞体中央,胞质丰富。24 h后大多数细胞完成贴壁,部分细胞逐渐伸展,形状发生改变,变为多角形或不规则形,散在均匀分布于培养基中(见图1 a),培养3 d 后,细胞增殖明显,融合面积约占瓶底的60%,相邻细胞间出现结节状的连接,周围伴有基质成分的沉积(见图1 b)。1周后,细胞铺满瓶底进行传代培养,传代后细胞贴壁时间明显缩短,增殖速度加快,约4 d左右的时间基本铺满。

图1 大鼠软骨细胞培养不同时间在光学显微镜下的形态 a:培养1 d(×100);b:培养3 d(×100);c:培养1 d(×200);d:培养3 d(×200)
与大鼠软骨细胞相比,原代培养的兔软骨细胞贴壁时间明显延长约12~24 h,其中大部分的细胞24 h 后才开始贴壁,贴壁的细胞多为三角形或不规则形,形态较大,胞质成分较多,核仁明显。细胞增殖相对缓慢且具有成簇生长的特点,约2 周左右才铺满瓶底(见图2 b)。
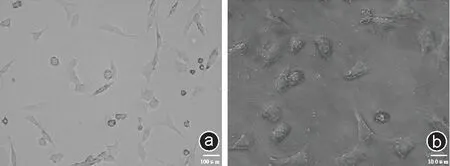
图2 大鼠软骨细胞与兔软骨细胞形态学比较 a:大鼠软骨细胞(×200);b:兔软骨细胞(×200)
二、软骨细胞生长曲线
原代大鼠软骨细胞接种后前2 d生长缓慢,细胞分裂增殖较少,处于细胞生长周期的潜伏期,第3天起细胞分裂增殖加速,构成生长曲线的对数增长期,直到第5 天后生长曲线逐渐趋于平稳达平台期;兔软骨细胞增殖明显滞后,生长曲线右移,其增殖高峰约第7天才出现(见图3)。

图3 大鼠软骨细胞与兔软骨细胞生长曲线的比较
三、不同代数软骨细胞Collagen Ⅱ、ADAMTS5 mRNA水平的比较
Collagen Ⅱ、ADAMTS5 表达水平可以代表软骨细胞活力的高低,通过比较不同代数的同种软骨细胞Collagen Ⅱ的表达水平发现,随着培养代数的增加,Collagen Ⅱ的mRNA 表达水平逐渐降低,AD⁃AMTS5的mRNA 表达水平逐步升高,表明软骨细胞的活力逐渐降低,逐步退化;进一步比较了相同代数的不同软骨细胞上述指标的表达差异,可以明显观察到大鼠软骨细胞较兔软骨细胞具有更好的活力,即Collagen Ⅱ水平更高而ADAMTS5 水平更低(见图4)。

图4 不同代数大鼠及兔软骨细胞Collagen Ⅱ及ADAMTS5 mRNA表达水平 a:大鼠及兔软骨细胞Collagen ⅡmRNA表达;b:大鼠及兔软骨细胞ADAMTS5 mRNA表达
四、软骨细胞的鉴定
(一)甲苯胺蓝染色
甲苯胺蓝染色可见大鼠软骨细胞胞质内存在蓝色异染颗粒,表明软骨细胞分泌了糖胺多糖(图5)。

图5 大鼠软骨细胞形态学鉴定 a:×100;b:×200
(二)Ⅱ型胶原免疫荧光染色
Ⅱ型胶原免疫荧光染色在不同波段的荧光激发下,大鼠软骨细胞胞膜及胞质呈现出清晰的绿色荧光表现为强阳性,兔软骨细胞呈现出强烈的红色荧光,细胞核为明亮蓝色,证实原代分离培养的软骨胞具有分泌Ⅱ型胶原的能力且分泌的胶原成分主要位于胞浆中[10](见图6)。
讨 论
一、软骨细胞分离培养方法的改良
传统方法上选择成年或胎鼠进行实验,所收获的软骨细胞活性较差且数量较少。本研究选用出生2周的幼鼠,克服了鼠龄过小,软骨成分含量较少的缺点,又尽量地减少了其他骨质成分的干扰。传统方法往往采用胰蛋白酶与Ⅱ型胶原酶消化法反复循环消化和离心获取软骨细胞,步骤相对复杂,细胞容易受损,活力差且容易发生污染[11⁃12]。实验改良技术单用Ⅱ型胶原酶进行消化,且突出机械分离的作用,缩短酶消化的时间,逐层机械分离,尽可能去除其他成分,有助于提高细胞纯度。分离后软骨块剪碎,增加与酶的接触面积,缩短酶的消化时间,获取具有高度活性的软骨细胞。酶消化后,分时间段收集,提高细胞获取量。收集过程中采用机械吹打,每次至少吹打2~3 min 有助于分离细胞与细胞外基质成分,滤网过滤后离心获取单细胞悬液。
二、大鼠软骨细胞和兔软骨细胞的分离培养
(一)选材比较
大鼠软骨组织和兔相比价格低廉,取材容易。选用出生两周的幼鼠,软骨成分相对较多,利用机械分离和Ⅱ型胶原酶消化后,可以极大地增加软骨细胞获取率;同时大鼠软骨组织细胞外基质成分含量相对较少,酶消化时间相应缩短,因此细胞的活性相对较高。
(二)培养比较
大鼠软骨细胞培养周期短,培养条件相对简单,经一个星期左右的时间就可以长满瓶底;反复传代培养后,细胞依然保持高度活性,细胞形态和原代细胞差异不大,而兔软骨细胞在传代培养五代及以上后,细胞形态发生明显改变,细胞活性明显下降,逐渐走向衰老的进程甚至部分发生了分化,失去了软骨特征[13⁃14]。进一步通过比较不同代数的软骨细胞标志性蛋白Collagen Ⅱ及ADAMTS5 mRNA 的表达水平,发现其表达特点与文献中介绍的一致[6],也与形态结构的变化一致,即随着传代次数的增加,细胞中Collagen ⅡmRNA 表达量逐渐降低,ADAMTS5 mRNA表达量逐渐升高,软骨特性逐渐减弱。
三、软骨细胞的培养与鉴定

图6 软骨细胞的Ⅱ型胶原免疫荧光染色鉴定 a~c:(DAPI, Collagen Ⅱ, Merge),大鼠软骨细胞;d~f:(DAPI, Collagen Ⅱ, Merge),兔软骨细胞
软骨细胞在体外的环境下,经过长期培养和反复传代容易出现分化不稳定的情况,逐渐转变为成纤维样细胞,失去表达Ⅱ型胶原的能力[15]。在培养的过程中,需要注意细胞接种的密度。低密度培养时,细胞易与基质失去联系,细胞因子无法提供反馈调节,出现反分化呈成纤维样细胞形态,导致合成Ⅱ型胶原的能力下降;高密度培养时细胞生长良好,有助于分泌因子维持其基本表型以及细胞新陈代谢,阻止和减缓细胞的反分化[16]。软骨细胞无特异性标志物,通过对其分泌的氨基多糖的甲苯胺蓝染色以及Ⅱ型胶原的免疫荧光染色,结合取材部位和培养观察可以鉴别[17⁃18]。实验中观察到经甲苯胺蓝染色的软骨细胞胞质内形成蓝色的异染颗粒表明氨基多糖成分的存在;Ⅱ型胶原免疫荧光染色通过抗原-抗体反应检测Ⅱ型胶原表达情况,结果显示细胞胞浆中呈现出强荧光信号,表明分离得到是能够分泌Ⅱ型胶原的软骨细胞[19]。
四、本研究的技术改良、不足及展望
本研究立足于比较大鼠及新西兰兔软骨细胞的培养以及生物学特性,重点关注两种动物相同取材部位的软骨细胞形态学特点、生长周期以及生物活性,发现随培养代数的增加,软骨细胞增殖能力逐渐下降,同时代表活性的Ⅱ型胶原的表达量也是逐渐降低,进一步说明了培养代数是制约软骨细胞活力的主要因素,同时发现大鼠软骨细胞相较于相同代数的兔软骨细胞活力较强,从而为软骨材料研发提供一定参考。但本研究也存在一定的缺陷,本研究仅仅停留在对于两类软骨细胞形态及分泌方面的研究,而对于两者的超微结构是否存在差异并未涉及,后续将通过电子显微镜进一步比较不同代数、不同来源的软骨细胞的结构差异,从而为揭示软骨老化提供理论依据。
