药源性帕金森综合征临床研究进展*
2020-08-10张晚霞安薇张明伟童欢夏飞
张晚霞,安薇,张明伟,童欢,夏飞
(江汉大学附属湖北省第三人民医院药学部,武汉 430033)
药源性帕金森综合征(drug-induced Parkinsonism,DIP)是由于药物导致纹状体内多巴胺递质含量减少或多巴胺受体被阻断,乙酰胆碱的兴奋作用相对增强,从而出现运动障碍、震颤、自主神经功能紊乱等一系列临床表现的综合征。20世纪50年代早期,DIP在医学界被首次认识,并认为其是抗精神病药物治疗的常见并发症[1-2]。后来随着药物的不断开发与应用,发现抗抑郁药、钙通道拮抗剂、胃肠用药、降压药和许多其他化合物也可导致DIP的发生[3]。已知DIP的危险因素包括自身因素(年龄、性别、遗传、合并认知障碍等)和药物因素(种类、剂量和疗程)。绝大多数DIP患者在停用药物后症状可逐渐消失,而少数患者停药后症状仍然持续,甚至进行性加重[4]。由于DIP的临床症状和体征与原发性帕金森病(idiopathic Parkinson’s disease,iPD)相似,容易引起误诊,因此给临床诊断与治疗带来一定困难。笔者在本文通过介绍DIP的定义及流行病学现状,临床常用药物诱发DIP的致病机制、临床特点以及防治策略,以期提高临床对DIP 的认识,做到早发现、早诊断、早治疗。
1 DIP流行病学及临床特点
研究发现,50~99岁年龄段人群DIP发病率每年约22.94:100000[5]。巴西的一项老年人(>64岁)社区调查结果显示,帕金森综合征的总患病率为7.2%,DIP是第二大常见病因(2.7%),仅次于iPD(3.3%)[6]。此外,鹿特丹的一项基于人口的队列研究发现12%帕金森综合征由药物引起[7]。而在一项全球调查中发现,约有15%患者在长期服用抗精神病药物后出现了DIP,其中60岁以上的患者超过50%[8-9]。提示患者的年龄和服用的相关药物可能是引起DIP的主要危险因素。多项研究证实,年龄是DIP的一个持续风险因素,在60~69岁患者中DIP的患病率为9.4%,在80~99岁患者中增至29.3%[10],其可能原因是随着年龄的增长黑质纹状体神经元的数量逐渐减少。此外,DIP在几项研究中都显示出明显的女性优势,提示雌激素可能抑制多巴胺受体的表达[11]。有学者发现,在DIP患者和其家族中人类白细胞抗原HLA-B44呈现高表达[12],表明遗传易感性也可能在DIP的发展过程中发挥重要作用。
DIP患者在服用诱发药物之前并没有帕金森综合征病史。这意味着DIP与iPD和其他与神经退行性病变或环境因素(如脑血管疾病、感染、创伤、肿瘤等)相关的继发性帕金森症具有区别。在神经病学和运动障碍临床实践中,DIP可能只占所有类型帕金森综合征的4%~6.8%[13],但DIP和iPD的临床特征类似,因此经常出现误诊的现象。DIP的临床特征可归纳:①有明确的用药史;②患病以高龄和女性多见(iPD男性发病率高);③起病较快,发展迅速;④双侧起病,少数患者单侧症状严重(iPD症状多为单侧);⑤症状具有可逆性,停药后症状逐渐改善;⑥对治疗帕金森病的药物不敏感(见表1)。
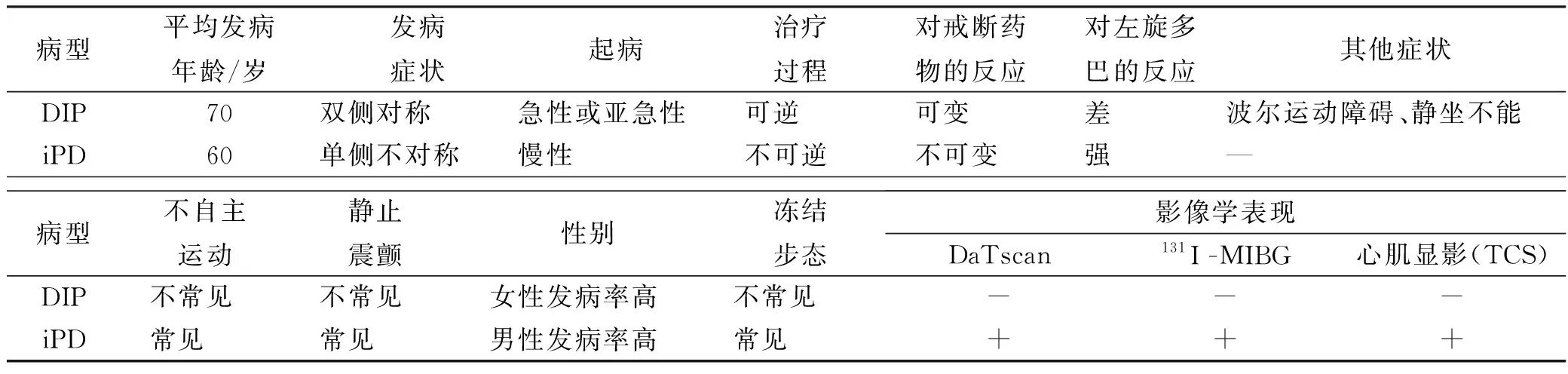
表1 药源性帕金森综合征和原发性帕金森病的临床特点
在临床诊断中,经颅超声波检测出现持续性黑质高回声可作为iPD诊断的有效指标[14],也可作为鉴别iPD和DIP的方法之一。131I-间碘苄胍心肌显像可用于直观地评估iPD患者心脏交感神经的功能和完整性。研究表明,该显像手段有助于iPD早期诊断和iPD与DIP的鉴别[15]。此外,多巴胺转运蛋白扫描技术(dopamine transporter scanning,DaTscan)也是目前临床诊断iPD较新的检测手段,是一种探测突触前黑质纹状体系统完整性的成像技术[16]。2016年被FDA正式批准用于帕金森综合征的检测。在某荟萃分析中证实,DaTscan可以准确区分早期iPD和DIP,并认为是鉴别iPD和DIP的最有效方法[17]。
2 诱发DIP的药物及致病机制
诱发DIP的药物可根据其相对风险进行分类(表2)。某些药物具有较高的致病风险,其致病机制已得到确认。例如经典的抗精神病药物和其他多巴胺受体阻断剂(如胃肠道动力药)。但仍有许多可诱发DIP的药物其致病机制尚有待进一步确证。

表2 诱发药源性帕金森综合征的相关药物
2.1抗精神病类药物 20世纪50年代,氯丙嗪作为第一个被发现的抗精神病药物,开创了药物治疗精神疾病的历史。但随着该药在临床的广泛使用,很快就被发现其可能会引起包括帕金森综合征等一系列的锥体外系反应(extrapyramidal side effects,EPS)。研究表明,接近80%的EPS是由于服用此类药物,而其中DIP发生率达到25%[18]。精神病的发生主要因为中脑和边缘系统多巴胺通路D2受体增加引起多巴胺能神经功能亢奋。典型抗精神病药物通过抑制中脑边缘系统多巴胺能的传递发挥作用,另一方面又因为阻断黑质纹状体通路多巴胺受体,使多巴胺-乙酰胆碱功能失衡,胆碱能神经功能相对亢进,而导致帕金森综合征的发生。随后利培酮、奥氮平、奎硫平和氯氮平等非典型抗精神病药物被逐渐发现,它们由于能选择性地阻断中脑-边缘系统的多巴胺受体,而对纹状体多巴胺受体阻断作用不明显,因此比典型抗精神病药物的致EPS风险更低。非典型抗精神病药物同样也可以阻断5-羟色胺受体,而这种双重阻断作用将降低DIP发生风险[19]。有研究发现,非典型抗精神病药物的致EPS风险氯氮平<奎硫平<奥氮平[19]。但需要引起重视的是,非典型抗精神病药物在使用中、大剂量时,也会产生较高的DIP风险[20-21]。因此,推荐临床应尽量小剂量使用非典型抗精神病药。
2.2钙通道阻滞药 有研究报道,长期使用某些钙通道阻滞药(桂利嗪、氟桂利嗪)的老年患者都伴有僵直、震颤或运动障碍等帕金森病症状,且发生率近30%[22]。患者在使用氟桂利嗪后出现迟缓性运动障碍,在停药1个月后会有所缓解[23]。研究中发现,2000年至2005年在中国台湾地区接受氟桂利嗪或桂利嗪治疗的患者中有2.9%的患者被诊断为帕金森综合征,同时高龄、卒中和糖尿病被认为是重要的危险因素[24]。此外,氟桂利嗪诱发的DIP潜伏期不等,从服药数周至数月,长则数年,导致临床诊断难度增加[25]。此类药物对多巴胺受体并没有阻断作用[26],其诱导DIP的确切机制目前尚不明确。研究发现,氟桂利嗪可激活黑质内的小胶质细胞,导致黑质内多巴胺能神经元免疫活性降低,最终致多巴胺能神经元的损伤,但这种损伤是可逆的[27]。也有假说认为,氟桂利嗪可能是通过降低由钙调蛋白调控的多巴胺β-羟化酶活性来发挥突触前作用[25]。此外,临床常用于治疗心绞痛的钙通道阻滞剂曲美他嗪也被报道可诱发DIP。在2004年某病例报告中共有8例患者,6例女性和2例男性,平均年龄80岁,长期服用曲美他嗪期间罹患帕金森综合征,但均在停药后症状好转[28]。这是曲美他嗪诱发帕金森综合征的首次报道,随后亦有大量案例报道证实曲美他嗪可诱发DIP。
2.3胃肠道动力药 胃肠道动力药在临床主要用于治疗上消化道运动障碍。常见的能诱发DIP的胃肠道动力药包括甲氧氯普胺、左舒必利、多潘立酮等。甲氧氯普胺是引起DIP最常见的一种药,其引起的DIP已得到临床医师的重视。DE RONDE 等[29]报道了3例关于甲氧氯普胺诱发的DIP案例,其中2例在停药1个月后康复。在另一案例中,患者在服用甲氧氯普胺后,帕金森综合征症状进一步恶化[30]。此外,左舒必利在一些亚洲和欧洲国家广泛用于治疗恶心、呕吐和功能性消化不良,目前已证实左舒必利可通过阻断肠道多巴胺受体诱发DIP[31]。它们除了与末梢器官的受体结合外,还可通过阻断胃腹膜区多巴胺受体产生止吐作用,拮抗中枢多巴胺受体,导致高泌乳素血症、EPS等不良反应。虽然甲氧氯普胺和左旋舒必利具有相同的作用机制,但其不良反应表现不同,其原因还尚待阐明。而多潘立酮在致DIP风险问题上被认为是相对较为安全的药物,甚至包括帕金森综合征患者,其主要原因可能是血-脑屏障的阻碍[32]。尽管多潘立酮致DIP不良反应很罕见,但也有发生急性肌张力障碍的报道[33]。因此推荐临床优先使用较难透过血脑屏障的药物如多潘立酮、法莫替丁等。
2.4抗癫药 大量报道证实抗癫药丙戊酸钠在长期使用后可导致帕金森症状。研究发现丙戊酸钠诱发DIP的发病率约为5%,患者没有服用抗精神病药或其他已知会导致EPS的药物,并服用丙戊酸钠至少一年。当患者停用丙戊酸钠后,70%DIP患者病情明显好转,所有患者的多巴胺转运体均正常[34]。在iPD患者中呼吸链相关线粒体酶(烟酰胺腺嘌呤二核苷酸、辅酶Q10、还原酶等)都存在功能缺陷[35]。丙戊酸钠致DIP的机制尚未明确,有研究认为是由于该药物导致氧化应激和线粒体呼吸链功能障碍。另一种机制可能是丙戊酸钠能增强脑内抑制性递质γ-氨基丁酸(γ-aminobutyric acid,GABA)的功能,而此现象在iPD患者中也存在[36]。另有报道证实巴比妥类抗癫药物苯巴比妥也可诱发DIP,其致病机制也可能是增强了GABA的抑制作用[37-38]。
2.5其他药物 随着新药的不断开发应用以及人们对DIP的逐步重视和关注,越来越多的可诱发DIP的药物被逐渐报道。例如,抗老年痴呆药物多奈哌齐,其致病机制可能是通过减少乙酰胆碱酶诱导的水解反应,增加乙酰胆碱的含量,导致纹状体多巴胺-乙酰胆碱失衡,而诱发DIP[39]。某病例报告介绍1例75岁女性,因接受乳腺癌治疗术后服用曲马多诱发帕金森综合征,在服用左旋多巴1周后治愈。同时指出高龄和女性是导致DIP发生的两大主要风险[40]。曲马多除了具有镇痛作用外,还具有抗抑郁作用,可抑制去甲肾上腺素和5-羟色胺再摄取,这可能是其诱发DIP的机制。此外,另一种抗抑郁及焦虑药物艾司西酞普兰也被认为可导致DIP的发生,报道称1例29岁男性患者在开始服用艾司西酞普兰(10 mg·d-1)2周后,出现震颤、僵硬、行动迟缓、言语障碍以及假面等症状,而患者在服用4 mg·d-1的比哌立登4周后治愈[41]。艾司西酞普兰可能是通过5-羟色胺再摄取抑制多巴胺能系统诱导DIP的发生。此外,有报道抗肿瘤药物沙利度胺和来那度胺也可致DIP的发生,但其症状在停药后均可消失[42-43]。免疫抑制剂他克莫司和环孢素也分别被报道可导致DIP的发生[44-45],1例患者原位肝移植术后使用他克莫司连续免疫抑制剂治疗,由于观察到震颤相关的症状,被诊断为DIP,但该患者停药后其临床症状得到改善[44]。RIFAIE等[46]证实他克莫司可诱发DIP的发生。最新案例报道提示,二甲双胍可导致脑病变患者发生表现为帕金森样症状,而停用二甲双胍后症状和体征都得到改善[47]。抗病毒药拉米夫定也被报道可致小儿EPS,1例9岁和1例11岁男孩在服用拉米夫定后分别表现出痉挛性斜颈及肌紧张增高,但在停药后其症状均消失[48],致病机制可能是拉米夫定代谢物通过血-脑屏障后阻滞突触后多巴胺能受体功能而引起。抗生素两性霉素B被报道可导致DIP发生,但其具体致病机制尚不明确[49]。近年来有报道称他汀类药物使用与帕金森病风险增加具有相关性。曾经许多研究表明应用他汀类药物可能降低帕金森病发病率,但目前研究发现他汀类药物对帕金森患者的保护作用非常微小[50]。研究者通过分析2008—2012年MarketScan商业索赔和冲突资料库中的数据发现,降脂药物的使用包括他汀类或非他汀类药物,均与帕金森病发生率显著增加相关([OR],1.61~1.67;P<0.0001),且他汀类药物治疗后早期的风险最高(<1年,OR=1.93;1~2.5年,OR=1.83;≥2.5年,OR=1.37;P<0.0001)[51]。原因可能是他汀不仅能够阻断胆固醇的合成还会妨碍细胞功能所必需的辅酶Q10的合成。
虽然随着DIP逐渐被人们所重视,有较多诱发DIP的药物被报道,但目前尚还存在许多潜在的DIP诱导药物。进一步对相关高风险药物说明书进行筛查发现,有较多药物在说明书中标识可致震颤发生,但目前尚无相关病例报道。如抗抑郁药物曲唑酮、帕罗西汀、氟伏沙明、氟哌噻吨美利曲辛、文拉法辛;抗癫药物:苯妥英钠、左乙拉西坦、托吡酯、卡马西平、奥卡西平;镇静催眠药物:阿普唑仑、艾司唑仑、地西泮、氯硝西泮、劳拉西泮等。提示在使用该类药物时应时刻警惕DIP的潜在发病风险,做好适当的防御措施。
3 治疗与预防
随着DIP发病率的逐年增加,如何有效预防药物诱发帕金森综合征已成为目前亟待解决的问题。目前DIP的发生多与药物使用剂量和疗程有关,但也存在个体差异的现象,发生DIP应及时停药,严重时应选用适用药物对症治疗。虽然DIP在停药症状可能得到缓解,但要警惕快速停药后引起的帕金森高热综合征[52]。如果在患者不能停药的情况下,左旋多巴、抗胆碱能药物、多巴胺受体激动剂、金刚烷胺可能对缓解DIP症状有一定作用,另外电休克治疗也可减轻DIP的症状[53]。由于DIP的治疗较为困难,因此预防显得极为重要[54]。本文对于DIP的预防提出以下建议:①明确患者药物不良反应史;②避免使用已知会引起DIP的药物,或者可以用更安全的药物替代;③必须使用时,应给予小剂量,疗程不宜过长,并应严密监控服药过程中患者的状态;④高龄和女性患者在服用该类药物时更应谨慎;⑤注意哺乳期患者的用药状况,密切关注幼儿的EPS风险;⑥避免风险药物的联合贡献。
4 结语
近年来,新药的不断研发使得药物不良反应在被逐渐改善,例如新一代的抗精神病、抗抑郁和胃肠道药物所引起的DIP发生率在逐渐降低,但是依然存在风险。对此DIP的早期预防和正确诊断显得尤为重要。虽然DIP已成为一种常见的具有潜在致残性的疾病,尤其是针对老年人,但事实上DIP却因为其症状的可逆性而时常被临床忽视。同时DIP也常与iPD混淆,而导致药物的不当使用,具有潜在的有害影响。因此临床医师与药师应在DIP的诊断、预防、管理上做出更大的贡献。
