氩氦冷冻消融治疗肝癌术中实时温度监测对邻近重要组织的作用研究
2020-08-10李秀莉郑峥张玲玲薄常文梁献伟李娜安永辉
李秀莉 郑峥 张玲玲 薄常文 梁献伟 李娜 安永辉
随着国内外肝脏肿瘤临床研究的进展,肝脏肿瘤的治疗方式除传统的手术、放化疗等治疗外,微创治疗也取得了巨大的进展。越来越多的微创治疗应用于临床,例如冷冻消融、射频消融、微波消融、酒精注射、血管介入等手段[1]。冷冻定位和监测手段的发展使穿刺靶组织定位更准确,冰球能完全包裹病灶,但是只有温度达到-40℃或更低才能确保肿瘤完全冷冻坏死,对于较大的肿瘤冷冻周边温度难以达到癌细胞死亡的有效低温,这是导致肝癌冷冻后复发的主要原因[2]。为了克服这个问题,临床上常采用扩大冷冻范围,使冷冻边缘超过肿瘤>1 cm,但这样会加重周边正常组织的损伤,尤其对于邻近重要脏器的肝癌患者。本文主要就氩氦刀冷冻治疗肝癌术中实时温度监测对邻近重要组织的损伤及并发症的预防意义进行研究。
1 资料与方法
1.1 一般资料 选取2015年2月至2017年10月河北医科大学第一医院肿瘤科入院的肝癌患者。选择2015年2月至2017年10月于我院接受诊断和采用氩氦刀靶向冷冻治疗的肝癌患者121例,共268个病灶。见表1。

表1 患者一般资料 例(%)
1.2 纳入与排除标准
1.2.1 纳入标准:①年龄≥18岁;②病理或临床诊断为原发性或继发性肝脏恶性肿瘤患者;③影像学显示肝脏肿瘤部分侵及邻近胃肠道、胆囊或膈肌等组织;④患者及家属愿意接受CT引导下经皮穿刺肝癌氩氦刀冷冻治疗。
1.2.2 排除标准:①全身状况差,无法配合手术体位,有严重出血倾向者;②弥漫性肝恶性肿瘤者;③肝功能评价为Child C级者;④凝血功能明显异常者。
1.3 研究方法
1.3.1 仪器与设备:冷冻设备采用美国Endocare公司生产的Cryocare氩氦刀微创冷冻靶向消融系统。主要由主机工作站、冷刀和测温电偶组成。含有4支超导刀,调节温度的范围局限在超导刀尖端2 cm内,可输出高压常温氩气(冷冻模式)或高压常温氦气(升温模式),氩气的温度可在十几秒内达到-100℃~145℃,并恒定在-135℃~145℃,并配备穿刺测温探针系统;64排大孔径CT引导(飞利浦公司);心电监护仪(迈瑞医疗)。
1.3.2 手术方法:根据肿块形状和部位,患者采用平卧位、侧卧位、颈伸卧位,常规消毒铺巾,0.5%利多卡因10~40 ml,于穿刺定位点行局部浸润阻滞麻醉。在穿刺点处切开皮肤0.5 cm,依据术前定位片所提示的进针方向、角度、深度,将氩氦刀快速刺入肿瘤靶点,经CT显示穿刺针达预定位置为准。如整个冷冻过程仅需1把刀冷冻,则直接启动氩氦超低温冷冻手术系统。如需插入2把以上氩氦刀,则将已插入的氩氦刀暂时冷冻固定,再将所需插入的冷刀按前述方法分别插入瘤内设计靶位。于肿瘤外缘胃壁、肠管、胆囊、膈肌等组织旁分别插入测温探针。冷刀及探针均到位后,检查校对无误,同时启动超低温手术系统快速冷冻,温度恒定在-135℃~145℃,冷冻时间为15~20 min,冰球超出肿瘤边缘0.5 cm为最佳时机停止冷冻。启动加热系统,当温度上升至0℃时,重新启动超低温手术系统,实行第二循环冷冻,冷冻时间同首循环。在冷冻过程中监测冰球温度的变化,实时监测测温探针的变化。治疗结束,当氦气复温至>8℃时,氩氦刀与冰球松动后即可拔出氩氦刀。局部压迫止血,加压包扎。术后行常规CT扫描,了解冷冻效果、冰球大小以及有无胃肠道周围组织损伤、出血等并发症。
1.4 观察指标
1.4.1 肿瘤邻近正常组织边缘(胆囊、胃壁、肠管、膈顶)的温度变化监测:治疗过程中将温度探测仪贴近正常组织边缘,进行实时温度监测,记录冰球形成过程中,正常组织的温度变化。正常内脏器官肝脏温度最高约为38℃,冷冻消融冰球中心温度约-145℃,冰球边缘温度约为0℃,冷冻使组织坏死的临界温度是-40℃~-20℃。
1.4.2 观察术后并发症情况以及与术中邻近组织温度的关系:术后患者可能会出现出血、发热、感染、恶心呕吐、上腹疼痛、肝功异常、皮肤冻伤、冷反应等并发症,肿瘤处于高风险部位可能会出现严重的并发症,例如胃穿孔、胆肠瘘、休克等。术后积极给予患者对症处理,一般并发症会在1周内消失。对于出现并发症的患者观察术中记录的探针温度变化情况,并与未出现相关并发症的患者比较温度的高低。
1.5 近期疗效评价 目标病灶局部消融疗效评估采用mRECIST标准(modified RECIST criteria)。(1)完全缓解(CR):所有目标灶动脉期增强显影消失,持续时间至少>4周;(2)部分缓解(PR):目标病灶动脉期增强显影的直径总和缩小≥30%,持续时间至少>4周;(3)疾病稳定(SD):动脉期增强显影的病灶长径总和有缩小,但未达PR或有增加但未达PD;(4)疾病进展(PD):目标病灶动脉期增强显影的直径总和增加≥20%或出现新病灶。客观缓解率=(CR+PR)/总例数×100%;局部控制率=(CR+PR+SD)/总例数×100%。
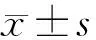
2 结果
2.1 冷冻过程中肿瘤临近正常组织边缘(胆囊、胃壁、肠管、膈顶等)的温度监测 在冷冻消融之前肝脏平均温度为(37.8±0.1)℃,贴近胆囊的温度探针平均温度为(37.5±1.3)℃,贴近胃壁的温度探针平均温度为(37.2±1.9)℃,贴近肠管的温度探针平均温度为(37.6±2.4)℃,贴近膈顶的温度探针平均温度为(36.9±2.8)℃,监测冷冻过程中冰球达肺瘤边缘时、达温度探针时、达肺瘤边缘超出0.5 cm时的探针温度,经非参数检验得出当冰球超出肿瘤边缘0.5 cm时,即冰球已触及正常组织时,4组邻近组织的温度差异有统计学意义,且温度中位数分别是邻近膈肌>胃壁>胆囊>肠管(P<0.05);而冰球达肿瘤边缘时和达温度探针时,4组邻近组织的温度差异无统计学意义(P>0.05)。见表2。

表2 冷冻过程中温度探针随冰球大小的变化
2.2 mRECIST标准评价近期疗效 本研究共冷冻消融268个病灶,冷冻治疗结束后1个月复查强化CT,根据不同部位不同病灶数,客观缓解率为83.21%,局部控制率为99.25%。见表3。
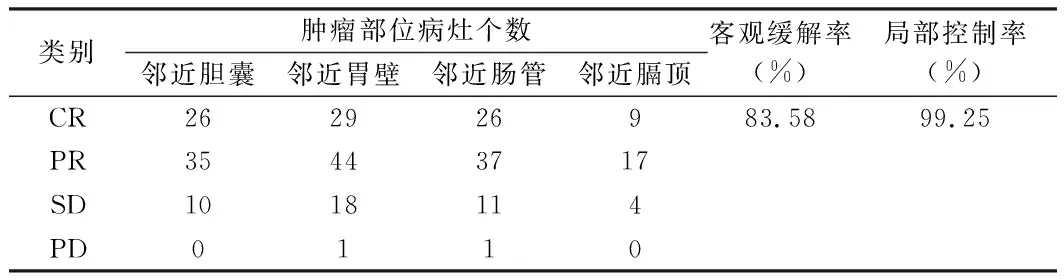
表3 冷冻治疗的近期疗效 个
2.3 术后并发症发生与探针温度的关系 出现恶心呕吐、上腹疼痛以及皮肤冻伤的患者,邻近组织的温度明显低于未出现并发症的患者(P<0.05),而其他并发症的发生与邻近组织的最低温度差异无统计学意义(P>0.05)。对于出现冷休克以及胆肠瘘患者各1例,无法进行统计学分析,但出现这2个并发症的患者,邻近组织的探针温度最低。见表4。
3 讨论
肝癌是消化道最常见的恶性肿瘤之一,由于肝细胞储备不良、多中心肿瘤和肝外疾病等因素,很大比例的肝癌患者不适合肿瘤切除[3,4]。对于不适合手术或肝移植的肝癌患者,冷冻消融一直是一个优先的选择,其中氩氦冷冻消融术是临床应用最广泛的冷冻治疗技术[5]。从技术上讲,多器官肿瘤的冷冻切除,如肝、肺、肾、乳腺、胰腺和前列腺已被证明是安全有效的[6]。然而,当肝癌病灶靠近胆管、胃肠道、胆囊和膈肌等结构时,应谨慎行消融,以免损伤这些结构。
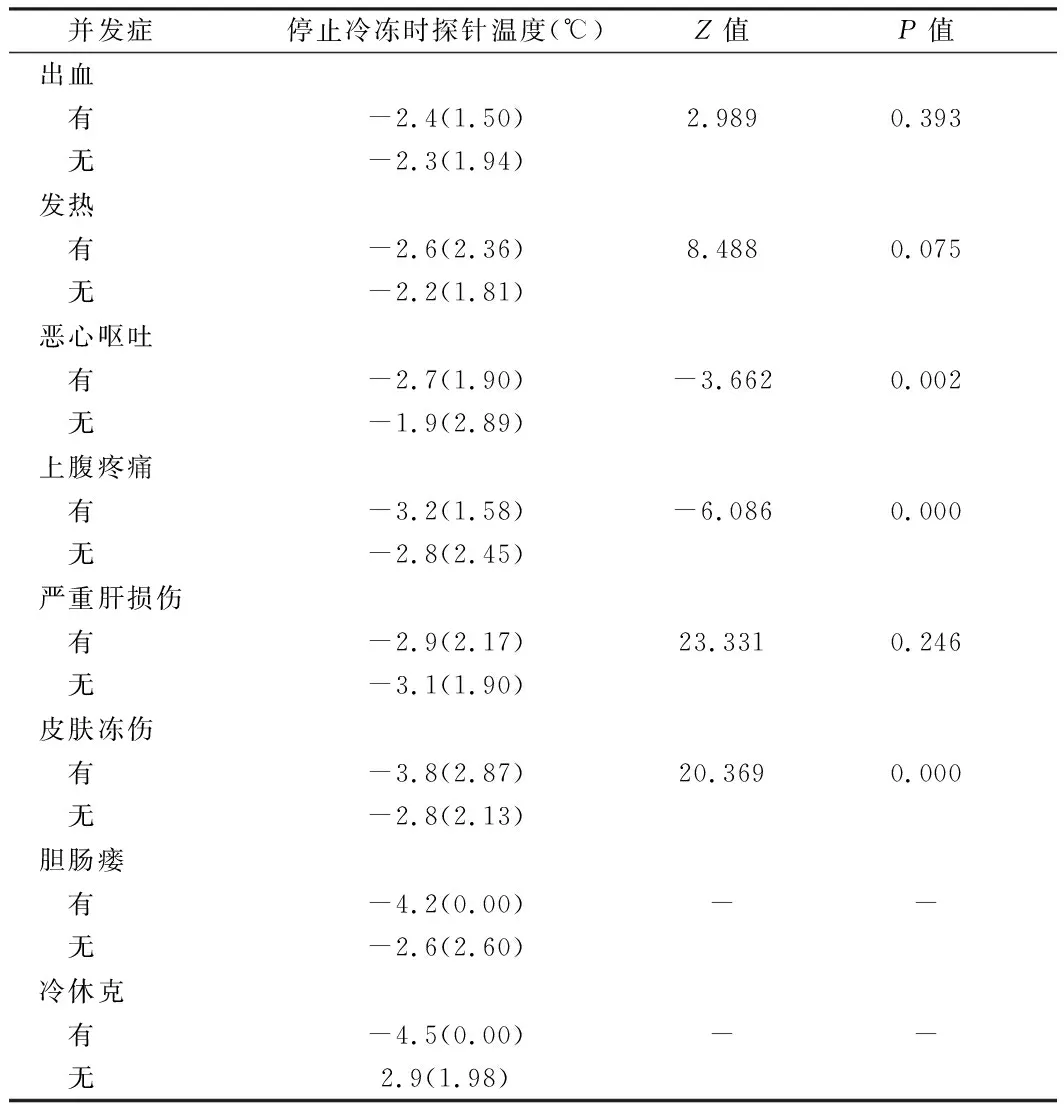
表4 术后并发症的发生与停止冷冻时探针温度之间的关系
影响冷冻效果最主要的三大技术参数为冷冻速度、冷冻循环次数以及最低温度和时间。影响因素中最重要的是最低温度及其保持时间。有研究者指出,采用双次循环的冷冻坏死温度是-41.4℃,而单次循环冷冻温度<-61.7℃,肿瘤细胞可彻底坏死或凋亡,单次及双次冷冻产生的坏死区半径分别是4.1 mm和6.0 mm[7],因此双冻融循环显著增加细胞损伤程度。在一项动物研究中,对猪的肝脏冷冻消融后冰球和坏死区之间的关系进行评估,可见冰球的边缘与坏死区之间约有1.1 mm的间隙[8]。这意味着我们的冰球大小高估了真正坏死区的大小。这种冰球和坏死区之间的差异是由于细胞的致死温度造成的。在动物肝脏的实验中,作者坚持认为组织温度在-20~-15℃范围内足以破坏正常的肝脏组织[9,10]。然而,细胞对冻伤有不同的敏感性。一些恶性细胞在-40℃的温度下对损伤具有抵抗力[11]。尽管对致死温度有各种不同的看法,但认为-20℃足以引起水样变性或组织的坏死[12,13]。
本研究中冰球已触及正常组织时,邻近组织的中位数温度由大到小排序依次为膈肌>胃壁>胆囊>肠管。众所周知胆囊壁比肠管壁更薄,但温度却比肠管的高,这可能因为胆囊因胆汁的存在如同血管的热池效应而使胆囊壁的温度稍高于肠管。在Fairchild等[14]的研究中,冰球延伸至胆囊管腔(平均距离可达6 mm),但即使冰球延伸至1.8 cm至胆囊管腔,也没有发生胆囊穿孔的病例。这可能是由于胆囊内的胆汁可能会消散胆囊窝周围探针的冷却作用。但是,随着胆囊壁的进一步冷冻,胆汁的“消散作用”极度减弱,局部自限性炎性反应导致胆囊壁水肿和反应性积液,进而加重了胆囊损伤的严重程度[14]。Lee等[15]研究发现,射频消融术的面积与胆囊毗邻的肝脏可导致严重的并发症,包括胆囊穿孔,尤其是在没有保持安全距离的情况下进行消融时。此外,超声引导下经皮微波消融术只有在严格的温度监测下才能安全应用于临近胆囊的肝脏恶性肿瘤[16]。冷冻消融与良好的温度控制相关,这允许准确定位坏死区域,并导致很少的副作用。因此,冷冻消融可适用于重要脏器附近肝脏病变的消融[17]。
在本研究中有恶心呕吐、上腹疼痛以及皮肤冻伤等并发症的患者,邻近组织的温度明显低于未出现这些并发症的患者,且均低于冰球达肿瘤边缘超出0.5 cm时的温度。低温休克可能与消融体积大的肿瘤有关。事实上,低温休克手术一般用于治疗>10 cm的肿瘤[18]。
当肿瘤突出肝表面、紧邻膈肌或重要脏器而人造腹水技术不能实施时,如术后黏连,推荐首先选择冷冻消融[19]。因此对于既往认为毗邻胃肠道、胆囊、肾脏等重要脏器的肝癌,会限制进针位置、冷冻时间和冰球大小的想法已经过时了,良好的温度监测手段可确保获得对肿瘤细胞达到最大限度的杀灭,并尽量减少对正常组织的损伤,避免或减少了并发症的发生,为冷冻消融提供了保障。
