miR-17靶向调控Akt2在抑制宫颈癌细胞增殖中的作用及机制研究
2020-08-10陈丹李媛媛赵俊
陈丹 李媛媛 赵俊
宫颈癌是发病率最高的妇科恶性肿瘤,高复发率以及高转移性是宫颈癌预后不良的主要原因,严重威胁着女性的身体健康[1]。近年来,尽管宫颈癌手术以及放化疗技术取得了很大的发展,但是中晚期宫颈癌患者预后仍然极差[2]。因此,进一步寻找宫颈癌发病的分子机制对于改善中晚期患者预后具有重大意义。近年研究发现,非编码RNA在肿瘤的增殖以及侵袭转移等恶性进程中起着关键调控作用,如miRNA以及lncRNA等[3-7]。微小RNA即miRNA,一类长链非编码RNA,其长度为19~25个核苷酸[8]。miRNA主要通过结合靶基因的3’非翻译区,调节基因转录后水平从而干预肿瘤的发生发展[9]。研究发现,宫颈癌细胞中亦存在较多差异表达的miRNA[10-13],这些差异表达的miRNA可能成为宫颈癌分子靶向治疗的潜在靶点。有研究报道miR-17在乳腺癌以及肺癌中均出现差异表达,且差异表达的miR-17与肿瘤增殖密切相关[14,15]。miR-17在宫颈癌细胞中表达显著降低[16],但其在宫颈癌中的发病机制尚未完全阐明。Akt又名蛋白激酶B(Protein kinase B,PKB),当前的研究结果表明AKT通路在细胞的增殖与凋亡过程中起着关键调节作用[17]。TargetScan软件预测结果表明Akt2为miR-17的靶向调控基因,因此我们猜测miR-17可以通过靶向调控Akt2/Foxo1A/Bcl-2通路抑制宫颈癌细胞的增殖。本研究以上述背景为基础,以Hela细胞株为研究对象,证实miR-17与Akt2的靶向调控关系,并通过多种实验验证miR-17靶向调控Akt2从而促进宫颈癌细胞增殖。
1 资料与方法
1.1 一般资料 收集2017年8~12月在我院行手术切除的宫颈癌患者手术标本23例,包括癌组织以及癌旁正常组织,入组患者均具有完善的病历资料。纳入标准:(1)初诊患者,术前无放化疗以及内分泌治疗史;(2)术后病理确诊为宫颈癌患者。排除标准:(1)合并其他恶性肿瘤如乳腺癌、卵巢癌等其他恶性肿瘤病史;(2)无心功能以及肝肾功能障碍;(3)合并传染病史如艾滋病、梅毒以及肝炎等。标本离体后30 min内切取新鲜的癌组织以及癌旁正常组织,并将其置于装有RNA保存液的冻存管中,放于-80℃冰箱备用。
1.2 主要试剂与仪器 miR-17 mimics、inhibitor及对照组NC(普健生物科技有限公司,武汉),蛋白酶抑制剂、PMSF(浩然生物技术有限公司,上海),Trizol试剂(Thermo Fisher公司,美国),BCA蛋白定量检测试剂盒(Thermo Fisher公司,美国),DMEM高糖培养基、RPMI1640培养基、胎牛血清以及胰酶(Thermo Fisher公司,美国),双荧光素酶活性检测试剂盒(北京艾然生物科技有限公司,北京),Akt2抗体(abcom,ab38513),内参GAPDH抗体(abcom,ab8245),Akt2的3’-UTR荧光素酶报告基因载体(introvigen公司,美国),qT-PCR试剂盒(天根生化科技有限公司,北京),RIPA组织裂解液(索莱宝科技有限公司,北京),TaqMan逆转录试剂盒(Takara公司,日本),RNA提取试剂盒(索莱宝科技有限公司,北京)。宫颈癌细胞株(上海生命科学院细胞和生物化学研究所)。
1.3 细胞培养 液氮中取出Hela细胞以及正常宫颈上皮细胞,37℃快速复温后离心(800 r/min,3 min),将加入1 ml含有10%FBS的培养基重悬后将细胞转移至25 cm2的小瓶中,继续加入3 ml培养基,并将其置于37℃、5% CO2的细胞培养箱中孵育。SiHa以及Hela细胞培养于含10%FBS的DMEM高糖培养基中,H8细胞培养于含10%FBS的RPMI1640培养基中。
1.4 RNA提取及qRT-PCR检测 (1)将收集的宫颈癌组织以及正常组织从-80℃冰箱取出并置于冰上,用镊子或剪刀钳夹适量组织块置于研钵中,加入少许液氮后用力将组织研碎,加入1 ml Trizol反复吹吸,尽量将组织全部转入无RNA酶的1.5 ml EP管中。加入200 μl氯仿,震荡混匀后室温静置15 min,离心(12 000 g,4℃,15 min),取上清,加入等体积异丙醇,室温静置10 min,离心(12 000 g,4℃,15 min),加入75%乙醇,震荡混匀后离心(8 000 g,4℃,5 min),弃上清,室温干燥15 min。10 μl DEPC水溶解RNA后,核酸检测仪检测RNA的浓度和纯度(A260/280值约2.0),将剩余的提取RNA立即放入-20℃冰箱保存备用。(2)取融合度>80%的SiHa、Hela以及H8细胞消化后,离心,弃上清,提取细胞总RNA,以上述提取的总RNA为模板,进行实时定量PCR技术,循逆转录试剂盒说明书操作,扩增28~32个循环后在实时荧光定量系统上检测各组的CT值并记录。G3PD为内参,每个样品设置3个复孔。
1.5 荧光素酶报告基因实验 取对数生长期的Hela细胞,荧光显微镜下玻璃板计数,取2×104个细胞接种于24孔板中,继续培养,待细胞融合度达80%时将Akt2的3’-UTR荧光素酶报告基因载体及对照组(NC)导入细胞,每组设3个平行孔,共分为4组:Akt2(野生型或突变型)与miR-17 mimics共转染组;Akt2(野生型或突变型)与对照组共转染组,细胞培养箱中培养24 h后弃去培基,PBS冲洗2次(PBS提前预冷),每孔加入100 μl 1×passive lysis Buffer,孵育15 min(室温),96孔发光检测板中加入待检样品,放入ModulusTM 发光检测仪中读数,计算相对荧光强度并进行统计学分析。
1.6 细胞转染 取0.25%胰酶消化融合度达80%左右的对数生长期细胞,将其制成单细胞悬液,接种于6孔板中,每孔1.5×105个细胞,将接种好细胞的6孔板摇匀后置于细胞培养箱中。8 h后转染。转染:A:更换1.5 ml无血清培养基,取5 μl lipofectamine2000转染试剂加入250 μl无血清混匀,室温静置20 min;B:取适量待转化合物加入至250 μl无血清培养基中;C:将A液与B液混匀后加入6孔板中。6 h后换成常规培养基,继续培养,待细胞融合度达80%左右时,收集细胞。qRT-PCR检测转染效果,继续后续实验。
1.7 MTS检测细胞 取转染48 h后的各组细胞,胰酶消化后将其制成单细胞悬液后计数,将细胞接种于以96孔板中(2×103个细胞),每个转染组细胞设6个复孔,放至培养箱中培养,分别在铺板后第0、1、2、3、4、5天各孔加入20 μl MTS工作液,培养箱中孵育2 h 后,酶标仪测定490 nm波长处各组细胞的吸光度 (OD值),重复3次实验。
1.8 细胞克隆形成能力检测 取转染48 h后的各组细胞,胰酶消化后接种于6孔板中(每孔300个细胞、2 ml 培养基),每组设置3个复孔,细胞培养箱中培养1周,各组孔重复加入转染试剂一次,继续培养1周,待观察到有克隆团形成时,弃掉培养基,PBS洗3次,甲醇固定15 min,去固定液后加入Giemsa染液染色20 min,流水冲洗后晾干,扫描拍照,计数肉眼可见克隆团。重复3次实验。
1.9 Foxo1A以及Bcl-2蛋白表达检测 采用Western-blot方法,收集转染48 h后的各组细胞,加入适量RIPA细胞裂解液裂解细胞(超声破碎仪裂解30 min);离心(14 000 g,4℃,30 min),BCA 法测定细胞蛋白浓度,计算50 μg样品的体积,加入总体积1/4的上样缓冲液与样品混匀后,将样品置于沸水中煮沸5 min后将样品置于-20℃冰箱保存备用。配胶,上样,跑胶,湿转法转膜后,8%脱脂奶粉封闭3 h,一抗孵育过夜,TBST洗涤1次,二抗(1∶8 000)孵育2 h,TBST洗涤3次后,化学发光底物曝光条带。GAPDH作为内参。
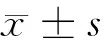
2 结果
2.1 miR-17在宫颈癌组织以及细胞系中的表达 qRT-PCR检测miR-17在宫颈癌组织与宫颈癌细胞株中的表达水平。结果显示:miR-17在宫颈癌组织中的表达水平明显低于周围正常组织,差异有统计学意义(P<0.05);与正常宫颈上皮细胞H8相比,miR-17在宫颈癌细胞株SiHa以及Hela细胞中表达明显低于正常宫颈上皮细胞H8,且在Hela中的表达最低;差异均有统计学意义(P<0.05)。见图1,表1、2。

图1 miR-17在宫颈癌组织、正常组织和宫颈癌细胞系中的表达
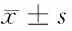
表1 miR-17在癌组织以及宫颈正常组织的表达
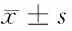
表2 miR-17在宫颈癌及正常细胞系水平
2.2 qRT-PCR检测细胞中miR-17的相对表达量 转染miR-17 inhibitor、miR-17 mimics 以及对照组转染细胞48 h后,收集细胞,RNA提取试剂盒提取细胞总RNA,qRT-PCR检测细胞内miR-17的相对表达量,结果显示:miR-17 inhibitor转染细胞中miR-17 的相对表达量较NC组显著降低,miR-17 mimics显著高于NC,差异有统计学意义(P<0.05)。说明miR-17 inhibitor和mimics作用较强,可以继续后续的功能实验。见表3。
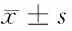
表3 不同处理条件下细胞内miR-17的表达水平
2.3 miR-17与Akt2的靶向调控关系 TargetScan软件预测结果显示miR-17与Akt2的3’-UTR区域存在互补结合位点。双荧光素酶报告基因检测结果显示:Akt2-wt与miR-17 mimics共转染组荧光素酶的活性明显低于Akt2-wt与阴性对照组共转染组;而Akt2-mut与miR-17 mimics以及阴性对照组间荧光素酶活性强度无显著差异。Western Blot结果显示,miR-17 mimics转染组的Akt2蛋白表达水平较对照组均显著降低,转染miR-17 inhibitor组Akt2蛋白的表达升高。qRT-PCR结果显示,miR-17 mimics转染组的Akt2 mRNA表达水平较对照组显著降低。差异均有统计学意义(P<0.05)。见图3。

图3 miR-17与Akt2的靶向调控关系
2.4 MTS检测细胞增殖 过表达或抑制miR-17的表达后,采用MTS法测定miR-17抑制剂组、过表达组和对照组细胞的增殖能力,结果显示从第1天开始,与对照组相比,miR-17抑制物组细胞生长速度明显加快,miR-7 mimics组细胞生长速度明显减慢,且2组均随时间的推移,活细胞数与对照组的差值有统计学意义(P<0.05)。见图4,表4。

图4 MTS检测转染Hela细胞miR-17抑制剂和mimics后1~5 d细胞增殖活性的变化;与对照组比较,*P<0.05
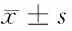
表4 不同处理条件下细胞增殖活性比较
2.5 细胞克隆形成能力的检测 过表达或抑制miR-17的表达后,采用平板克隆实验测定miR-17抑制剂组、过表达组和对照组细胞的克隆形成能力,结果显示与对照组相比,miR-17抑制物组细胞克隆形成能力明显增强,miR-7 mimics组细胞克隆形成能力明显减弱(P<0.05)。见表5。
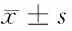
表5 不同处理条件下细胞克隆形成能力比较
2.6 流式细胞术检测miR-17对宫颈癌细胞凋亡的影响 分别转染miR-17 mimics ,抑制剂后,采用流式细胞术检测细胞凋亡率。结果显示:与对照组相比,转染miR-17抑制剂的Hela细胞其凋亡率为(1.34±0.25)%,较对照组(4.67±0.41)%显著降低;转染miR-17 mimics的细胞其凋亡率(12.36±1.23)%,较对照组显著升高。见图5,表6。
2.7 3组细胞Akt2、FOXO1A、Bcl-2蛋白表达水平比较 为了进一步阐明miR-17对Akt2、FOXO1A、Bcl-2蛋白表达的影响,分别转染miR-17 mimics和miR-17抑制物48 h后,收集细胞,Western-blot检测各组细胞中Akt2、FOXO1A、Bcl-2蛋白的表达水平,结果显示与对照组相比,转染miR-17抑制物的Hela细胞Akt2表达显著升高、FOXO1A以及Bcl-2表达显著降低,转染miR-17 mimics组细胞Akt2表达显著降低、FOXO1A以及Bcl-2表达显著升高。见图6,表7。

图5 流式细胞术检测细胞凋亡。转染miR-17抑制剂后,较对照组相比,细胞凋亡数显著降低,差异有统计学意义(*P<0.05);转染miR-17 mimics后,较对照组相比,细胞凋亡率显著升高(*P<0.05)
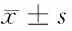
表6 不同处理条件下细胞凋亡率比较
3 讨论
近年来,随着社会的不断进步,医学进入了高速发展时代,基因检测技术的不断更新、靶向治疗以及内分泌治疗的不断改善,使得宫颈癌治疗向着精准化治疗方向迈进,然而,对于中晚期宫颈癌患者来说,其复发转移率仍然较高,预后不良。目前研究已经证实异常表达的分子或蛋白可能在促使肿瘤发生发展过程中起着关键调控作用。研究报道miRNA的表达异常与多种肿瘤的发生密切相关,包括肺癌、乳腺癌以及肝癌等[18-20]。因此,深入研究miRNA的功能及机制可能为肿瘤诊断、预后以及靶向治疗等提供潜在靶标。
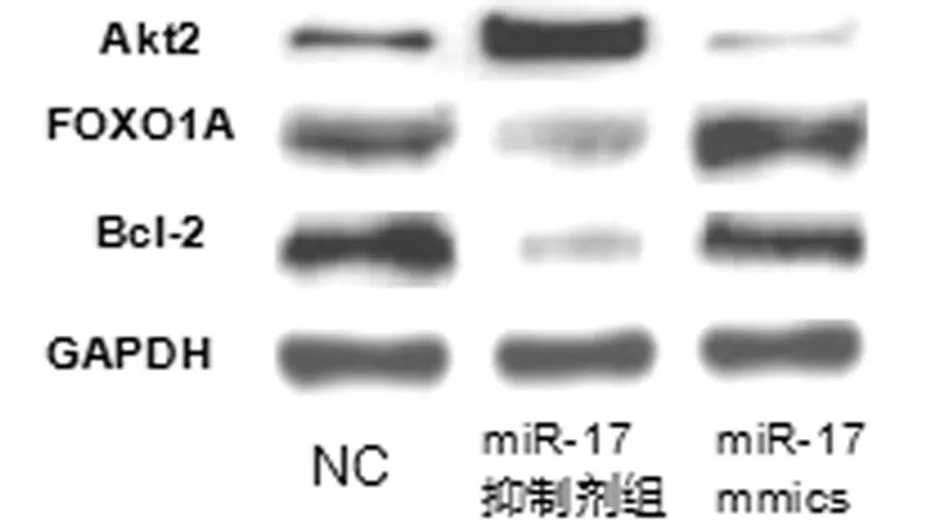
图6 Hela细胞转染miR-17抑制剂以及miR-17 mimics 后,Akt2、FOXO1A以及Bcl-2蛋白表达变化。转染miR-17抑制剂后,western-blot检测各组Akt2表达升高,FOXO1A以及Bcl-2蛋白表达显著降低,转染miR-17 mimics后细胞中Akt2表达降低,FOXO1A以及Bcl-2蛋白表达显著升高
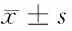
表7 不同处理条件下细胞Akt2、FOXO1A、Bcl-2蛋白表达水平比较
miR-17是miRNA家族中的一个成员,Liu等[21]发现miR-17在肝癌中的表达显著下调,Xu等[22]发现miR-17表达下调可以显著增强前列腺癌细胞对放疗的敏感性,令人关注的是Li等[23]发现miR-17可通过靶向调控ETV1抑制三阴乳腺癌细胞增殖。而最近研究也发现miR-17在宫颈癌中的表达显著降低,且与宫颈癌细胞增殖密切相关[24],但具体机制尚未完全阐明。Akt2是PI3K/Akt通路中的关键调节因子,其在细胞增殖、凋亡以及侵袭转移中起着重要作用。FOXO1A基因是叉头转录因子家族的重要一员,是PI3K/Akt通路下游的靶向调节因子,在细胞凋亡中起着重要作用[25]。B淋巴细胞白血病-2(B-cell lymphorma-2,Bcl-2)是目前已知重要的抗凋亡基因,同时也是FOXO1A下游的调节因子[26],Targetscan软件预测发现Akt2为miR-17的靶基因,因此本研究提出了miR-17通过靶向调控Akt2进而调控FOXO1A/Bcl-2通路干预细胞的增殖。本研究验证了miR-17在宫颈癌组织与癌旁组织,宫颈癌细胞株Hela和宫颈正常上皮细胞株H8中的表达情况,发现miR-17在宫颈癌组织中表达显著低于癌旁正常组织,且在宫颈癌细胞株Hela中的表达亦显著低于正常宫颈上皮细胞株H8;进一步采用miR-17抑制剂和mimics转染Hela细胞进一步研究miR-17在宫颈癌细胞增殖中发挥的作用,qRT-PCR检测发现转染miR-17抑制剂的Hela细胞中miR-17表达明显降低,MTS以及平板克隆实验显示细胞的增殖能力和平板克隆形成能力显著升高,细胞凋亡率显著降低;反之,转染miR-17 mimics细胞中miR-17表达明显增多,MTS以及平板克隆实验显示细胞的增殖能力和平板克隆形成能力显著降低,细胞凋亡率显著升高;上述结果提示低表达的miR-17促进宫颈癌细胞增殖。
为了进一步研究miR-17在抑制宫颈癌细胞增殖中的作用机制,我们采用双荧光素酶报告基因检测系统验证miR-17与Akt2的靶向调控关系,结果显示,较对照组相比,野生型Akt2与miR-17共转染组荧光素酶活性显著降低,由此可见,Akt2为miR-17的靶基因。此外,western-blot检测结果发现转染miR-17抑制剂组的Hela细胞Akt2蛋白表达升高,FOXO1A以及Bcl-2的表达显著降低,反之,miR-17 mimics转染组Akt2蛋白表达降低,FOXO1A以及Bcl-2的表达显著升高。由此提示,miR-17可通过靶向Akt2调控FOXO1A/Bcl-2通路抑制细胞增殖,促进细胞凋亡。
综上所述,miR-17在宫颈癌组织以及宫颈癌细胞株中的表达均显著降低,且Akt2是miR-17的靶基因。miR-17抑制剂处理组细胞Akt2蛋白表达升高,FOXO1A以及Bcl-2的表达显著降低,miR-17 mimics转染组Akt2蛋白表达降低,FOXO1A以及Bcl-2的表达显著升高。因此,miR-17可能是抑制宫颈癌细胞增殖的潜在靶向分子,为中晚期宫颈癌患者治疗提供新的思路。
