钙敏感受体与泌尿系疾病关系的研究进展
2020-08-10崔庆鹏罗云熊磊范世成朱元全李同海罗钰辉
崔庆鹏 罗云 熊磊 范世成 朱元全 李同海 罗钰辉
钙敏感受体(calcium-sensing receptor,CaSR)是一个C族G蛋白偶联受体,自从1993年首次被发现后,就受到了人们的重视[1]。目前,很多研究阐述了CaSR与心血管疾病[2]、肿瘤[3]及缺氧损伤[4]等的关系,但CaSR与泌尿系疾病的关系还未有系统的阐述。CaSR广泛表达于肾脏组织[5,6],与许多泌尿系疾病有着密不可分的联系。泌尿系结石作为一种全球性疾病,其发病率呈上升趋势[7],研究表明CaSR的过度激活可能是高钙尿症产生从而导致泌尿系结石形成的原因之一[8];美国最新的癌症统计表明前列腺癌是男性发病率最高(占所有癌症的20%)死亡率第二(占所有癌症死亡人数的10%)的肿瘤[9],因而引起了人们越来越多的重视。已有研究表明,CaSR的高表达可能与前列腺癌的发生及转移有关[10];肾癌为泌尿系发病率第三的肿瘤[11],现有的研究表明,CaSR高表达可能与肾癌的发生、发展有关[12],肾纤维化是所有肾脏疾病的终末期表现,延缓及逆转肾纤维化的进展是慢性肾脏病(chronic kidney disease,CKD)的关键,相关研究表明CaSR激活可能起到延缓肾脏纤维化的作用[13]。但目前关于CaSR在泌尿系各个疾病中作用机制的研究还不明确,也缺乏系统的阐述,本文就CaSR的基本结构及其功能以及其与泌尿系疾病关系的研究进展作一文献综述,为以CaSR为靶点的药物治疗提供一些理论基础。
1 钙敏感受体(CaSR)的结构与功能
1.1 CaSR的结构 钙敏感受体(CaSR)自1933年被Brown等[1]首次在牛甲状旁腺细胞发现后,越来越受到了人们的重视。人的CaSR基因位于3号染色体(3q21~24,chr3q13.3~21),由1 078个氨基酸残基组成。有7个外显子,2个启动子。两个启动子都受到了维生素D反应元件的调节[14],维生素D3可促进其表达。Tennakoon等[15]研究发现CaSR的拓扑结构由三部分组成:(1) 胞外区氨基结构域(extracellular N terminal domain,ECD),由612个氨基酸组成,呈亲水性,形成二聚体,是受体与激动剂互相结合的位点;(2) 跨膜结构域(transmembrane domain,TMD),由 250个氨基酸残基组成的7次跨膜区域,为 G 蛋白偶联受体家族的特征性结构,形成3个细胞内环和3个细胞外环,功能是进行细胞间的信号转导;(3)胞内羧基结构域(intercellular domain,ICD),由 217 个氨基酸组成,与G蛋白进行偶联,含有蛋白激酶 C(protein kinase C,PKC)和蛋白激酶 A(protein kinase A,PKA) 的磷酸化位点。通过一系列的信号通路转导影响细胞功能。CaSR广泛表达于甲状旁腺、肾脏、骨等组织,对体内钙稳态的调节起到了重要作用[16,17]。
1.2 CaSR的功能及其介导的信号转导通路 CaSR的主要作用是调节与维持细胞内外Ca2+的平衡与稳定,同时参与调控细胞的分泌、增殖、分化、趋化、凋亡等活动,并且在基因表达、维持膜电位、离子通道开关、衰老等过程中也起到一定作用[18-20]。
当血清钙离子升高时,CaSR被激活,抑制甲状旁腺激素(parathyroid hormone,PTH)分泌和1,25(OH)2D3的合成,并刺激降钙素(calcitonin,CT)的分泌,使血钙降低;反之,当Ca2+浓度过低时,CaSR活性下调,抑制降钙素(calcitonin)释放,促进PTH释放[21],血钙升高。
在细胞中,当Ca2+、Mg2+、Be2+等配体与CaSR胞外区氨基结构域结合后,使CaSR构象发生改变,激活G蛋白,活化的G蛋白可以激活磷脂酶C(phospholipase C,PLC),并催化磷酯酰肌醇二磷酸(phosphatidylinositalbiphosphate,PIP2)产生三磷酸肌醇(inositol 1,4,5-triphosphate,IP3)和甘油二酯(diacylglycerol,DAG),IP3和DAG分别促使内质网上IP3受体激活,钙离子通道开放,细胞内钙离子浓度上升[22](GaSR等G蛋白偶联受体介导的信号转导简单过程见图1)。作为一个重要的第二信使,胞质中Ca2+浓度升高后,结合钙调蛋白传递信号,激活钙调蛋白依赖性激酶,激活各种效应蛋白,在收缩和运动、物质代谢、神经递质的合成、细胞分泌和分裂、细胞凋亡等等众多生理过程中起到了重要作用[23]。
2 CaSR与泌尿系疾病
2.1 CaSR与泌尿结石 泌尿系结石是一种全球性疾病,近年来发病率在全世界范围内明显升高[7]。目前研究表明CaSR在泌尿系结石的形成中具有重要作用。泌尿系结石中80%以上为含钙的结石,且泌尿系结石患者中有40%存在着特发性高钙尿症[24]。肾脏中表达的CaSR在钙的重吸收中取到了重要作用。
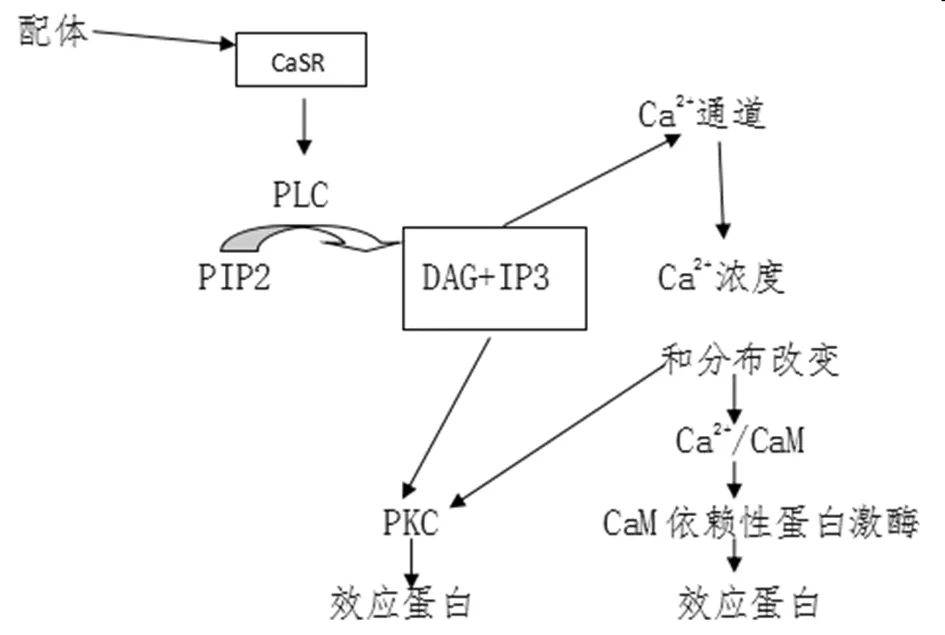
图1 钙敏感受体作用示意图
在近端小管(proximal tubule,PT),表达于近端小管刷状缘顶端膜上的CaSR通过调控1,25-(OH)2D3及抑制非甲状旁腺素依赖的1,25-(OH)2D3对钙的重吸收产生影响[25,26]。CaSR 一方面通过降低甲状旁腺素磷酸化增加近端小管对磷的重吸收; 另一方面通过抑制1,25-(OH)2D3的作用进而抑制钙的重吸[27]。
在髓攀升支粗段(thick ascending limb,TAL),大约一半的钙的重吸收通过经细胞转运途径进行,CaSR通过抑制甲状旁腺素减少这一途径钙的重吸收;另一半的钙则通过细胞旁途径进行重吸收,CaSR 可增加紧密连接蛋白14(The tight junction protein claudin-14,CLDN14/Claudin14)的表达水平而减少钙的重吸收[28]。
在远曲小管(distal convoluted tubule,DCT),CaSR激活可减少瞬时感受电位通道(Transient receptor potential cation channel subfamily V member 5,TRPV5)的表达,从而减少钙的重吸收[29]。
在集合管(ollecting tube,CT),CaSR 通过减少水通道蛋白2(quaponn-2,APQ2)的表达及增加质子泵的活性起到稀释、酸化尿液降低尿中钙的溶解性的作用[30]。因此肾脏组织表达的CaSR在维持肾脏中钙离子的稳定起到了重要作用。
王少刚等[8]研究发现遗传性高钙尿结石大鼠肾脏组织CaSR mRNA表达高于正常野生型大鼠,他们认为肾组织CaSR mRNA高表达及其第7外显子Glu1024Lys替换可能是特发性高钙尿症发病的分子机制之一。祝家兴等[31]研究表明含钙肾结石患者肾脏CaSR mRNA及蛋白表达均低于正常人。关于CaSR基因多态性与泌尿系结石的关系,目前的研究结果也不一致。Vezzoli等[32]认为CaSR基因突变并不会增加泌尿系结石形成的风险。谢坤等[33]研究也表明CaSR基因第7外显子第986、990多态性位点与泌尿系结石的形成无直接相关性。
国外一项荟萃分析表明,CaSR基因A986S多态性的SS基因型是亚洲人和PHPT患者尿石症的危险因素,却是白种人的保护因素[34]。R990多态性的GG基因型与尿石症的风险增加有关,特别是在白种人和健康人群中。关于尿钙浓度关联,具有G等位基因的个体具有比非携带者更高水平的尿钙。Shakhssalim等[35]研究也表明CaSR的第7个外显子中3个SNP (986S、990G、1011Q) 可以增加含钙结石的形成的风险。因此,目前关于CaSR的表达在泌尿系结石的形成中起促进作用或者是抑制作用还未有明确的结论。进一步的研究对阐明结石的病因及预防治疗可能有重要作用。
2.2 CaSR与前列腺癌 在西方国家,前列腺(Prostate,Pca)癌是男性患者肿瘤中发病率第一,死亡率第二的恶性肿瘤[8],严重威胁着老年男性的健康。我国前列腺癌的发病率虽然低于发达国家,但近年来呈上升趋势[36]。目前认为,前列腺癌的发展及骨转移与CaSR及Ca2+关系密切。其作用机制(图1)是配体与CaSR结合后,G蛋白结构域别构激活,引起PLC的激活,并催化PIP 2 产生IP 3 和DAG,DAG 诱导激活PKC,再激活Ras蛋白,进一步激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导途径[37];同时,CaSR也能激活MAPK途径的多种信号蛋白,例如氨基端激酶(c-Jun N-terminal kinase,c-Jun)、MAPK、p38(一种蛋白激酶)和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK);最后,CaSR还可以通过激活核转录因子кB信号通路、激活物蛋白-1的表达,从而影响细胞的多种生理活动。
有学者认为前列腺癌的发生发展可能是由Ca2+介导的信号传导增强导致的,细胞实验证明CaSR拮抗剂NPS2143和Calhex 231可抑制人前列腺癌细胞(PC-3细胞)增殖和迁移,并且使CaSR表达下调[10]。这表明CaSR抑制剂作为前列腺癌新型药物治疗的潜力。前列腺癌与钙离子通道阻滞剂已成为人们研究的热点之一。
钙通道阻滞剂可能通过减少前列腺细胞钙运输和增加钙的释放来抑制血管内皮生长因子的表达,从而使前列腺癌细胞凋亡[38,39]。Bernichtein等[40]在动物实验中研究表明高钙饮食通过促进细胞增殖,微侵袭,组织炎症和前列腺癌标志物的表达从而加速前列腺上皮内瘤变形成的进展。引人注目的是,膳食中的维生素D可以防止这些钙引发的致瘤作用。表达谱分析和体外机制研究表明,用细胞外Ca2+刺激PC-3细胞导致细胞增殖,人瞬时阳离子受体通道6(transient receptor potential protein family-6,TRPC6)和CaSR表达的增加。而给予活性维生素D代谢物钙三醇逆转了所有这些效果,且可以在钙刺激的PC3细胞中沉默CaSR和TRPC6表达,降低癌细胞的增殖。Huang等[41]研究表明细胞外Ca2+促进雄激素受体缺陷和高转移性前列腺癌细胞系(DU145和PC-3)的迁移,并且还表明细胞外Ca2+通过CaSR介导的信号传导诱导细胞蛋白A裂解并促进AR缺陷和高转移性前列腺癌细胞中的迁移。Ahearn等[42]研究表明CaSR在前列腺癌的骨转移中起重要作用,且CaSR表达与致死性前列腺癌的风险增加相关,特别是在具有低维生素D受体(VDR)表达的肿瘤中。Feng等[43]发现从骨中获得的转移性前列腺癌组织具有比原发性前列腺癌更高的CaSR表达(P<0.05)。癌症组织中CaSR的表达与癌症分化的阶段或状态无关。这些结果表明CaSR可能在促进前列腺癌的骨转移中起作用,因此提高了用基于CaSR的疗法降低这种转移的风险的可能性。在基因多态性方面,研究显示,rs1725122与前列腺癌及乳腺癌有明显的相关性,携带纯合子变体会显着增加乳腺癌和前列腺癌的风险[43]。而另一项荟萃研究则表明在所有遗传模型中,CASR rs1801725,rs1042636,rs12485716,rs4678174,rs1801726,rs17251221,rs10934578和rs2270916多态性与癌症风险之间无显着相关性(P>0.05)[44]。
2.3 CaSR与肾细胞癌 在我国,肾细胞癌(renal cell carcinoma,RCC)是泌尿系中发病率仅次于膀胱癌和前列腺癌肿瘤,在多种成人恶性肿瘤中所占比例约为2%~3%,近些年在全世界的发病率有上升的趋势[11]。CaSR与Ca2+在RCC的发生发展中的作用与CaSR介导的信号转导相关(详见图1)。Znaor等[45]研究发现包括CaSR在内的10个基因在肾细胞癌的发生和增殖中起着至关重要的作用,它们与免疫反应,代谢过程,细胞周期调节,血管生成和离子转运有关。
骨组织是肾细胞癌(RCC)转移的主要部位之一。在骨组织中,钙离子的浓度非常高。细胞通过钙敏感受体(CaSR)识别细胞外钙。Yuan等[46]在肾切除术后5年内没有转移或发生骨或肺转移的患者的肿瘤组织和原发肿瘤细胞中定量CaSR。发现在发生骨转移的患者的组织样本和原代细胞中,CaSR表达明显增强。在功能上,分析显示骨转移细胞对增殖和趋化性迁移的敏感性更高。这些效应是由CaSR的下游靶标AKT(PKA与PKC的相关激酶,related to the A and C kinase,RAC-PK),PLCg,JNK(c-Jun氨基末端激酶,c-Jun N-terminal kinase)和p38(一种应激激活的蛋白激酶)的活性增强引起的。Joeckel等[47]研究结果表明CaSR的表达在骨转移患者的标本和细胞中最高。细胞外钙通过高表达的CaSR及其下游信号通路促进骨转移RCC细胞的细胞迁移和增殖。他们认为CaSR可被视为预测RCC骨转移的新预后标志物。Huang等[48]研究表明CaSR介导的细胞内Ca2+增加通过转录因子CREB影响细胞骨架基因表达。添加NPS2390(特异性CaSR拮抗剂)可以对抗这一效果。
2.4 CaSR与肾纤维化 肾纤维化(renal fibrosis)是肾实质逐渐瘢痕化,肾功能逐渐丧失的病理过程,是各种不同病因的肾性疾病发展致终末期肾衰竭的共同病理表现。因此,延缓及逆转肾纤维化的进展是慢性肾脏病(chronic kidney disease,CKD)的关键。
Abdullah等[49]研究表明在 mTAL 细胞上,CaSR通过Gi蛋白偶联机制激活钙调蛋白(calmodulin;CaM)和活化T细胞核因子(nuclear factor of activated T cells,NFAT),通过PKC依赖的方式增加肿瘤坏死因子(tumor necrosis factor,TNF)基因的转录,增加了TNF-α的分泌水平。TNF-α可以上调单核细胞化学诱导蛋白(monocyte chemoattractnt protein-1,MCP-1)、血管细胞黏附分子-1(vacular cell adhesion molecule-1,VCAM-1)和细胞间黏附分子-1(inter cellular adhe-sion molecule-1,ICAM-1)的表达,导致大量的单核/巨噬细胞、中性粒细胞、淋巴细胞等炎性细胞趋化聚集至受损肾间质并被激活,释放IL-1、IL-6等更多的炎性因子,一方面进一步加强炎性反应,产生“级联放大”作用,另一方面使肾小管上皮细胞、血管及其周围组织的损伤进一步加重。损伤和再生的肾小管上皮细胞则可以产生更多的肿瘤坏死因子(tumor necrosis factor-α,TNF-α),而 TNF-α可刺激成纤维细胞的增殖,介导肾小管上皮细胞转分化(epithelial-mesenchymal transition,EMT),合成大量胶原等细胞外基质(extracellular Matrix,ECM),加速肾脏纤维化进程[50]。
肾脏纤维化是以细胞外基质(extracellular matrix,ECM)的异常沉积为特征的。Wu等[13]研究发现CaSR激动剂cinacalcet使Ⅰ型、Ⅲ型和Ⅳ型胶原的ECM组分表达降低0.25%。此外,CaSR激动剂西那卡塞可部分地消除了由TGF-β1诱导的胶原蛋白的上调,从而起到降低肾纤维化的作用。该研究提供了肾纤维化中CaSR活化对肾小管上皮保护作用的证据,这一作用可能通过抑制肾小管上皮细胞中的胶原蛋白表达来实现的。其作用机制可能与TGF-β/Smad信号转导机制有关。同时他的研究还表明CaSR介导小鼠集合管细胞中白细胞介素(interleukin,IL-1β)诱导的胶原蛋白表达,选择性CaSR抑制剂(Calhex231或NPS2143)或CaSR的小干扰RNA(Small interfering RNA;siRNA,siRNA)可以减弱Ⅰ型和Ⅲ型胶原蛋白的增强表达。这些结果表明IL-1β诱导的集合管细胞中的胶原蛋白Ⅰ和Ⅲ的表达可能部分由CaSR介导[51]。但目前关于CaSR与肾纤维化的相关研究较少,具体机制还需进一步研究。
在不同的疾病中,CaSR作用机制并不相同。尚需进一步研究来了解CaSR在这些疾病发生、发展的分子机制,为CaSR成为临床治疗的靶点奠定基础。我们可以利用CaSR的激动剂或拮抗剂来治疗上述相关疾病;我们还可以在基因水平对CaSR加以修饰,有针对性地上调或者下调CaSR的表达,来治疗上述疾病或是抑制上述疾病(特别是前列腺癌和肾癌)的进展,为泌尿系疾病的治疗提供新方法。
