胃内微生态系统结构特点和潜在致病菌
2020-08-07刘金哲周丽雅
刘金哲 薛 艳 周丽雅#
清华大学附属北京清华长庚医院消化内科1(102218) 北京大学第三医院消化科2
30余年来的研究和实践证实,幽门螺杆菌(Helicobacterpylori,Hp)是导致慢性胃炎、消化性溃疡、胃癌等疾病发生、发展的重要因素,早期根除Hp可降低胃癌发病率。然而微生物组学研究进展表明,胃内除Hp外,尚存在数百种微生物,其中一部分能定植于胃黏膜,可能具有潜在致病性。欧洲Maastricht Ⅴ共识明确指出胃内有其固有菌群,且可能在Hp相关疾病的发生、发展中发挥重要作用[1]。由胃内环境、Hp和其他胃内菌群共同构成的胃内微生态系统保持稳定能促进人体健康,反之则会导致疾病发生、发展。本文就胃内微生态系统的结构、功能以及潜在致病菌的研究进展作一综述。
一、胃内固有菌群
细菌培养是传统的微生物研究方法,也是早年消化系统疾病研究最常用的手段,但当时的研究者认为胃内菌群系口腔、咽喉部和呼吸道来源的过路菌,对胃肠道疾病的诊治意义不大。近十余年来,随着观念的转变,胃内菌群的培养重新得到重视,基因测序技术则较传统培养方法能获得更多的胃内菌群信息。Bik等[2]最早对胃黏膜标本行二代测序,共发现128种细菌,其中50%以上不能分离培养,67%是来自口腔的细菌。Delgado等[3]通过比较口腔、咽喉与胃黏膜菌群数据库,发现胃黏膜有着独特的微生态结构,证实胃内有其固有菌群,而不是单纯来源于口腔和咽喉的过路菌。朱鸣等[4]采用细菌培养结合16S rDNA测序分析老年人群的胃内菌群,发现常见细菌包括链球菌、大肠埃希菌、奈瑟菌、罗氏菌等。中国疾病预防控制中心应用质谱技术鉴定Hp阳性上消化道疾病患者的胃内其他细菌种类,发现最常见的是浅黄奈瑟菌、唾液链球菌和黏滑罗氏菌[5]。
吞咽下的细菌碎片、被胃液和免疫系统杀死的细菌不能在胃内定植,不属于胃内固有菌群范畴。为区分这些“过路菌”,前沿研究多采用能反映有代谢活性的菌群特征的反转录测序技术。由于死亡细菌的RNA被降解,故提取胃黏膜组织样本的RNA反转录为cDNA再行测序可得到存活菌群的信息。Schulz等[6]应用16S rRNA测序技术处理上消化道来源标本,分析发现口腔、胃和十二指肠菌群因部位不同而存在显著差异,唾液、胃液和十二指肠液与胃黏膜、十二指肠黏膜菌群亦有较大差异;与唾液相比,胃液中韦荣球菌减少而梭菌属丰富,丙酸杆菌等多种细菌丰度降低,提示胃液对菌群有明显选择性;Hp在胃黏膜菌群中居主导地位。
胃内菌群受多种因素影响,与肠道菌群相比,具有密度小、特异性低、稳定性差、波动性高等特征。关于胃内固有菌群,目前研究比较明确的有以下三点:第一,胃内最常见的5个菌门为变形菌门、拟杆菌门、厚壁菌门、放线菌门和梭菌门。5个菌门中分布最广泛的分别是变形菌门中的螺杆菌、嗜血杆菌、放线杆菌和奈瑟菌;拟杆菌门的普氏菌属;放线菌门的罗氏菌、放线菌和微球菌;厚壁菌门的链球菌和杆状菌[7]。第二,Hp主导胃黏膜相关菌群,Hp过度增殖可能干扰胃内微生态环境,引起微生态紊乱和炎症反应,导致胃内菌群失调和疾病发生。第三,胃黏膜菌群不同于胃液菌群,其内除Hp外还可能包含其他潜在致病菌。探讨胃内固有菌群有助于提高对慢性胃病的认识。
二、胃内微生态环境
胃黏膜环境是胃内微生态系统的重要组成部分,进行菌群分析不可忽视胃黏膜结构特点,特别是胃酸的理化特性和黏液层的结构特点。胃酸是抑制细菌的主要成分,长期以来胃黏膜被认为是无菌器官,理由即为较多学者认为胃酸可杀死大多数细菌。但事实上胃酸并不能杀死全部微生物,Hp就是最好的证据。除Hp外,螺杆菌属的其他菌种也可逃避胃酸的侵蚀,其他微生物也可能借助Hp的生物膜顺利定植。尽管如此,胃十二指肠仍是消化道菌群密度最低的区域。胃酸是调控胃内菌群最重要的因素,因而也是决定胃内环境最重要的因素。正常人胃酸维持在pH 1.0~2.0,萎缩性胃炎患者和老年人胃酸分泌异常,感染机会增加,慢性炎症进展至肿瘤的风险也相应增加。
传统意义的胃黏膜指表皮细胞以下的成分,由黏液细胞或上皮分泌的黏液往往被忽视。图1所示消化道黏液层的微观结构模式,其内层紧贴黏膜上皮,水分被吸收,结构较为致密,外层则相对疏松。黏液层的结构特点决定了胃内菌群的分布规律,外层含有更多的微生物,可发挥生物屏障功能;内层不利于细菌移动,故细菌很少侵犯上皮细胞。内层黏液中的免疫成分如抗菌肽、IgA等浓度相对较高,可进一步防止高侵袭力的菌种侵犯。除胃酸和黏液层外,胃液中的固有免疫系统成分也是胃内环境的重要组分。胆汁反流、抑酸剂、免疫抑制剂、胃黏膜萎缩等可降低胃酸pH值,破坏黏液层结构,减少胃黏膜固有免疫组分,从而破坏胃内微生态环境,使胃内固有菌群结构发生较大改变,菌群失调可能加速疾病进展。
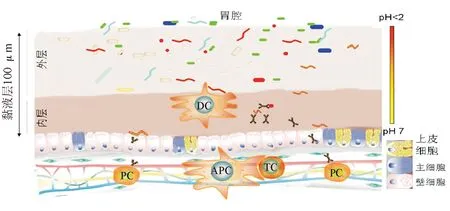
DC:树突细胞;PC:浆细胞;APC:抗原呈递细胞;TC:T细胞图1 胃内微生态环境模式图
三、胃内菌群的功能
胃内微生物具有维持内分泌平衡、免疫调节、促进消化和吸收等重要功能。2011年荷兰Van den Abbeele等[8]提出了宿主选择和共同进化学说,阐明人体通过自身免疫系统保留胃肠道内有益微生物并消除病原菌。关于这些能在胃内定植的微生物对人体起有何种作用,免疫屏障和辅助消化是目前研究得比较清楚的两个部分。
首先,益生菌可发挥免疫屏障功能,抵御外来病原菌的侵袭。益生菌除竞争性拮抗外来病原菌定植外,还能增强胃黏膜免疫如分泌强免疫原性分子、提高IgA浓度。龚四堂课题组的研究[9]发现,表达尿素酶B的重组枯草芽孢杆菌孢子能促使胃黏膜产生体液免疫,进而抑制Hp增殖。杨若明课题组最近报道布拉酵母菌可保护机体免受螺杆菌侵袭,其主要作用机制为升高胃液和血清中的螺杆菌特异性IgA浓度[10]。其次,微生物携带有很多功能基因,能编码分解脂肪酸等物质的酶类,参与构成人体消化酶辅助消化和吸收。再次,Hp在维持内分泌调节方面也起有重要作用。纽约大学医学院Blaser等[11]详细论述了Hp对胃泌素和生长抑素的调节作用,儿童根除Hp后体内调节性T细胞数量和胃泌素水平下降,生长抑素、胃饥饿素和胃酸水平升高。此外,胃内菌群对胃肠道生理特别是酸分泌、免疫激活和神经内分泌系统具有潜在调节作用,探究这些潜在功能是胃内微生态研究的重要课题。
四、菌群间的相互作用
正常菌群对机体具有免疫屏障作用,可拮抗病原菌入侵和定植,亦可抑制条件致病菌的大量增殖和移位,这些效应的实现建立在菌群间直接相互作用的基础之上。一般而言,细菌之间存在生态位竞争,即通过产生抗菌物质、代谢产物和群体感应效应相互抑制。菌群间关系复杂,既有相互拮抗又有互利共生,如口腔菌群中的链球菌代谢物乳酸可促进韦荣球菌生长,韦荣球菌代谢物甲萘醌为卟啉单胞菌所必须,卟啉单胞菌则可抑制链球菌生长。在胃内菌群中,缓症链球菌可促使Hp由螺旋状变形为球状,从而抑制Hp生长[12]。布拉酵母菌能抑制猪螺杆菌(H.suis)造成的胃黏膜淋巴滤泡形成[10]。
胃内菌群中的某些微生物可改变宿主的免疫特性,从而间接影响胃内微生态和人体其他部位的微生态结构。动物实验证实肝螺杆菌(H.hepaticus)定植可通过抑制机体免疫功能间接促进结核分枝杆菌增殖并增强其致病性[13]。而Hp可通过促进T细胞成熟降低活动性结核风险[14]。流行病学调查显示Hp感染与变应性哮喘之间呈负相关,动物实验亦证实Hp可减少气道过敏性疾病发生[15]。
五、胃内致病菌
大量临床资料和动物实验证实Hp是慢性胃炎、消化性溃疡、胃癌等疾病的致病因子。但严格地说,Hp作为致病菌并不符合科赫法则,因为健康人群也可能携带Hp。Hp是一种苛养菌,培养阳性率通常不高,最近应用测序技术发现了更多的Hp携带者。一项研究[16]显示,在消化性溃疡出血患者中,胃黏膜标本PCR测序、快速尿素酶试验(RUT)和组织学检测三种方法检出Hp感染的敏感性分别为97.2%、47.7%和71.6%。瑞典学者应用宏转录组学技术发现,传统方法检测显示Hp阴性的人群,多数胃内菌群仍以Hp为主[17]。因此,在Hp感染率逐渐下降而慢性胃炎发病率上升的趋势下[18],我们不得不思考Hp和胃内其他微生物的致病性问题。
有学者认为Hp过度生长可表现出致病性,胃窦Hp密度超过105cfu/mg组织蛋白可致十二指肠溃疡发生,低于此密度则一般无溃疡[19]。但也有学者提出Hp丰度不一定是主要致病因素,比利时学者发现尿素酶活性与炎症程度无关,但高Hp负荷会给根除治疗带来一定困难[20]。Hp感染者的患病情况个体差异较大,尤其是种族差异,如Hp感染的亚洲之谜(Asian enigma),即亚洲印度、巴基斯坦、孟加拉国等Hp高感染率国家的胃癌发病率反而低于中、日、韩等Hp感染率相对较低的国家[21]。另有数据显示Hp感染与哮喘、肥胖等现代疾病呈负相关。特别值得一提的是,根除Hp在降低胃癌发病率的同时可增加食管癌发病率。研究[22]显示CagA阳性Hp感染对亚洲人群的食管鳞癌是一种保护因素。Hp的VacA、CagA、BabA2等毒力因子与其致病性密不可分,前期CagA-菌株感染甚至能减轻后续CagA+菌株造成的炎症损伤[23]。
螺杆菌属包含30多个菌种,Hp以外的螺杆菌(non-Helicobacterpylorihelicobacter,NHPH)对人体健康和根除Hp有重要影响。调查发现中国北京地区1 499例Hp检测结果阳性患者中11.87%同时存在海尔曼螺杆菌(H.heilmanniis.l.)感染,包括猪螺杆菌、猫螺杆菌(H.felis)、毕氏螺杆菌(H.bizzozeronii)等[24],部分菌种已在感染动物模型中被证实可损伤胃黏膜。猪螺杆菌是最常见的NHPH,通常用于制作胃黏膜相关淋巴样组织(MALT)淋巴瘤动物模型[10]。
正常生理条件下,胃内菌群有助于机体防御病原菌入侵、菌群移位,以及建立完善的免疫系统,但伴随着胃黏膜的病理改变,胃内菌群更替、紊乱甚至出现过度增殖,可能加剧胃黏膜病理损伤。Lofgren等[25]的动物实验证实,在Hp与胃内菌群的联合作用下,胰岛素-胃泌素转基因(transgenic FVB/N insulin-gastrin,INS-GAS)小鼠发生胃黏膜上皮内瘤变的时间明显早于单独Hp感染小鼠;Hp感染导致小鼠胃内拟杆菌门减少、厚壁菌门增多,进而加重胃黏膜损伤。由此推测Hp在胃癌发生中起始动作用,伴随胃黏膜萎缩、胃酸分泌减少出现的菌群失调则促进胃癌发生、发展。临床证据显示,在癌前状态(肠化生或异型增生)下,根除Hp并不能降低胃癌发生风险[26]。也有研究[27]发现胃癌患者的胃内菌群密度和生物多样性显著高于胃炎患者,提示源自胃内菌群的其他因素在胃癌发生中起有不可忽视的作用。已有研究表明胃癌与胃内菌群失调密切相关,国内、外众多研究团队致力于寻找胃癌特异性菌群。香港中文大学Coker研究团队于2017年在美国消化疾病周报道了5种胃癌组织特异性细菌,分别是胃炎消化链球菌(Peptostreptococcusstomatis)、咽峡炎链球菌(Streptococcusanginosus)、微小小单胞菌(Parvimonasmicra)、乏生斯莱克菌(Slackiaexigua)和侵肺戴阿利斯特菌(Dialisterpneumosintes)。这些胃癌相关菌群可能在胃黏膜萎缩后期发挥效应。此外,口腔菌群紊乱有助于Hp定植,甚至有学者提出牙周疾病的病原菌是胃癌发生的重要因素[28]。
根除Hp的同时也根除了其他胃内菌群,因此根除Hp降低胃癌发生风险的效应也可能得益于其他胃内菌群的消除。在病变早期胃黏膜尚未发生萎缩之前根除Hp可逆转病理损伤,之后则无效,胃内菌群恰恰是在这一不可逆点之前出现更替:Hp与其他胃内菌群在健康人体内都作为共生菌存在,胃内环境改变后,Hp过度增殖启动胃黏膜萎缩,萎缩黏膜产生胃酸的能力下降,胃内pH值下降,具有耐酸能力的Hp失去竞争优势,密度在胃黏膜发生萎缩后逐渐降低,胃内其他菌群开始占据主导地位(图2)。

图2 Hp与其他胃内菌群的交替
胃内菌群失调与胃癌间的相关性虽已得到证实,但两者的因果关系仍不确定。菌群失调既可能出现于胃癌发生前,促进胃癌的发生、发展,也可能是继发于胃癌发生后胃黏膜生理环境的改变。越来越多的研究证据支持前者,即胃内微生物组学改变可促进癌症进展,但这一观点需要更严谨的实验加以证实[29]。
六、胃内菌群与Hp的耐药性
Hp耐药性增加除与其自身耐药性相关外,还可能与胃内固有菌群有关。首先,Hp感染与胃内菌群关系密切。动物实验证实Hp在普通动物胃内较难定植,经抗菌药物干预的动物和和无菌动物的Hp感染率大幅升高,因此根除Hp应充分考虑调节胃内微生态环境这一因素。第二,胃黏膜培养中可能出现链球菌、奈瑟菌、葡萄球菌、肺炎克雷伯菌等杂菌生长,不论这些细菌是来自呼吸道、口腔或鼻腔的过路菌还是胃黏膜内定植的细菌,均会影响临床Hp检测结果,如肺炎克雷伯菌、葡萄球菌属的一些种类尿素酶阳性,可干扰尿素呼气试验(UBT)或RUT结果,导致Hp诊断结果假阳性,同样也可使Hp根除结束后的复查结果呈假阳性[30]。第三,胃内环境的特殊性决定了胃内菌群以生物膜的形式存在,数量占优的Hp聚集,通过代谢作用形成相对偏中性的环境,以利于自身或其他共生菌定植。Hp的根除使葡萄球菌、链球菌等正常菌群产生耐药性,理论上,耐药质粒有机会传递给Hp,导致Hp耐药。此外,螺杆菌属尚存在多种生化特性与Hp相似的菌种,如H.cinaedi也能导致胃炎发生,目前对这些Hp以外的螺杆菌耐药性和致病性的研究远远不足。因此,调查Hp根除人群的胃内差异菌群具有重要科研和临床意义。
七、IgA结合菌群
胃液中的IgA是防御病原菌侵袭的重要屏障,Hp可诱导胃黏膜产生Hp特异性IgA[31],然而这些特异性IgA多为非分泌型,Hp感染者胃液中的分泌型IgA水平降低,保护作用减弱,造成感染状态持续[32]。其他胃内菌群如侵入黏膜上皮,同样会诱导特异性抗体产生,特异性IgA分泌至肠腔内,可特异性地阻断相应细菌进一步侵袭。日本北海道大学Tsuruta等[33-35]对胃肠道IgA结合菌群作了一系列研究,发现流式细胞分析是检测该类菌群较为敏感的方法。以荧光标记IgA抗体标记IgA结合菌群,借助流式细胞分析可达到分离该类菌群的目的。目前IgA流式筛选联合测序技术已应用于肠道细菌研究,特别是炎症性肠病的研究,可用于致结肠炎菌群的鉴别[36]。鉴定胃内潜在致病菌可借鉴这一方法。
八、结语
人体胃内所有的微生物和胃内环境共同构成胃内微生态系统,该系统结构复杂,各个组分之间相互作用,包括Hp与其他胃内菌群的相互作用、胃内菌群间的相互作用,以及胃内菌群与胃黏膜免疫系统间的相互作用。因影响因素众多,胃内固有菌群个体差异较大,导致其内在规律难以描述。Hp在胃黏膜菌群中居主导地位,携带Hp的人群比例远高于传统方法的检出率。胃内固有菌群在Hp相关疾病中的作用已为越来越多的研究所证实,其中的潜在致病菌尚待深入研究探讨。慢性呼吸系统、泌尿和生殖系统感染性疾病的常见病原菌多种多样,慢性胃炎的病原菌亦可能不仅仅只有Hp。微生物组学研究已证实胃内尚有其他微生物定植,其中哪些细菌可引起慢性胃炎,应引起各国胃肠病学家的足够重视。
