卵泡抑素样蛋白1在胃间质瘤生长和凋亡中的作用
2020-08-07温培楠陈笑雷
温培楠 陈笑雷
胃间质瘤作为一种恶性程度较低的胃黏膜下肿瘤,是消化系统发病率最高的肉瘤。伊马替尼是治疗胃间质瘤最有效的药物,但其耐药率高达60%以上,目前对进展期胃间质瘤尚缺乏有效的治疗措施[1]。胃间质瘤的发生是在遗传和外部刺激的作用下导致细胞多种信号通路调节异常,从而引起细胞增殖、凋亡和血管再生能力等多种生物学行为的改变[2]。卵泡抑素样蛋白1(follistatin-like protein 1, FSTL1)是一种细胞外分泌糖蛋白,又称转化生长因子β1刺激克隆36(TSC-36),其在人体组织中广泛表达,在细胞生存、增殖、分化、迁移和胚胎脏器成熟过程中起着重要的调节作用[3-5]。体外实验结果表明,FSTL1可促进肺癌、乳腺癌等多种恶性肿瘤细胞生长[6]。本研究旨在探讨胃间质瘤细胞中FSTL1的表达,并评估其在胃间质瘤细胞生长和存活中的作用。
1 材料与方法
1.1 血液和组织标本来源 纳入2016年9月—2018年9月间在温州医科大学附属第一医院普通外科接受胃间质瘤切除术的患者27例,以及接受胃镜下黏膜活组织检查(简称活检)的健康志愿者32名。采集健康志愿者和间质瘤患者手术前和手术后1 d的静脉血,同时留取胃间质瘤组织标本和正常胃黏膜组织标本。本研究符合2013年修订的《赫尔辛基宣言》,所有受试者均签署知情同意书,并排除慢性疾病和先天性疾病,且术前均未接受放射治疗或化学疗法,其组织标本经两位病理科医师确诊。
1.2 细胞株和主要试剂 人胃间质瘤细胞株GIST882和正常胃黏膜上皮细胞株RGM-1购于美国模式培养物保存中心(American Type Culture Collection, ATCC);伊马替尼购自瑞士诺华公司;蛋白激酶B(AKT)抑制剂Wortmannin和细胞外信号调节蛋白激酶(ERK)抑制剂PD 98059购自美国Sigma公司;吉姆萨染液和二甲基亚砜(DMSO)来源于杭州四季青公司;DMEM培养基来源于江苏麦莎公司;含EDTA的胰蛋白酶购自中国吉诺公司;FSTL1 mimic、mimic阴性对照(mimic NC)、FSTL1小干扰RNA(siRNA)和siRNA对照(siRNA NC)购自南京巴傲得生物科技有限公司;脂质体(LipofectamineTM2000)购自美国Gibco公司;FSTL1 ELISA试剂盒、细胞计数试剂盒-8(CCK-8)、凋亡检测试剂盒、反转录试剂盒、定量反转录(qRT)-PCR试剂盒和BCA蛋白质水平检测试剂盒均来源于上海常斤生物公司;细胞色素C(cytochrome C)、Bax、bcl-2、ERK和磷酸化(p-)ERK、c-Jun氨基末端激酶(JNK)和p-JNK、p53和p73抗体购自美国Epitomics公司;周期素E(Cyclin E)、E2F-1、Rb和p-Rb、AKT、p-AKT、β-actin抗体购自美国Santa Cruz公司;半胱天冬酶(caspase)-3、NF-κB抑制蛋白(IκB)和p-IκB、多聚二磷酸腺苷核糖聚合酶(PARP)抗体购自美国 Abcam公司。
1.3 FSTL1在血清、胃间质瘤组织和细胞株中的表达
1.3.1 FSTL1在血清中的表达 采用ELISA检测血清FSTL1表达。取出冷藏的胃间质瘤患者和健康志愿者静脉血,离心后按照试剂盒说明书进行操作,设立标准品浓度,在ELX808U酶标仪(美国Bio-Tek公司)上自动拟合标准曲线,检测各孔吸光度(A)值,计算样本中FSTL1的含量。
1.3.2 FSTL1在胃间质瘤组织和细胞株中的表达 采用Werstern印迹法检测FSTL1在胃间质瘤细胞株GIST882和正常胃黏膜细胞株RGM-1中的表达量,以及其在胃间质瘤和正常胃黏膜组织中的表达量。
1.4 细胞实验步骤
1.4.1 细胞培养和转染 在DMEM培养液中添加10%胎牛血清培育GIST882和RGM-1细胞,将细胞放置细胞培养箱中,使用含EDTA的胰蛋白酶消化,按照1∶3的比例进行传代,取对数生长期细胞进行各项实验。将GIST882细胞以每孔2×104个细胞加入96孔板中,分别将5 μL浓度为20 μmol/L的FSTL1 mimic(FSTL1 mimic组)或FSTL1 siRNA(FSTL1 siRNA组)与5 μL脂质体(LipofectamineTM2000)混匀后加入GIST882细胞中,FSTL1 mimic和FSTL1 siRNA的转染浓度分别为100和50 nmol/L,同时设立各自的空白对照组(mimic BC和siRNA BC组)和相应的阴性对照组(mimic NC和siRNA NC组),每组5个复孔。24 h后换液为完全培养基继续培养24 h,采用Werstern印迹法检测转染效率。
1.4.2 FSTL1对胃间质瘤细胞生长的影响 验证转染成功后,采用CCK-8法分别检测FSTL1 mimic组、mimic NC组、mimic BC组和 FSTL1 siRNA组、siRNA NC组、siRNA BC组的细胞活力。采用平板克隆形成实验比较各组细胞的增殖能力。
1.4.3 抑制FSTL1的表达对细胞周期、细胞凋亡的影响 采用流式细胞术检测FSTL1 siRNA组、siRNA NC组和siRNA BC组中处于G1期的GIST882细胞比例,分析早期凋亡率。采用Werstern印迹法检测细胞G1周期调控蛋白(Cyclin E、E2F-1、p-Rb、p53和p73)、凋亡相关蛋白[细胞色素C、Bax、bcl-2、裂解的caspase-3(cleaved caspase-3)和裂解的PARP(cleaved PARP)],以及AKT和ERK通路的通路相关蛋白(p-ERK、p-JNK、p-AKT、IκB)的表达。
1.4.4 AKT和ERK通路对胃间质瘤细胞活力的影响 设立mimic NC组、FSTL1 mimic组、mimic NC+Wortmannin组、FSTL1 mimic+Wortmannin组和mimic NC组、FSTL1 mimic组、mimic NC+PD 98059组、FSTL1 mimic+PD 98059组。加入Wortmannin终浓度为40 mmol/L,作用时间30 min;PD 98059终浓度为20 mmol/L,作用时间30 min。采用CCK-8法分析各组细胞活力。
1.4.5 抑制FSTL1表达对胃间质瘤细胞药物敏感性的影响 设立siRNA NC组、FSTL1 siRNA组、siRNA NC+伊马替尼组和FSTL1 siRNA+伊马替尼组。加入伊马替尼终浓度为40 μmol/L,作用时间24 h。采用CCK-8法分析细胞活力。
1.5 Western印迹法检测蛋白质操作方法 受检细胞在细胞裂解液的作用下提取蛋白质;组织标本先剔除杂质、匀浆,再经细胞裂解液作用后获取总蛋白。总蛋白经匀浆、离心和变性等操作后,经凝胶电泳分离并转移至硝酸纤维素膜,通过脱脂奶粉进行封闭操作,整体实验环境为4 ℃,维持12 h,加入一抗、二抗反应后,TBST缓冲液漂洗5次后滴加ECL发光液于聚偏二氟乙烯膜(PVDF)膜上,置于化学发光凝胶成像系统(天能Tanon-5200Multi)中摄片。检测各相关蛋白质表达量。
1.6 CCK-8法检测细胞活力 将GIST882细胞加入96孔板中,每孔中分配2×104个细胞,每组5个复孔,转染或药物处理后将细胞置于37 ℃环境中4 h,再将10 mL的CCK-8试剂加至每孔细胞中,应用酶联免疫检测仪检测吸光度(A)值。
1.7 平板克隆形成实验 将siRNA BC组、siRNA NC组和FSTL1 siRNA组细胞分别加入6孔板中,每孔中分配2×105个细胞,每组5个复孔,细胞置于37 ℃环境中2周,细胞经甲醛固定后每孔加入吉姆萨染色液1 mL,计数细胞克隆形成数量,以细胞数>50作为有效克隆。
1.8 流式细胞术分析细胞周期和凋亡 将各组GIST882细胞浓度调至5×105/mL,细胞悬液以PBS冲洗3次后放置于70%乙醇溶液中固定12 h,离心后用PBS液重悬细胞,加入5 μL碘化丙啶(PI)在室温下避光反应5 min,应用流式细胞仪检测细胞周期。在GIST882细胞中加入2.5 μL annexin Ⅴ试剂(20 mg/L)和50 μL结合缓冲液在室温下避光反应30 min,再加入5 μL PI和100 μL结合缓冲液在室温下避光反应5 min,应用流式细胞仪检测细胞凋亡,该步骤重复3次,计算平均值。

2 结 果
2.1 FSTL1在血清中的表达 胃间质瘤患者术前、术后和健康志愿者血清中FSTL1的相对表达量分别为27.3±3.4、14.6±2.6和19.5±3.2。胃间质瘤患者术前血清FSTL1水平显著高于健康志愿者(P=0.005),且在术后显著下降(P=0.007)。
2.2 FSTL1在胃间质瘤组织和细胞中的表达 采用Western印迹法检测胃间质瘤、正常胃黏膜上皮组织、人胃间质瘤细胞株GIST882和RGM-1细胞中FSTL1蛋白质的表达,发现胃间质瘤和正常胃黏膜上皮组织中FSTL1蛋白质相对表达量分别为2.971±0.204和1.235±0.167,胃间质瘤中FSTL1蛋白质相对表达量显著高于正常胃黏膜组织(P<0.001);GIST882和RGM-1细胞中FSTL1蛋白质相对表达量分别为4.562±0.575和2.744±0.296,GIST882细胞中FSTL1蛋白质相对表达量显著高于RGM-1细胞(P<0.001)。见图1。
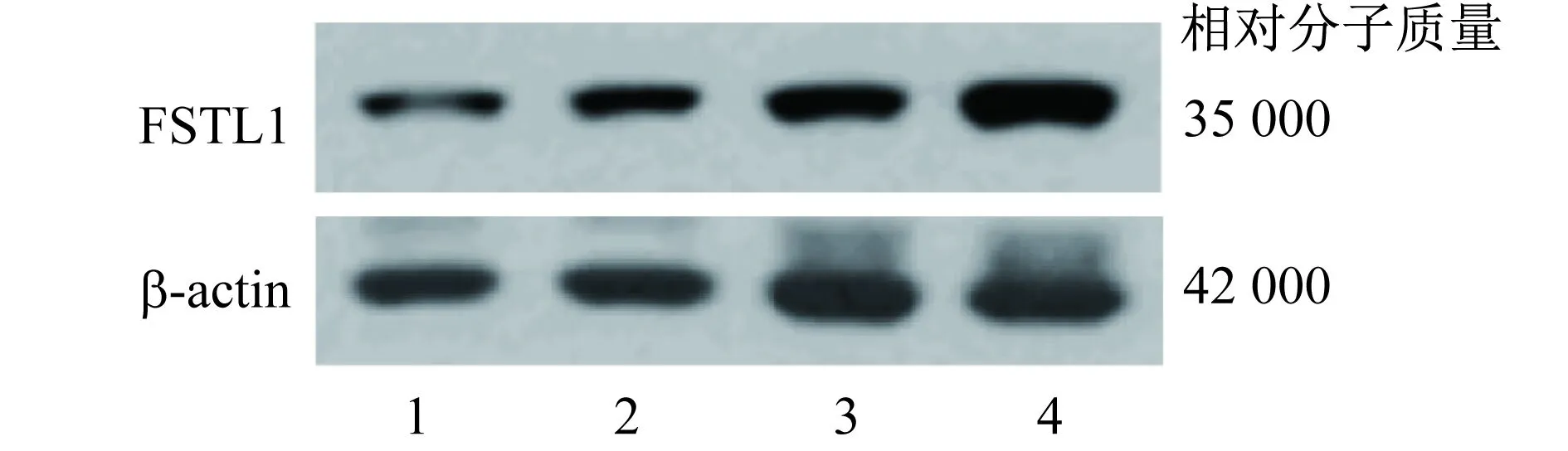
1 正常胃黏膜 2 胃间质瘤 3 RGM-1细胞 4 GIST882细胞图1 Western印迹法检测各组织和细胞株中FSTL1蛋白质的表达
2.3 FSTL1对胃间质瘤细胞生长、周期和凋亡的影响
2.3.1 细胞转染效率检测 在FSTL1 siRNA或siRNA NC转染GIST882细胞后48 h,siRNA BC组、siRNA NC组和FSTL1 siRNA组中FSTL1蛋白质相对表达量分别为1.594±0.167、1.678±0.192和0.302±0.024,转染FSTL1 siRNA显著抑制了FSTL1蛋白质的表达,与siRNA BC组和siRNA NC组间的差异均有统计学意义(P值均<0.001),见图2A。在FSTL1 mimic或mimic NC转染GIST882细胞后48 h,mimic BC组、mimic NC组和FSTL1 mimic组中FSTL1蛋白质相对表达量分别为0.876±0.093、0.971±0.112和2.576±0.341,转染FSTL1 mimic显著上调了FSTL1蛋白质的表达,与mimic BC组和mimic NC组间的差异均有统计学意义(P值均<0.001),见图2B。

A 转染FSTL1 siRNA B 转染FSTL1 mimic 1 siRNA BC组 2 siRNA NC组 3 FSTL1 siRNA组 4 mimic BC组 5 mimic NC组 6 FSTL1 mimic组图2 Western印迹法检测各组GIST882细胞中FSTL1蛋白质的表达
2.3.2 CCK-8法细胞活力检测 siRNA BC组、siRNA NC组和FSTL1 siRNA组的A值分别为1.234±0.152、1.361±0.167和0.748±0.126,FSTL1 siRNA组的A值显著低于siRNA BC组和siRNA NC组(F=12.085,P=0.008);mimic BC组、mimic NC组和FSTL1 mimic组的A值分别为1.137±0.142、0.943±0.157和1.724±0.231,FSTL1 mimic组GIST882细胞的A值显著高于mimic BC组和mimic NC组(F=13.548,P=0.003)。转染FSTL1 siRNA可显著抑制GIST882细胞活力,转染FSTL1 mimic可显著提高GIST882细胞活力。
2.3.3 细胞克隆形成实验 siRNA BC组、siRNA NC组和FSTL1 siRNA组的细胞克隆形成数目分别为157.8±21.7、174.5±24.3和63.7±10.4,与siRNA BC组和siRNA NC组相比较,FSTL1 siRNA组细胞克隆形成数目显著减少(F=26.872,P<0.001)。见图3。

A siRNA BC组 B siRNA NC组 C FSTL1 siRNA组图3 平板克隆形成实验检测GIST882细胞克隆形成数目
2.4 抑制FSTL1表达对细胞周期的影响 流式细胞术显示,siRNA BC组、siRNA NC组和FSTL1 siRNA组处于G1期的GIST882细胞比例分别为(42.4±5.2)%、(44.3±6.5)%和(61.2±8.1)%,FSTL1 siRNA组中处于G1期的细胞比例显著高于siRNA BC组和siRNA NC组(F=14.581,P=0.007),见图4。采用Western印迹法检测细胞G1周期调控蛋白水平,发现抑制FSTL1表达可下调GIST882细胞中Cyclin E、E2F-1和p-Rb蛋白质的表达水平,同时可上调GIST882细胞中转录因子p53和p73的表达,见表1、图5。
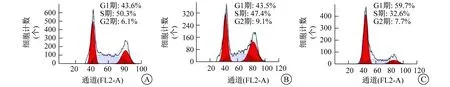
A siRNA BC组 B siRNA NC组 C FSTL1 siRNA组图4 流式细胞术检测GIST882细胞周期

表1 抑制FSTL1表达对GIST882细胞中Cyclin E、E2F-1、p-Rb、p53和p73蛋白质表达的影响

1 siRNA BC组 2 siRNA NC组 3 FSTL1 siRNA组图5 Western印迹法检测转染FSTL1 siRNA后的GIST882细胞中细胞周期相关蛋白质表达的影响
2.5 抑制FSTL1对细胞凋亡的影响 siRNA BC组和siRNA NC组GIST882细胞早期凋亡率分别为(1.58±0.23)%和(1.81±0.29)%,与FSTL1 siRNA组的(12.38±1.57)%比较,差异均有统计学意义(F=18.574,P<0.001),见图6。Western印迹法分析细胞凋亡相关蛋白质表达发现,与siRNA BC组和siRNA NC组相比,FSTL1 siRNA组中促凋亡蛋白细胞色素C、Bax、裂解的caspase-3和裂解的PARP的表达上调,同时诱导bcl-2蛋白降解(P值均<0.01),见图7、表2。
2.6 FSTL1对GIST882细胞中ERK、JNK、AKT和ⅠκB蛋白质表达的影响 采用Western印迹法检测ERK、JNK、AKT和ⅠκB蛋白激酶的活性,结果显示,与siRNA NC组和siRNA BC组相比,FSTL1 siRNA组p-ERK和p-AKT的表达均显著下降(P值均<0.01),而p-JNK和IκB的表达均无明显改变(P值均>0.05),见表3、图8。

1 siRNA BC组 2 siRNA NC组 3 FSTL1 siRNA组图7 Western 印迹法检测转染FSTL1 siRNA对细胞凋亡相关蛋白质表达的影响
2.7 FSTL1通过ERK通路依赖途径促进体外胃间质瘤细胞增殖 分别在AKT抑制剂Wortmannin或ERK抑制剂PD 98059存在或缺失的情况下培养GIST882细胞,CCK-8法检测细胞活力发现,mimic NC组、FSTL1 mimic组、mimic NC+Wortmannin组和FSTL1 mimic+Wortmannin组细胞A值分别为1.248±0.176、1.865±0.243、1.127±0.234和1.753±0.318,FSTL1 mimic组和FSTL1 mimic+Wortmannin组间的差异无统计学意义(P值均>0.05)。mimic NC组、FSTL1 mimic组、mimic NC+PD 98059组和FSTL1 mimic+PD 98059组细胞A值分别为1.314±0.262、2.063±0.327、1.264±0.186和1.239±0.268,FSTL1 mimic组细胞A值显著高于FSTL1 mimic+ PD 98059组(P=0.007)。结果显示,Wortmannin不影响FSTL1诱导的细胞活力促进作用,而PD 98059可显著抑制FSTL1对GIST882细胞活力的促进作用。
2.8 抑制FSTL1对间质瘤细胞药物敏感性的影响 CCK-8实验结果显示,siRNA NC组、FSTL1 siRNA组、siRNA NC + 伊马替尼组和FSTL1 siRNA +伊马替尼组细胞A值分别为1.627±0.243、0.938±0.174、1.121±0.189和0.622±0.134,与siRNA NC组相比较,其他3组细胞A值均显著下降(P值均<0.01); 而与siRNA NC+伊马替尼组比较,FSTL1 siRNA+伊马替尼组A值显著下降(P=0.003)。表明,抑制FSTL1在GIST882细胞中的表达可提高胃间质瘤细胞对伊马替尼的敏感性。

表2 抑制FSTL1表达对GIST882细胞中细胞色素C、Bax、bcl-2、裂解的caspase-3和裂解的PARP表达的影响

表3 抑制FSTL1表达对GIST882细胞中p-ERK、p-JNK、p-AKT和IκB蛋白质表达的影响

1 siRNA BC组 2 siRNA NC组 3 FSTL1 siRNA组图8 Western 印迹法检测转染FSTL1 siRNA对细胞通路蛋白质表达的影响
3 讨 论
越来越多的证据表明,免疫细胞和基质细胞分泌的细胞因子在维持胃间质瘤细胞生长和存活中起着非常重要的作用[7-8]。胃间质瘤细胞会以旁分泌或自分泌方式分泌额外的细胞因子,进一步放大增殖和存活信号[9]。FSTL1蛋白质广泛分布于除外周淋巴细胞以外的机体细胞中[3-5]。FSTL1在胶质瘤细胞、前列腺癌和胃癌等多种实体瘤细胞中表达上调,抑制FSTL1 的表达可有效降低肿瘤细胞的多种恶性生物学行为[10-12],但其具体作用机制尚未明确。本研究发现,胃间质瘤患者血清中FSTL1的表达明显升高,且在胃间质瘤组织标本中的表达显著上调。上述结果表明,在胃黏膜上皮细胞发生恶性变的初始阶段,FSTL1有异常的信号表达。有研究[13]表明,FSTL1的异常表达与肺癌的分化程度、浸润深度和有无淋巴管转移等临床病理学特征密切相关。另外,FSTL1的转录水平与结肠癌的大小、 分化程度和转移关系密切[14]。FSTL1的表达量越高,乳腺癌患者的生存时间越短[15]。本研究比较胃间质瘤患者术前和术后血清中FSTL1表达发现,术后患者血清中FSTL1的表达迅速下调至正常水平,提示胃间质瘤组织高表达FSTL1,与既往研究[13-14]报道相仿。细胞学实验结果表明,FSTL1在胃间质瘤细胞株中的表达也明显升高,与组织学结果相吻合。综上所述,鉴于FSTL1在胃黏膜良恶性组织和细胞中的差异性表达,提示FSTL1与胃间质瘤的发生和发展联系密切。
目前,鲜见关于FSTL1与胃间质瘤细胞恶性生物学行为的研究报道。本研究通过siRNA技术特异性沉默GIST882细胞中FSTL1的表达,发现抑制FSTL1对体外GIST882细胞活力和增殖有显著抑制作用,同时诱导细胞凋亡,这与在胃间质瘤患者术后血清中FSTL1表达下调结果相吻合,表明FSTL1与胃间质瘤恶性增殖关系密切。在真核细胞中,DNA复制的起始是由细胞周期激活剂与抑制剂之间相互作用紧密调控的。真核细胞周期的进展由Cdk-cyclin复合物的协同活性控制,细胞从G1至S期的转换主要依赖于Cyclin E/Cdk1活性[16-17],而Cyclin E/Cdk1的活性可被Cdc25c激活或被p53、p21Waf1/Cip1和p27Kip1所抑制,E2F-1和p-Rb是控制细胞周期G1至S期转化的关键蛋白质,可在DNA损伤时被激活[18]。DNA损伤激活ATM介导Chk1和Chk2的诱导,抑制和降解Cdc25c,通过Cdc25c激活Cdk1,从而导致细胞周期停滞在G1期[19-20]。本研究中,下调FSTL1的表达可显著抑制GIST882细胞中Cyclin E、E2F-1和p-Rb表达水平,并诱导细胞周期停滞于G1期。肿瘤抑制蛋白p53可调控多种细胞信号通路,包括多种条件下的细胞癌变、细胞周期、凋亡和DNA损伤反应,活化的p53诱导Bax表达,导致Bax/bcl-2比例失衡,导致线粒体释放细胞色素C,破坏线粒体膜电位,同时诱导裂解的caspase-3和9的表达,从而诱导细胞凋亡[21]。此外,p73是一种与p53相关的蛋白质,由于其结构与p53相似,被认为是一种抑癌基因;p73参与细胞周期调控和诱导细胞凋亡[22]。本研究发现,抑制FSTL1的表达可上调GIST882细胞中p53和p73的表达。这些结果表明,下调FSTL1的表达可通过影响GIST882细胞中参与G1至S期调控的关键蛋白质表达来诱导细胞周期阻滞,并通过激活caspase来调控GIST882细胞凋亡。
ERK作为一种脯氨酸导向的丝氨酸/苏氨酸激酶,主要位于细胞质中,在诸如生长因子、激素、细胞因子、高糖和缺氧等刺激后下发生磷酸化,p-ERK可进入细胞核中,最终对肿瘤细胞迁移、分化和増殖等多种生理学功能发挥调控作用[23-25]。为了阐明FSTL1控制胃间质瘤细胞生长的作用通路,本研究检测抑制FSTL1表达后对GIST882细胞信号通路因子表达的变化,并且用AKT通路抑制剂和ERK通路抑制剂验证;结果表明,FSTL1调控胃间质瘤细胞生长和凋亡作用是通过ERK通路介导,而不是由AKT或ⅠκB介导的。以往研究[26]结果显示,FSTL1在炎症细胞中发挥作用通过活化ERK通路而实现,与本研究结果相似。本研究结果还表明,下调FSTL1的表达可提高体外胃间质瘤细胞对伊马替尼的敏感性,但其具体作用机制还需进一步研究明确。
总之,本研究结果表明,FSTL1在胃间质瘤组织中表达上调,其与胃间质瘤增殖与细胞活力显著相关,此种作用是通过ERK通路实现。但FSTL1对体内胃间质瘤是否具有生长促进作用还不明确。同时,其增敏伊马替尼对胃间质瘤细胞的杀伤作用机制尚未明确。本研究为开发抗癌药物提供了思路,靶向FSTL1基因的治疗有望成为临床胃间质瘤化学疗法的“补充选择”。
