炭疽杆菌RPA 等温检测方法的建立和应用
2020-08-06王素华袁淑辉帅江冰王忠才赵治国
王素华,袁淑辉,帅江冰,王忠才,蔡 军,赵治国
(1. 温州海关综合技术服务中心,浙江 温州 325027;2. 杭州海关技术中心,浙江 杭州 310016; 3. 呼和浩特海关技术中心,内蒙古 呼和浩特 010020)
炭疽杆菌(Bacillus anthracis)是一种革兰氏阳性芽孢杆菌,可引起人畜共患的炭疽病,是世界动物卫生组织(OIE)确立的必须通报的动物疫病。炭疽杆菌具有高致病性,对人和动物的健康和生命构成极大威胁,常被用作生物恐怖战剂,其快速而精确的检测一直备受重视[1]。目前炭疽杆菌检测的常用方法,主要是对病原体进行培养、染色镜检、血清学(抗原或抗体)检测等,但这些检测方法耗时较长,难以适应快速诊断和控制疫情的需要。
重组酶聚合酶扩增技术(Recombinase polymerase amplification,RPA)是一种新型的等温扩增技术[2]。RPA 主要依赖于重组酶、聚合酶、单链结合蛋白等实现对靶基因的等温扩增。在反应过程中,重组酶结合引物形成蛋白-DNA 混合物并启动寻找模板DNA 上的同源序列。同源序列定位后,则会引发链置换反应,引物结合到对应模板上,聚合酶进而从引物3'末端开始启动DNA 合成。同PCR 一样,两条引物可以启动对靶基因的对数级扩增[2]。本研究以炭疽杆菌BA5345 基因为研究对象,设计特异性引物,建立了能够快速、有效检测炭疽杆菌的RPA 等温检测方法,旨在为炭疽的防控和诊断提供一种新的、可靠的技术支持。
1 材料与方法
1.1 菌株及临床样品炭疽杆菌疫苗株(A16R)购自兰州生物制品有限公司; 蜡样芽孢杆菌(BNCC124613)、苏云金芽孢杆菌(BNCC221700)、蕈状芽孢杆菌(BNCC184427)和魏氏芽孢杆菌(BNCC189983)购自国家兽医微生物菌种保藏中心;变形杆菌、金黄色葡萄球菌和枯草芽孢杆菌由杭州海关技术中心惠赠。炭疽杆菌基因组DNA 由本实验室保存。临床样品为实验室自制污染生皮毛样品。
1.2 主要试剂Quick-DNATM提取和纯化试剂盒购自美国ZYMO RESEARCH公司;质粒DNA小量抽提试剂盒、pUC57 Vector、大肠杆菌DH5α和Amp购自生工生物工程(上海)股份有限公司;TwistAmpTMDNA amplification Kit 购 自 英 国Twist Dx 公 司;Taq DNA 聚 合 酶(5 U/μL)、dNTPs(10.0 mmol/L)、MgCL2(25 mmol/L)、DL500 DNA Marker、DL5000 DNA Marker、DNA 胶 回收试剂盒均购自宝生物工程(大连)有限公司;炭疽杆菌荧光定量PCR 检测试剂盒购自广州维伯鑫生物科技有限公司。
1.3引物设计炭疽杆菌BA5345 基因序列(FJ694154.1)常规PCR 引物的设计与特异性位点的选择参考王素华等的方法[3],同时选择该基因特异性保守区域,设计RPA 引物,引物序列见表1。引物由上海华大基因科技有限公司合成。

表1 引物序列Table 1 Primer sequences
1.4 炭疽杆菌BA5345 基因重组质粒标准品的制备以炭疽杆菌基因组DNA 为模板,以BA5345-F/BA5345-R 为引物,参考王素华等[3]建立的常规PCR方法扩增BA5345 基因片段,预期扩增的BA5345 基因大小为510 bp。将扩增的目的片段回收纯化后与pUC57 载体连接,转化大肠杆菌DH5α感受态细胞,挑取阳性菌落经PCR 和测序鉴定,获得pUC57-BA5345 阳性质粒。通过Nano Drop 2000 测定质粒的DNA 浓度,按照公式(6.02×1023拷贝/mol)×质粒浓度(ng/μL)×10-9/(DNA 长度×660)=拷贝/μL 换算为拷贝数,作为pUC57-BA5345 质粒标准品备用。
1.5 RPA 方法的优化分别对10 mmol/L 的引物使用量和反应时间进行优化。采用Twist Amp Basic Kit配制50 μL RPA反应体系,并在如下范围内进行优化:10 mmol/L BA5345-F1/BA5345-R1 各1.0 μL~5.0 μL、Rehydration Buffer 29.5 μL,MgAc(280 mmol/L)2.5 μL,模板1.0 μL,加灭菌去离子水补至50.0 μL。将模板和MgAc 之外的所有试剂预混后转入含有冻干酶制剂的0.2 mL 反应管中,并充分混匀。将1.0 μL 模板和2.5 μL MgAc 加入反应管中,盖紧管盖,瞬时离心并旋涡后,放进39 ℃水浴锅中反应,反应时间设置为10 min、20 min、30 min 和40 min。利用DNA 纯化试剂盒对RPA 产物进行纯化,取5 μL 产物经2.0%琼脂糖凝胶电泳检测。
1.6 常规PCR 扩增用于炭疽杆菌检测的常规PCR 引物序列见表1,PCR 的反应体系为:10×PCR Buffer 5.0 μL,dNTPs(10.0 mmol/L)1.0 μL,MgCl2(25 mmol/L)2.0 μL,正、反向引物(25 pmol/μL)各1.0 μL,Taq DNA 聚合酶(5 U/μL)0.4 μL,模板DNA 4.0 μL,灭菌去离子水补至50.0 μL。反应条件为:94 ℃3 min;94 ℃30 s、55.0 ℃30 s、72 ℃45 s,35个循环;72 ℃10 min。
1.7 特异性试验将炭疽杆菌疫苗株、蜡样芽孢杆菌、苏云金芽孢杆菌、蕈状芽孢杆菌、魏氏芽孢杆菌、变形杆菌、金黄色葡萄球菌和枯草芽孢杆菌在绵羊血琼脂平板上37 ℃培养48 h~72 h,用灭菌的接种环从血琼脂平板上各挑取一环新鲜菌落,加入到盛有25.0 μL 灭菌去离子水的1.5 mL 离心管中制成菌落悬液,95 ℃作用2 min 后于冰浴中冷却至4 ℃左右,Quick-DNATM提取和纯化试剂盒提取基因组DNA。以提取的DNA 作为模板,根据1.5 建立的RPA 方法进行特异性试验。
1.8 敏感性试验将重组质粒pUC57-BA534510 倍倍比稀释,使其浓度在106拷贝/μL 至100拷贝/μL 之间,并以此为模板进行RPA反应,确定该方法的敏感性。同时参照文献[3]进行常规PCR检测,利用荧光定量PCR试剂盒进行荧光PCR检测,比较三者敏感性。
1.9 RPA 方法的应用将3×106cfu/mL 炭疽杆菌疫苗株芽孢悬液,10 倍倍比稀释为7 个不同浓度(3×106cfu/mL~3×100cfu/mL)后各取200 μL 随机加入到1 g 生皮毛样品中,振荡混匀10 min,4 ℃放置过夜,使芽孢与皮毛充分吸附,即为污染皮毛,共制备35 份样品,分为7 组,每组5 份样品,每组样品炭疽杆菌的添加浓度分别为3×106cfu/mL~3×100cfu/mL;同时设置5 份已知炭疽杆菌阴性的皮毛样品作为对照。污染皮毛样品中分别加入5 mL 0.5%TritonX-100 蔗糖PBS 溶液,充分混匀,室温震荡10 min,1 000 r/min离心5 min 去除皮毛中大的颗粒,取上层悬液用PBS溶液进行10 倍稀释后,12 000 r/min 离心5 min,弃上清,再用PBS 溶液洗涤2 次,200 μL PBS 溶液重悬,悬液中即为炭疽芽孢。提取35 份污染样品和5份阴性样品的DNA 作为模板,分别采用本研究建立的RPA 方法、常规PCR 方法[3]、荧光定量PCR 试剂盒同时检测,计算三者的阳性检出率,并比较三者的检测结果。
2 结 果
2.1 炭疽杆菌BA5345 基因重组质粒标准品的鉴定结果以提取的炭疽杆菌基因组DNA 为模板,以BA5345-F/BA5345-R 为引物进行PCR 扩增。1.5%琼脂糖凝胶电泳检测显示,目的片段约为510 bp,与预期大小一致,经测序验证,结果表明重组质粒标准品pUC57-BA5345 构建正确,测定重组质粒浓度为45 ng/μL,换算成拷贝数为8.0×1010拷贝/μL。
2.2 RPA 方法的优化结果经反应体系和反应条件优化,最终确定了炭疽杆菌BA5345 基因RPA 反应体系为10 mmol/L 的BA5345- F1/BA5345-R1 各2.0 μL,Rehydration Buffer 29.5 μL,MgAc(280 mmol/L)2.5 μL,模板1.0 μL,加灭菌去离子水补至50.0 μL。最佳反应时间为30 min(图1)。
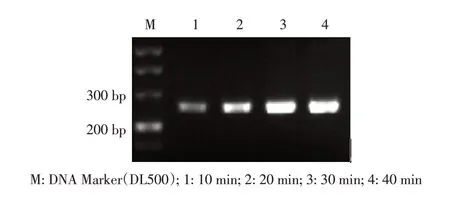
图1 炭疽杆菌检测时间优化结果Fig.1 Optimization of the RPA reaction time for Bacillus anthracis detection
2.3 特异性试验结果以炭疽杆菌疫苗株、蜡样芽孢杆菌、苏云金芽孢杆菌、蕈状芽孢杆菌、魏氏芽孢杆菌、变形杆菌、金黄色葡萄球菌和枯草芽孢杆菌的DNA 作为模板进行RPA 反应,结果显示,只有炭疽杆菌疫苗株扩增出目的条带,其余均未出现特异性扩增(图2),表明该方法具有较强的特异性。

图2 特异性试验结果Fig.2 Specific test of RPA for Bacillus anthracis detection
2.4 敏感性试验结果将浓度为8.0×106拷贝/μL 的pUC57-BA5345 质粒标准品10 倍倍比稀释至7 个浓度(106拷贝/μL~100拷贝/μL),按照所建立的条件,进行RPA 敏感性试验,并与常规PCR、荧光定量PCR 试剂盒的检测结果进行比较。结果显示,RPA和荧光定量PCR 试剂盒对重组质粒标准品检测限一致,均为102拷贝/μL(图3、图5),而常规PCR 检测限为104拷贝/μL(图4)。表明本研究建立的方法敏感性较高。

图3 RPA 敏感性试验结果Fig.3 Sensitivity test of RPA for Bacillus anthracis detection

图4 常规PCR 敏感性试验结果Fig.4 Sensitivity test of conventional PCR for Bacillus anthracis detection
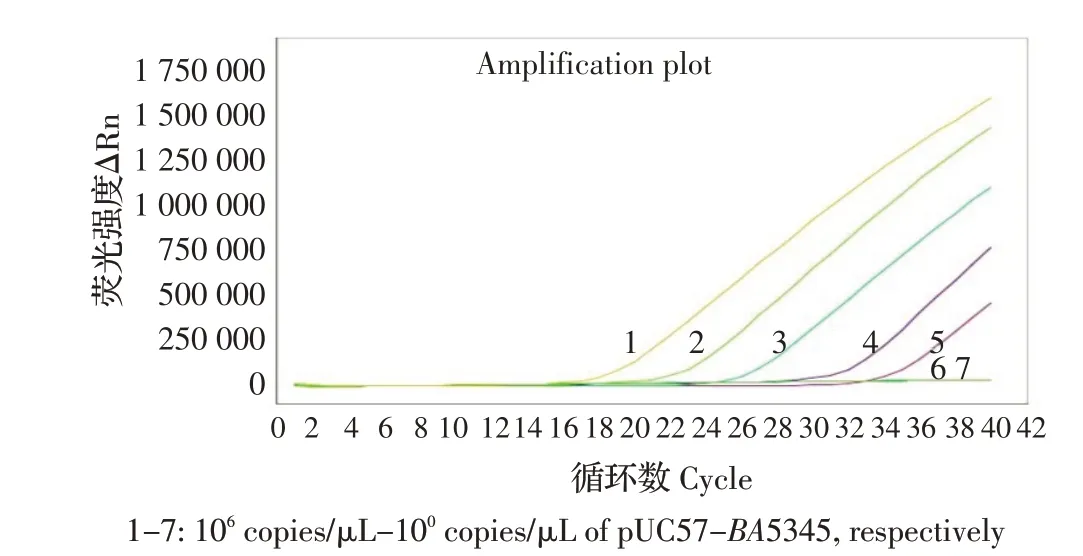
图5 荧光定量PCR 敏感性试验结果Fig.5 Sensitivity test of Real-time PCR for Bacillus anthracis detection
将浓度为3×106cfu/mL 炭疽杆菌疫苗株芽孢悬液进行10 倍倍比稀释为7 个浓度梯度后各取200 μL提取基因组DNA,按照所建立RPA 方法、常规PCR方法和荧光定量PCR 试剂盒进行扩增。结果表明,RPA 的检测限为3×102cfu/mL,同荧光定量PCR 方法检测限一致,而常规PCR 检测限为3×104cfu/mL。
2.5 临床样品的检测结果在35 份由炭疽杆菌疫苗株芽孢悬液污染的生皮毛样品中,RPA 方法的阳性检出率为65.71%(23/35),略低于炭疽杆菌荧光定量PCR 试剂盒的阳性检出率71.43%(25/35),明显高于常规PCR 的阳性检出率42.86%(15/35);在5份常规PCR 和炭疽杆菌荧光定量PCR 试剂盒均未检出炭疽杆菌的的阴性样品中,RPA 方法也未检出炭疽杆菌。
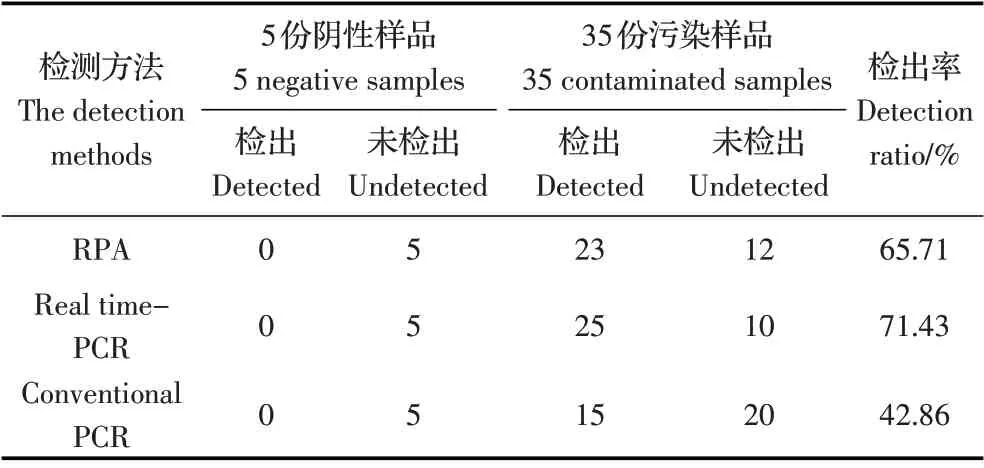
表2 临床样品检测结果Table 2 The detection results of clinical samples
3 讨 论
炭疽是严重威胁人类健康的烈性传染病,其病原体为炭疽芽孢杆菌[4]。炭疽芽孢杆菌在我国公布的《人间传染的病原微生物名录》中被列为第二类病原微生物(高致病性病原微生物),其芽孢可作为生物战剂和生物恐怖的原材料,因此发展灵敏、高效的炭疽杆菌检测方法十分重要和紧迫。
快速、精准的诊断是有效防控动物疫病的基础和必要条件。目前已经建立了多种用于炭疽杆菌芽孢检测的分子生物学方法。刘东立等建立了Taq-Man-LNA 探针多重荧光定量PCR 检测方法[5];徐超等建立了炭疽杆菌TaqMan-MGB 探针检测方法[6];谭维国等建立了双重荧光定量PCR 方法[7]。这些检测方法的特异性强、敏感性高,但也存在不足之处,如荧光定量PCR 方法需要经验丰富的技术人员和昂贵的PCR 仪[8-10],反应过程中需要复杂的温度变化,反应时间相对较长,或者需要复杂的引物和探针设计,反应试剂需要冷链运输和保存等。与PCR 方法相比,RPA 具有以下优势[11]:①试剂使用方便,易于保存,RPA核心试剂以冻干颗粒形式保存,从而避免了冷藏保存和冷链运输的必要;②RPA 反应时间短,30 min 内RPA 即可完成对炭疽杆菌靶基因的扩增,而PCR 一般需要60 min 以上;③等温扩增,RPA 属于等温扩增技术,对仪器设备要求低,一台水浴锅即可完成反应。
目前,RPA 技术已被广泛应用于动物疫病病原的快速检测,如Aebischer 等应用RPA 技术快速检测牛病毒性腹泻病毒[12];Ahmed 等建立了RT-RPA 方法快速检测口蹄疫病毒[13];刘立兵等建立了RPA 方法检测猪细小病毒;哈登楚日亚等用RPA 检测方法快速检测非洲猪瘟病毒[14]。本研究基于炭疽杆菌BA5345 基因建立了有效检测炭疽杆菌的RPA 方法,在39 ℃水浴锅中反应30 min 即可实现对目的基因片段的有效扩增,对重组质粒pUC57-BA5345 的最低检测限为102拷贝/μL。在对RPA 反应时间进行摸索时发现,在反应10 min 后可得到少量的扩增产物,在反应30 min 后,即可得到大量的扩增产物,条带清晰。利用本研究建立的RPA 方法对35 份污染样品进行检测,检测的阳性率(65.71%)较常规PCR 检测的阳性率(42.86%)更高,表明本研究建立的炭疽杆菌RPA 检测方法比目前常用的PCR 方法更加准确。
由于炭疽杆菌致病性强,快速、准确的诊断该病,尽早发现并处理传染源,是防控炭疽的重要和有效手段。本研究首次建立了一种检测炭疽杆菌的RPA 等温扩增检测方法,对设备的要求低,结果准确可靠。该方法特异性强、敏感度高、操作简单、反应速度快,适用于兽医诊断实验室和养殖场现场的炭疽杆菌检测,尤其是在资源匮乏的边缘地区养殖场的现场检测。
