A 型流感病毒NP 蛋白双单抗夹心ELISA 检测方法的建立
2020-08-06张振宇于萌萌王晓钧
徐 菱,张振宇,郭 兴,于萌萌,王晓钧
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/马传染病和慢病毒病研究创新团队,黑龙江 哈尔滨 150069)
流感病毒属于正粘病毒科(Orthomyxoviridae)流感病毒属。根据病毒核蛋白(Nucleoprotein,NP)和基质蛋白(Matrix,M)的特性,流感病毒可分为甲(A)、乙(B)、丙(C)和丁(D)4 个亚型[1]。A 型流感病毒(Influenza A virus,IAV)基因组由8段负链RNA组成,编码10个病毒基本蛋白,以及一些mRNA剪切形成的辅助蛋白[2-3]。由于IAV的抗原性极易发生变异,形成新的流感病毒变异株,从而导致病毒的耐药性不断增强,短时间内能够造成流感的区域性甚至全球性大流行[4]。据统计,在人类历史上,至少发生过4 次全球范围内的流感大流行。其中包括:1918 年的西班牙流感(H1N1)、1957 年的亚洲流感(H2N2)、1968 年的香港流感(H3N2)、2009 年的墨西哥流感(H1N1),仅在西班牙流感大流行中,造成的死亡人数高达5 000 万人,可见流感对全世界人类公共卫生安全的危害。我国是流感的高发区,也是流感病毒易发生变异的地区之一。近年来流感频发,严重威胁公共卫生安全,所以建立IAV 方便、快速、准确的检测方法,对A 型流感的临床诊断以及流行病学研究具有重大意义[5]。
NP 蛋白是由IAV 基因组中第5 节段RNA 编码,包含498 个氨基酸,分子量为56 ku,是高度保守的结构蛋白,与病毒RNA 基因组及病毒RNA 聚合酶(PA、PB1、PB2 蛋白)相互结合构成流感病毒核糖核蛋白复合体,参与流感病毒遗传物质的复制、转录和组装[6]。NP 蛋白含有各亚型流感病毒共有的表位,可诱导交叉反应抗体和T 细胞反应,为CD8+T细胞主要识别的内部病毒抗原,常用于流感的免疫诊断和新型流感疫苗的研究开发的靶标[7-8]。酶联免疫吸附试验(ELISA)具有灵敏度高、特异性强、方便和快速,对实验条件和人员要求低等优点,适合流感的快速确诊,是当前应用最广泛的一种免疫检测方法[9]。以流感病毒NP 蛋白单克隆抗体(Monoclonal antibodies,MAb)为基础建立抗原捕获ELISA 方法可以快速检测流感病毒,并且为NP 蛋白功能研究及定量检测奠定技术基础。
1 材料与方法
1.1 质粒、细胞、病毒及实验动物pVR1012-signalPPT-H3N8XJ07NP-6xHis、 pVR1012-signalPPT-H1N1SC09NP-6xHis、pGEX-6p-1、pEZ-H3N8XJ07NP、pCAGGSH1N1SC09NP、pCAGGS-GST-H1N1SC09mut1、pCAGGSGST-H1N1SC09mut2、pCAGGS-GST-H1N1SC09mut3、pCAGGSH1N1WSNNP、 pCAGGS-H3N2GD11NP、 pCAGGS-H3N8JL98NP、 pCAGGS-H5N1AH05NP、 pCAGGS-H5N2AH07NP、pCAGGS-H7N9ZJ13NP、 pCAGGS-H9N2ZJ12NP、 pCAGGS,以及H1N1PR8反向遗传系统(pEZ-PB2、pEZ-PB1、pEZ-PA、pEZ-HA、pEZ-NA、pEZ-M、pEZ-NS)、HEK293T 细 胞、SP2/0 细 胞、IAV H1N1WSN株、乙 型流感病毒(IBV)YmPJ18株、新城疫病毒(NDV)、马传染性贫血病毒(EIAV)、马疱疹病毒(EHV)、马动脉炎病毒(EAV)均由本实验保存;SPF 级BALB/c 小鼠购自辽宁长生生物技术股份有限公司;采集自黑龙江省某马场的58 份马鼻拭子样品由本实验室保存,其中包括30 份RT-PCR 检测为阴性的样品,其余28份马鼻拭子为待测样品。
1.2 主要试剂HiTrap Protein G HP 抗体纯化试剂盒购自GE Healthcare 公司;TMB 显色液购自Abcam公司;鼠源抗His 抗体、鼠源抗GST 抗体、红外荧光标记的羊抗鼠IgG(IgG-Dylight 800)购自Sigma 公司;鼠源抗NP 抗体由本实验制备;考马斯亮蓝染液由本实验配置;GST 标签蛋白纯化试剂盒、Pre-Scission Protease 购自碧云天公司;PolyJetTMin Vitro DNA transfection reagent 购 自SignaGen 公 司。
1.3 携带GST 标签的流感病毒NP 蛋白真核表达质粒的构建及NP 蛋白表达的检测根据文献[10]合成扩增引物(表1),以pGEX-6p-1 为模板,以pGEX up/pGEX down 作为引物,扩增线性pGEX-6p-1-GST载体;分别以pEZ-H3N8XJ07NP、pCAGGS-H1N1SC09NP为模板,以XJ07 NP GST F/R 及SC09 NP GST F/R 作为引物扩增线性插入片段H3N8XJ07NP 和H1N1SC09NP。利用同源重组法将H3N8XJ07NP 和H1N1SC09NP 基因片段克隆到扩增的线性pGEX-6p-1载体中,构建pGEX-6p-1-GST-H3N8XJ07NP 和pGEX-6p-1-GST-H1N1SC09NP原核表达质粒。以pCAGGS-H1N1SC09NP 为模板,以pCAGGS up2018/down2018 作为引物, 扩增线性pCAGGS 载体;分别以pGEX-6p-1-GST-H3N8XJ07NP和pGEX-6p-1-GST-H1N1SC09NP 为模板,以GST-F/XJ07 NP-GST pcaggs R 及GST-F/SC09 NP-GST pcaggs R 作为引物,扩增线性插入片段GST-H3N8XJ07NP 和GST-H1N1SC09NP。利用同源重组法将GST-H3N8XJ07NP和GST-H1N1SC09NP 基因片段克隆至pCAGGS 载体中,构建pCAGGS-GST-H3N8XJ07NP 和pCAGGS-GSTH1N1SC09NP 真核表达质粒。以上构建的重组质粒均经PCR 和测序鉴定。将HEK293T 细胞铺于六孔板中,细胞密度达80%时利用PolyJet 转染试剂分别转染pCAGGS、 pCAGGS-GST-H3N8XJ07NP 和pCAGGSGST-H1N1SC09NP 质 粒 各1 μg,8 h 后 更 换 细 胞 培 养液,24 h 后以GST 标签抗体(1∶5 000)和鼠源抗NP抗体(1∶2 000)为一抗,以红外荧光标记的羊抗鼠IgG(IgG-Dylight 800)(1∶5 000)为二抗,经western blot 检测NP 蛋白的表达。

表1 引物序列Table 1 Primers sequences
1.4 H3N8XJ07NP 和H1N1SC09NP 蛋白的制备和纯化将HEK293T 细胞铺于75 cm2细胞培养瓶中,细胞密度达80%时利用PolyJet 转染试剂分别转染12 μg pCAGGS-GST-H3N8XJ07NP、pCAGGS-GST-H1N1SC09NP质粒,8 h 后更换细胞培养液,24 h 后加入碱性裂解液裂解细胞,12 000 r/min 离心10 min,收集细胞裂解液上清,按照GST 标签蛋白纯化试剂盒说明于纯化柱中孵育后,加入5 μL PreScission Protease 蛋白酶,4 ℃过夜孵育后洗涤得到纯化的H3N8XJ07NP 和H1N1SC09NP 蛋白,纯化的蛋白样品经SDS-PAGE 检测,考马斯亮蓝染色分析蛋白纯度。最后测定蛋白浓度,分装冻存于-80 ℃。
1.5 鼠抗NP MAb 的制备、纯化和HRP 标记选用6 周龄BALB/c 雌性小鼠,分成两组免疫,一组以pVR1012-signalPPT-H3N8XJ07NP-6xHis 质粒、H3N8XJ07NP 蛋白作为免疫原和一组以pVR1012-signalPPTH1N1SC09NP-6xHis、H1N1SC09NP 蛋白作为免疫原,免疫程序都是4 次质粒免疫,每3 周免疫一次,每次每只小鼠肌肉注射50 μg,第4 次免疫质粒两周后经蛋白加强免疫,每只小鼠腹腔免疫100 μg 蛋白。按常规方法筛选得到能够分泌结合不同抗原表位MAb的杂交瘤细胞,扩大培养后小鼠腹腔注射,收获小鼠腹水。利用HiTrap Protein G HP 抗体纯化柱纯化抗体,测定抗体浓度后加入50%甘油于-80℃保存;由钟鼎生物公司进行HRP 标记。将HEK293T 细胞铺于六孔板中,细胞密度达80%时用PolyJet 转染试剂分别转染pCAGGS-GST-H1N1SC09NP、pCAGGS-GSTH1N1SC09mut1、pCAGGS-GST-H1N1SC09mut2、pCAGGSGST-H1N1SC09mut3 质粒各1 μg,24 h 后以1.3 的western blot 筛选获得的MAb 的抗原表位。
1.6 双单抗夹心ELISA 方法的建立
1.6.1 双单抗夹心ELISA 方法的MAb 及其反应条件的优化将获得3 株MAb 5 倍倍比稀释(5 000 倍~625 000 倍)分别作为捕获抗体,HRP 标记的3 株MAb(1∶2 000)作为检测抗体,利用方阵法确定最佳捕获抗体和检测抗体。随后对捕获抗体包被量(0.01 μg/孔、0.1 μg/孔、1 μg/孔)及检测抗体稀释度(1∶2 000、1∶4 000、1∶8 000)进行优化。根据绘制标准曲线的R2及检测范围确定最佳反应条件:分别对捕获抗体的包被时间(4 ℃过夜、37 ℃1 h、37 ℃2 h)、封闭液(3% FBS、5% FBS、3% BSA、5% BSA、3%脱脂奶粉、5%脱脂奶粉)、封闭时间(37 ℃0.5 h、37 ℃1 h、37 ℃1.5 h、37 ℃2 h、37 ℃2.5 h、37 ℃3 h)、抗原反应时间(37 ℃0.5 h、37 ℃1 h、37 ℃1.5 h、37 ℃2 h、37 ℃2.5 h、37 ℃3 h)、检测抗体反应时间(37 ℃0.5 h、37 ℃1 h、37 ℃1.5 h、37 ℃2 h、37 ℃2.5 h、37 ℃3 h)、TMB 底物反应时间(1 min、5 min、10 min)进行优化,根据P/N 值确定最佳反应条件。
1.6.2 双单抗夹心ELISA 方法标准曲线的建立采用优化后的反应条件检测起始浓度为0.5 mg/mL 的H1N1SC09NP 蛋白并将其2 倍倍比稀释(21~212),利用优化后的双单抗夹心ELISA 方法进行检测,以OD450nm值为横坐标,对应NP 蛋白浓度为纵坐标,绘制NP 蛋白标准曲线图;测定2 倍倍比稀释(21~212)的H1N1WSN病毒样品中NP 蛋白的含量,并以该H1N1WSN病毒样品为标准品,利用本研究建立的双单抗夹心ELISA 方法进行检测,绘制病毒样品NP 蛋白的标准曲线。
1.7 阴阳性临界值的确定30 份马鼻拭子阴性样品按优化后的双单抗夹心ELSA 方法检测,参考文献[11]计算S/P 值,S/P 值=(样品OD450nm-阴性样品OD450nm)/(阳性样品OD450nm-阴性样品OD450nm),计算各样品S/P 值的平均值和标准方差SD,当样品S/P值<+2SD时,判为阴性;样品S/P值>+3SD时,判为阳性;+2SD≤样品S/P值≤+3SD时,判为疑似。
1.8 双单抗夹心ELISA 方法评估
1.8.1 特异性试验采用优化后的双单抗夹心ELISA 方 法 分 别 对H1N1WSN、 IBVPJ18、 NDV、 EIAV、EHV、EAV 进行检测,根据S/P 值对该方法的特异性进行评价。
1.8.2 广谱性试验将HEK293T 细胞铺于六孔板中,细胞密度达80%时分别转染包含IAV 不同亚型流感病毒NP 基因(pCAGGS-H1N1SC09NP、pCAGGSH1N1WSNNP、pCAGGS-H3N2GD11NP、pCAGGS-H3N8JL98NP、pCAGGS-H5N1AH05NP、pCAGGS-H5N2AH07NP、pCAGGSH7N9ZJ13NP、 pCAGGS-H9N2ZJ12NP)的反向遗传系统质粒,拯救出包含不同亚型IAV NP 蛋白的假病毒粒子。8 h 后更换细胞培养液,48 h 后收集细胞上清液,利用本研究建立的双单抗夹心ELISA 方法检测不同亚型流感假病毒粒子,评价该方法的广谱性。
1.8.3 灵敏度试验将H1N1WSN2 倍倍比稀释(21~216倍),利用优化后的双单抗夹心ELISA 方法进行检测,同时利用血凝试验测定该病毒的HA 效价,评价该方法的灵敏度。
1.8.4 重复性试验取同一批次包被的ELISA 板,按优化后的双单抗夹心ELISA 方法检测H1N1WSN尿囊液样品,以H1N1WSN标准品按1∶200 稀释作为阳性对照,将未接种病毒的尿囊液按1∶200 稀释作为阴性对照,抗原抗体稀释液作为空白对照,测定OD450nm值,计算批内变异系数。取不同批次包被的ELISA板,按照优化的双单抗夹心ELISA 方法检测H1N1WSN尿囊液样品,按上述分别设置阴、阳性及空白对照,计算批间变异系数。评估该方法重复性。
1.9 临床样品检测将本实验室保存的28 份马鼻拭子样品利用本研究建立的双单抗ELISA 方法检测;同时提取其核酸,采用反转录PCR(RT-PCR)方法(参照国家卫生行业标准,WS 285-2008,流行性感冒诊断标准)对样品进行检测。比较二者的检测结果,并计算二者的符合率。
2 结 果
2.1 流感病毒NP 蛋白GST 标签真核表达质粒及蛋白表达的鉴定结果利用同源重组技术构建重组质粒pCAGGS-GST-H3N8XJ07NP 和pCAGGS-GST-H1N1SC09NP,经菌液PCR 鉴定,结果显示扩增获得约为2 100 bp的目的条带,与GST-H3N8XJ07NP 和GST-H1N1SC09NP片段相符。同时,测序结果显示各目的基因序列和阅读框均正确,表明正确构建了以上各重组质粒。将pCAGGS-GST-H3N8XJ07和pCAGGS-GST-H1N1SC09NP转染HEK293T 细胞进行western blot 检测。结果显示,在70 ku 出现特异性条带,而空载体对照未见该条带(图1)。表明带有GST 标签的NP 蛋白重组质粒均可以在细胞内正确表达。
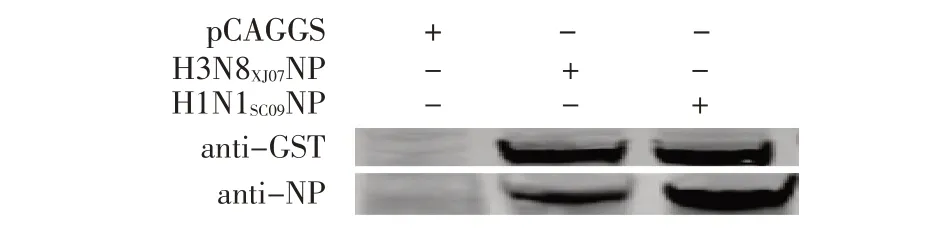
图1 带有GST 标签的NP 蛋白重组质粒表达的western blot 检测Fig.1 GST-tagged NP recombinant plasmid expression detected by western blot
2.2 H3N8XJ07NP 和H1N1SC09NP 蛋白的制备和纯化结果将pCAGGS-GST-H3N8XJ07NP 和pCAGGS-GSTH1N1SC09NP 重组质粒分别转染HEK293T 细胞表达纯化后,GST 标签蛋白纯化试剂盒纯化NP 蛋白,SDS-PAGE检测结果显示纯化蛋白大约为55 ku,与预测蛋白大小相符(图2),经紫外分光光度计测定蛋白浓度为1 mg/mL。

图2 NP 蛋白的SDS-PAGE 检测结果Fig.2 SDS-PAGE of NP protein
2.3 鼠抗NP 蛋白MAb 的制备、纯化和HRP 标记结果本试验共进行3 次克隆纯化,获得了21 株分泌MAb 的单克隆细胞。挑选出3 株单克隆细胞扩大培养,并注射小鼠腹腔,获得3株MAbs,通过western blot 筛选到这3 株MAbs 针对的不同抗原表位:XJ04 可识别NP蛋白第168~333位氨基酸序列、SC06可识别全长NP 蛋白序列、SC12 可识别NP 蛋白第1~167 氨基酸序列。3 株MAbs 纯化后稀释至浓度为2 mg/mL。将纯化的3株抗体经HRP标记,终浓度为1 mg/mL。
2.4 双单抗夹心ELISA 方法标准曲线的建立
2.4.1 双单抗夹心ELISA 方法的MAb 和反应条件的优化结果经优化,该ELISA 方法捕获抗体为SC06,包被量为0.1 μg/孔;检测抗体为XJ04,使用量为0.05 μg/孔。最佳反应条件见表2。

表2 双单抗夹心ELISA 最佳反应条件的优化结果Table 2 Optimization of the best reaction conditions for sandwich ELISA
2.4.2 双单抗夹心ELISA方法标准曲线的建立利用优化后的双单抗夹心ELISA 方法进行检测,结果显示H1N1SC09NP 蛋白标准品在4.88 ng/mL~78.13 ng/mL 时呈良好的线性关系,标准曲线为y=56.565x-2.086,R2=0.9999(图3A)。H1N1WSN标准品中的NP 蛋白含量在6.07 ng/mL~101.6 ng/mL 时呈良好的线性关系,标准曲线为y=56.63x-2.156,R2=0.9999(图3B)。

图3 双单抗夹心ELISA 标准曲线Fig.3 Standard curve of double-monoclonal antibody sandwich ELISA standard curve
2.5 阴阳性临界值的确定利用双单抗夹心ELISA方法对30 份马鼻拭子阴性样品进行检测,经计算,S/P 值 的 平 均 数=0.084,S/P 值 的 标 准 方 差SD=0.052。+2SD=0.272,+3SD=0.382。当 样 品S/P值<0.272 时,判为阴性;当样品S/P 值>0.382 时,判为阳性;当0.272≤样品S/P 值≤0.382 时,判为疑似(表3)。

表3 30 份马鼻拭子阴性样品的ELISA 检测结果Table 3 Results of negative samples of equine nose swabs deteced by ELISA test
2.6 双单抗夹心ELISA 方法评估
2.6.1 特异性试验结果采用优化后的双单抗夹心ELISA 方法检测IAV、IBV、EDV、以及几种马常见病原,结果显示,除IAV S/P 值为1.32 为阳性外,其余病毒的S/P 值均在0.1 以下为阴性(图4),无交叉反应,表明本研究建立的双单抗夹心ELISA 检测方法特异性较强。
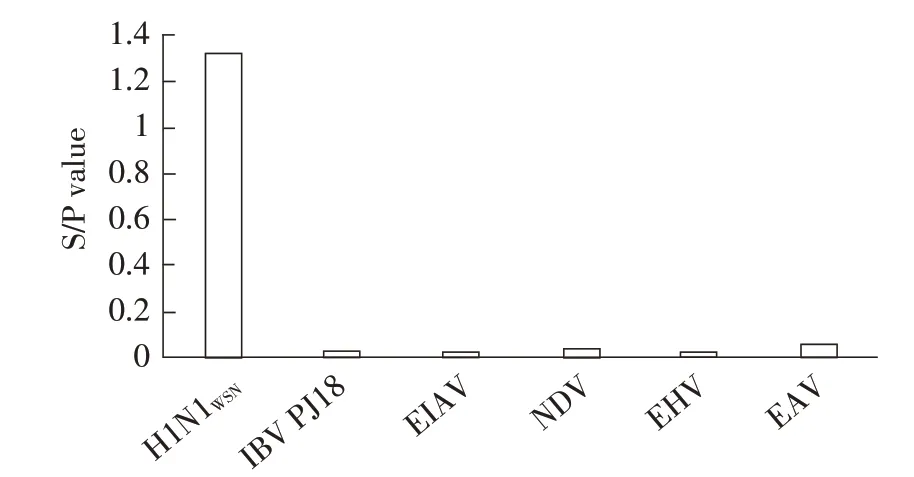
图4 双单抗夹心ELISA 特异性试验结果Fig.4 Specific test results of double-monoclonal antibody sandwich ELISA
2.6.2 广谱性试验结果利用本研究建立的双单抗夹心ELISA 方法检测IAV 不同亚型假病毒粒子,测定OD450nm值,根据上述病毒标准曲线方程y=56.63x-2.156 计算假病毒粒子的NP 蛋白量,结果显示本研究建立的NP 蛋白双单抗夹心ELISA 方法能够识别多种IAV 亚型包装的流感假病毒粒子中的NP 蛋白(图5)。表明本研究建立的双单抗夹心ELISA 方法广谱性好,能检测多个亚型的IAV。
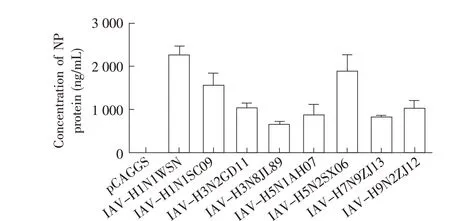
图5 双单抗夹心ELISA 广谱性试验结果Fig.5 Broad-spectrum test results of double-monoclonal antibody sandwich ELISA
2.6.3 灵敏度试验结果将血凝效价为8 log2H1N1WSN样品2 倍倍比稀释(21~212)后,用双单抗夹心ELISA方法检测,结果显示ELISA方法经212倍稀释后仍检测为阳性,检出的病毒NP 蛋白含量为20 ng/mL,相同病毒样品血凝试验只能检测到27倍稀释的H1N1WSN样品,并且不能检测病毒含量(表4)。表明该ELISA 检测方法的灵敏度远高于血凝试验。

表4 双单抗夹心ELISA 灵敏性试验结果Table 4 Sensitivity test results of double-monoclonal antibody sandwich ELISA
2.6.4 重复性试验结果利用本研究建立的双单抗夹心ELISA 方法对H1N1WSN尿囊液样品进行批内、批间重复性试验,并计算批内批间重复性试验的变异系数。结果显示,批内变异系数为2.230%~7.188%,批间变异系数为3.956%~6.505%,变异系数均小于8%(表5)。表明该方法重复性和稳定性均较好。
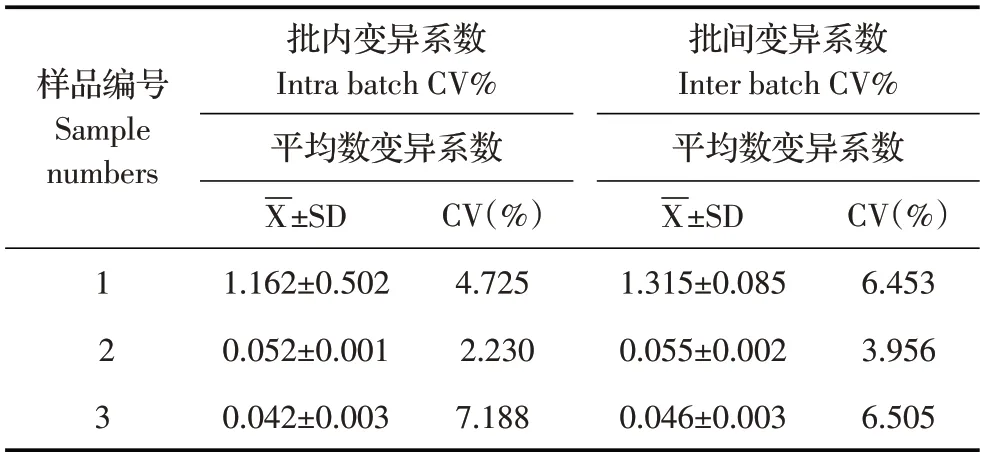
表5 双单抗夹心ELISA 重复性试验结果(n=3)Table 5 Reproducibility test results of double-monoclonal antibody sandwich ELISA(n=3)
2.7 临床样品检测结果利用本研究建立的双单抗夹心ELISA 方法和RT-PCR 方法同时检测28 份马鼻拭子样品,结果显示本研究建立的方法检测出12份IAV 阳性样品,16 份IAV 阴性样品,RT-PCR 方法检测出20 份IAV 阳性样品,8 份IAV 阴性样品。经计算两种方法的符合率为71.43%。表明本研究建立的双单抗夹心ELISA 方法可以应用于临床样品的检测,但其检测的灵敏度不及RT-PCR 方法,需要进一步优化和改进。
3 讨 论
流感病毒的抗原易变性和传播广泛性给流感的诊断和防控造成很大困难,因此建立精确又快速的诊断方法对流感的防控至关重要。流感病毒作为负链分节段RNA 病毒,其基因组变异率高、抗原漂移、抗原转换等特性导致其抗原变异性高,变异速度快[12]。因此选择适宜的靶标,提高检测的广谱性、灵敏性是建立流感病毒检测方法的难点。本研究通过比对2005 年~2017 年不同亚型IAV(H1~H13)的HA 和NP 的氨基酸序列,发现在IAV 中HA 的氨基酸序列突变率较高,而NP 蛋白的氨基酸序列具有较高的保守性。因此,本研究选择IAV 保守的NP蛋白作为检测靶点。
本研究在MAb 制备过程中采用先免疫含NP 基因的重组质粒后免疫真核表达的NP 蛋白的免疫程序。NP 蛋白仅用于融合前加强免疫,与常规的原核系统纯化蛋白,并全部用蛋白免疫的程序[13]相比减少了免疫过程中NP 蛋白的用量。通过这种免疫方法获得的MAb 特异性更强,与流感病毒NP 蛋白结合的亲和力更高。相对于其它采用单抗捕获-酶标多抗检测的双抗夹心ELISA 检测方法[14],本研究通过抗原表位筛选,选取两株针对不同抗原表位的高亲和力MAb 进行配对建立双单抗夹心ELISA 方法。该方法通过两株MAb 对抗原进行检测,可保证检测结果的准确性。选择酶标MAb 作为检测抗体,虽然该检测抗体仅与单一抗原表位结合,但MAb 比多克隆抗体具有更高的亲和力,因此该双单抗夹心ELISA方法在具备更强的特异性的同时能够保证方法的灵敏性。本研究建立的双单抗夹心ELISA 方法能够特异性检测多种亚型的IAV,并且具有较好灵敏度和重复性。该ELISA 检测方法比实验室普遍采用的血凝试验灵敏性更高,可以对血凝试验阴性的疑似样品进行检测,从而降低检测过程的假阴性率。
利用该双单抗夹心ELISA 方法与RT-PCR 方法同时检测28 份马鼻拭子样品,二者的符合率为71.43%。PCR 方法(常规PCR、荧光定量PCR)是指数倍数扩增基因片段,能将待检样品中的核酸信号呈指数倍数放大。而双单抗夹心ELISA 方法中每个NP 蛋白只能和一个MAb 结合,因此ELIA 检测方法对信号的放大效应要低于PCR 扩增方法。双单抗夹心ELISA 方法灵敏度虽不及RT-PCR 方法,但该双单抗夹心ELISA 方法操作简单快捷、对实验人员和设备要求低、花费成本也低,可以用于检测样品的初筛,减少后续检测的工作量,提高检测的效率和准确性。
在天然免疫信号分子、跨种传播限制因子、小分子抑制、疫苗、药物的研发等流感病毒科学研究的各个领域,评价流感病毒在宿主细胞内的复制水平都是至关重要的。常用于测定病毒载量的指标包括:TCID50、病毒感染空斑试验(FFU)、HA 效价、ELISA 等[15-17],相比较于ELISA,TCID50、FFU 等测定方法虽然准确性高但操作繁琐耗时较长;而血凝试验虽然简单快捷但敏感性差,不能准确定量病毒;而本研究利用重组蛋白制备的标准曲线与利用流感病毒制备的标准曲线十分接近,因此通过本研究建立的双单抗夹心ELISA 方法测定样品中IAV NP 蛋白的含量,能够间接反映出样品中流感病毒的含量,而且操作简单对实验条件和人员要求低。所以本研究建立的快速检测的双单抗夹心ELISA 方法不仅可以用于临床样品的检测,还能应用于基础研究中。
综上所述,本研究建立的双单抗夹心ELISA 流感病毒检测方法具备操作简单、成本低廉、广谱性好、灵敏度高等优点,具备潜在的应用价值,可为流感病毒的快速检测提供有力的技术支持。
