原发性三叉神经痛患者脑结构和功能连接改变
2020-08-06李丹,卜岗,张明,王渊*
李 丹,卜 岗,张 明,王 渊*
(1.西安交通大学第一附属医院呼吸与危重症医学科,2.医学影像科,3.疼痛科,陕西 西安 710061)
三叉神经痛(trigeminal neuralgia, TN)是常见的神经病理性疼痛,临床表现为三叉神经分布区的针刺样、烧灼样、电击样疼痛[1],约85% TN为原发性(primary TN, PTN),桥前池内血管-神经压迫(neurovascular compression, NVC)是其经典解剖学变异,疼痛信息不断沿三叉丘系上传至大脑皮层,导致PTN患者痛觉相关脑区发生结构和功能水平改变。目前国内外PTN研究多为解剖学定性和定量检测桥小脑脚区变异血管与三叉神经[2-3],仅少数文献[4-7]报道PTN患者存在脑内灰白质结构和功能改变,罕见针对脑结构和功能的综合研究报道。本研究联合应用基于体素的形态学(voxel-based morphometry, VBM)和种子点功能连接(functional connectivity, FC)技术定量观察PTN患者脑内形态学和功能活动异常,以期为评估病情和评价疗效提供客观依据。
1 资料与方法
1.1 一般资料 收集2012年6月—2018年5月于西安交通大学第一附属医院确诊的38例PTN患者(PTN组),男16例,女22例,年龄37~74岁,平均(55.8±8.3)岁,均符合国际头痛协会发布的PTN诊断标准:①突发头面部疼痛,持续时间通常不超过2 min;②疼痛具有下述特征[8]:局限于三叉神经支配区;为突发性剧烈电击痛、烧灼痛;可有固定扳机点;③无神经系统器质性损害。同期招募38名年龄、性别匹配的正常志愿者作为对照组,男16名,女22名,年龄37~73岁,平均(56.1±8.5)岁。根据爱丁堡利手量表(Edinburgh handedness inventory), 所有受试者均评估为右利手。排除标准:①继发性TN;②其他类型头面部疼痛;③严重躯体或精神疾病;④药物、酒精依赖;⑤曾接受微血管减压术。
由1名高年资疼痛科医师采用视觉模拟评分(visual analogue scale, VAS)测定PTN组痛觉水平,记录疼痛病程、发作频率及持续时间等指标。本研究经院医学伦理委员会论证并通过,受试者均签署知情同意书。
1.2 仪器与方法 采用GE Signa HDxt 3.0T超导型MR系统,先行常规扫描排除脑内器质性病变,包括轴位T1W、T2W及冠状位T2-液体衰减反转恢复(fluid attenuated inversion recovery, FLAIR)序列。PTN组先以快速扰相梯度回波(fast spoiled gradient acquisition in the steady-state, FSPGR)序列采集全脑三维结构成像,TR 10.7 ms,TE 4.9 ms,视野 256 mm×256 mm,矩阵256×256,翻转角15°,层厚 1 mm,间隔0 mm,共144层,扫描时间5 min 49 s;之后行静息态功能MRI (resting-state functional MRI, rs-fMRI),采用梯度回波(gradient echo, GRE)-平面回波成像(echo planar imaging, EPI)序列,TR 2 000 ms,TE 35 ms,视野240 mm×240 mm,矩阵64×64,翻转角90°,层厚 4 mm,间隔0 mm,共扫描35层、获得150幅时间容积图像,时间6 min 10 s。
1.3 数据处理
1.3.1 VBM数据处理 采用SPM 8软件及VBM 8插件,步骤如下:①图像翻转(Flip):将16例左侧TN患者的三维解剖图像沿X轴翻转到右侧(22例),以增加PTN组侧别一致性[9];②图像分割(Segmentation):分割全部受试者结构像,得到全脑灰质、白质和脑脊液图像,同时计算个体在标准模板上的仿射变换矩阵;③生成模板:利用仿射变换矩阵信息计算非线性变形场,配准受试者灰质和白质图像并进行加权,创建灰质和白质模板;④空间标准化(Normalization):以蒙特利尔神经研究所(Montreal neurological institute, MNI)空间对配准产生的灰白质模板进行标准化,使脑结构像在空间上相互匹配;⑤平滑(Smooth):采用8 mm半高全宽(full-width at half maximum, FWHM)进行空间平滑;⑥比较组间灰质体积(grey matter volume, GMV)差异:采用广义线性模型对灰质图像数据行组间两样本t检验,设定体素水平(voxel-level)P<0.001,簇水平(cluster-level)P<0.05(FDR校正),以连续体素>100的体素簇为组间GMV差异有统计学意义的脑区。
1.3.2 rs-fMRI数据处理 采用SPM 8和DPARSF[10]软件处理rs-fMRI数据,利用REST软件[11]呈现结果,步骤如下:①选择时间点:去除前10个时间点数据;②层面时间校正(Slice Timing):对各层fMRI之间的时间差进行校正,使所有层面图像接近于同时采集;③头动校正(Realign):平动≤2.0 mm和/或旋转≤2.0°均在校正范围内;④空间标准化、平滑及滤波(Filter):对头动校正后图像按照MNI空间进行标准化,体素为3 mm×3 mm×3 mm;采用FWHM为6 mm的高斯平滑核进行空间平滑,然后选择低频滤波(0.01~0.08 Hz)去除高频噪声;⑤FC:以VBM分析组间GMV差异有统计学意义脑区的中心坐标,ROI半径为6 mm,完成种子点设定,批量分析各种子点与全脑其他区域的信息相关性,并对2组FC强度行两样本t检验,设定体素水平(voxel-level)P<0.001,簇水平(cluster-level)P<0.05(FDR校正),以连续体素>100的体素簇为组间存在FC差异的脑区。
1.4 统计学分析 对组间差异脑区的GMV和种子点FC强度与患者疼痛特征(VAS评分、发作频率、持续时间、病程)进行偏相关分析(年龄、性别、全脑体积作为协变量),以P<0.05为差异有统计学意义,观察上述临床指标与PTN患者脑灰质结构和FC之间是否存在相关性。
2 结果
2.1 一般资料 PTN组与对照组性别、年龄差异均无统计学意义(P均>0.05)。PTN组病程为(7.05±5.32)年,VAS为5.79±1.70,疼痛发作频率为(5.90±5.83)次/日,持续时间(1.32±0.77)min,见表1。
2.2 灰质形态学改变 PTN组全脑GMV较对照组轻度降低(P<0.05),而组间全脑体积、白质体积和脑脊液体积差异均无统计学意义(P均>0.05),见表1。PTN患者存在多个脑区皮层GMV缩小,包括扣带回前部(anterior cingulate cortex, ACC)、扣带回中部(mid-cingulate cortex, MCC)、右侧岛叶(insula, Ins)/第二躯体感觉区(secondary somatosensory cortex, S2)、左侧初级运动皮质(primary motor cortex, M1)、左侧运动前区(premotor area, PMA)和双侧颞叶多个脑区,未见GMV增加脑区(P<0.05,FDR校正),见图1、表2。
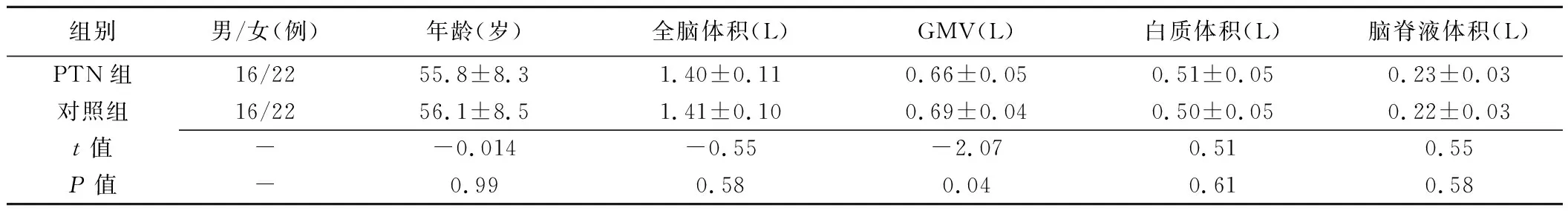
表1 2组一般资料

表2 PTN组GMV缩小脑区

图1 PTN组GMV缩小脑区(蓝色)(P<0.05,FDR校正)
2.3 种子点FC差异 以VBM获得的组间GMV差异脑区作为种子点行全脑FC分析,PTN组右侧Ins/S2与ACC、前额叶内侧部(medial prefrontal cortex, mPFC)、扣带回后部(posterior cingulate cortex, PCC)和双侧前额叶背外侧部(dorsal lateral prefrontal cortex, DLPFC)之间的FC均高于对照组(P均<0.05,FDR校正),未见FC减低区,见图2、表3。右侧Ins/S2与ACC的FC强度与PTN患者的VAS呈线性负相关(r=-0.552,P<0.01),与其他临床指标未见明显相关。
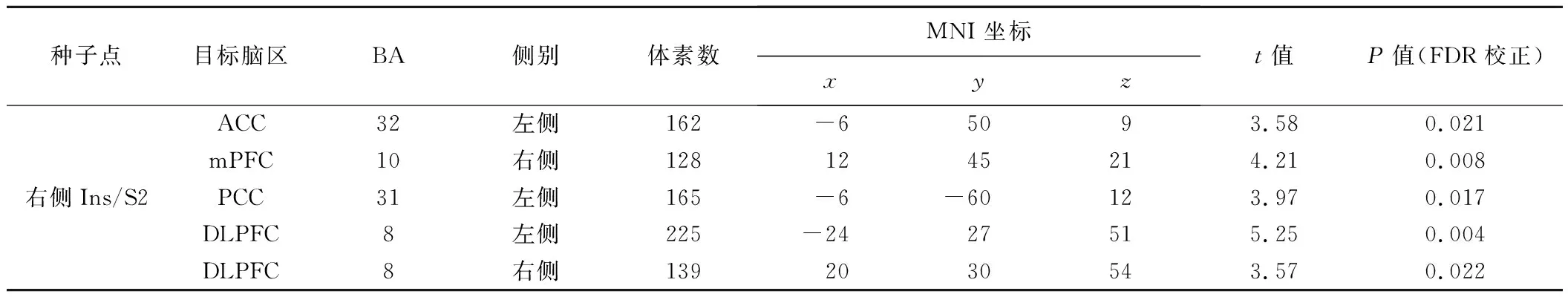
表3 PTN组种子点FC增强脑区
3 讨论
PTN患者存在脑内灰白质结构和功能改变[4-7]。本研究着重观察头面部剧烈疼痛对PTN患者灰质结构和FC的影响以及影像学指标与临床表现的相关性。
本研究VBM结果显示PTN患者双侧颞叶多个脑区GMV缩小,以双侧颞下回(inferior temporal gyrus, ITG)最为明显。ITG虽然并非痛觉信息处理的核心脑区,但可能负责与疼痛负性情绪相关的记忆功能,且已在记忆受损偏头痛患者中得到印证[12]。解剖和生理心理学研究[1]均支持ITG与杏仁核和海马之间存在双向联系,参与情绪调节,双侧ITG萎缩可能与PTN患者顽固性疼痛诱发的记忆力减退和情绪障碍有关。此外,PTN患者MCC的GMV缩小为本研究的另一重要发现。早期疼痛研究并未对MCC结构和功能改变予以足够重视,而近年发现MCC同样参与伤害感受性信息的多维度调节,包括疼痛感受、负性情绪和认知调控,如下腰痛[13]及颞下颌关节功能紊乱综合征[14]患者同样存在MCC体积缩小。慢性疼痛患者还出现运动相关脑区(M1和PMA) GMV缩小,其机制尚未明确,推测可能是机体对持续性痛觉信息的适应性反应,或抑制下颌活动以避免诱发疼痛所致[15]。
另一方面,PTN患者同时存在FC网络异常,以PTN组GMV缩小脑区右侧Ins/S2为种子点,与ACC、mPFC、PCC和双侧DLPFC的FC普遍高于对照组,主要涉及突显网络和默认网络两个特定网络。作为突显网络的重要节点,Ins和ACC也是疼痛网络的关键脑区,ACC与Ins前后亚区之间均存在纤维联系,共同负责机体对外界伤害性刺激做出适当反应[16];同时,右侧Ins/S2与ACC之间的FC强度与PTN患者VAS呈线性负相关。颞下颌关节功能紊乱综合征患者Ins-ACC的FC紧密程度亦与疼痛水平呈负相关[17],原因可能在于高强度疼痛更易破坏痛觉网络间功能联系,不仅可引起痛觉相关脑区形态学改变,也会导致这些关键脑区之间的信息交流障碍。
DLPFC为反馈下行信息的重要脑区,对其在痛觉调节方面的作用仍有争议。SEMINOWICZ等[18]提出DLPFC不仅与痛觉信息检测有关,并与痛觉抑制相关。以往fMRI研究提示痛觉过敏者双侧DLPFC活动与疼痛主观感受和不愉快感均呈负相关;DLPFC与感觉运动皮层存在广泛纤维联系,以引起适当的注意、情绪反应和躯体运动[19]。本研究中PTN组右侧Ins/S2种子点与双侧DLPFC的FC均增强,而Ins种子点与左侧DLPFC连接更为紧密,提示这一局部FC异常可能对协助评估痛觉强度及继发注意力集中和情绪障碍有一定作用;PTN组右侧Ins与PCC和mPFC的FC均增强,提示相应脑区参与异常痛觉信息处理。在外界疼痛刺激下,作为默认网络的重要节点,PCC和mPFC显示出稳定的负激活[20]。PTN引起颜面部间断性剧痛,对于疼痛的预期效应使上述脑区无法处于真正的休息状态,导致其默认网络产生某些连接属性异常。
综上,本研究提示PTN患者存在脑内结构和功能活动多维度改变,双侧颞叶多个亚区GMV缩小为其较特异性改变,而右侧Ins/S2与ACC的FC强度与疼痛水平密切相关,有助于为评估病情和筛选治疗靶点提供客观依据。
