基于免疫组化法研究MMP-2、MMP-14与颈动脉粥样斑块易损性的相关性
2020-08-06郭周颖张淑琴秦颢诚李洪娥
郭周颖,张淑琴,秦颢诚,于 明,李洪娥
动脉粥样硬化是缺血性卒中发生发展的重要病理和临床基础[1,2],其中易损斑块的形成以及随之形成的血栓是脑血管疾病致残、致死的重要原因,易损斑块主要以薄的纤维帽和富含脂质坏死核心、斑块内出血、活动性炎症及钙化为特征[3],具有偏心性分布、不规则表面、糜烂、溃疡等特征。研究表明约有2/3的脑血管事件是由易损斑块的破裂造成的[4]。因此,研究易损斑块的形成机制对缺血性卒中的防治尤为重要。
基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)又称明胶酶A,它表达广泛,能够降解明胶、胶原和多种基底膜成分,对于平滑肌细胞的增殖和迁移起着重要作用。这些作用可能促进了动脉粥样硬化的形成和进展[5]。基质金属蛋白酶-14(matrix metalloproteinase-14,MMP-14)是膜型基质金属蛋白酶的一种,它广泛存在于基底膜并能降解胶原酶Ⅰ、Ⅱ、Ⅲ和活化MMP-2[6]。相关研究表明MMP-14在巨噬细胞丰富的动脉粥样硬化斑块中表达丰富[7]。
鉴此,本研究在获取颈动脉内膜剥脱术(CEA)术后颈动脉斑块组织后,依据患者术前相关影像学检查及斑块组织形态学表现,将颈动脉粥样斑块分为稳定斑块组与易损斑块组,运用HE染色及免疫组织化学技术对两组斑块中的MMP-2及MMP-14的表达进行分析,探究相关MMP-2和MMP-14影响易损斑块发生、发展的可能机制。
1 资料与方法
1.1 材料
1.1.1 研究对象 研究对象为2018年1月-2019年6月在连云港市第一人民医院神经外科行CEA的患者55例,其中男50例,女5例。平均年龄(67±6.9)岁。根据术前基于颈部血管超声(carotid doppler ultrasonography,CDU)的多模式影像学检查、术后斑块HE染色特征将斑块组织分为稳定斑块组23例,易损斑块组32例。
CEA纳入标准:根据北美症状性颈动脉内膜切除试验(NASCET)标准[8],(1)中度狭窄(狭窄程度大于50%)且有症状患者;(2)重度狭窄(狭窄程度70%~99%)但无症状患者。
CEA排除标准:出血性脑血管疾病、风湿性心脏病、房颤等引起的颈动脉狭窄;放射性颈动脉狭窄,病变位置超过第二颈椎;严重肝肾功能不良无法耐受手术等患者。
斑块组织收集后进行石蜡包埋,以便后续病理学免疫组化检测。研究对象术前均签署知情同意书。
1.1.2 分组标准 CDU评估易损斑块标准:斑块内部存在大片低回声、伴或不伴有斑块形态不规则或纤维帽不完整、斑块内见血流信号(溃疡型斑块)、斑块内出血。CDU评估稳定斑块标准:斑块呈中等均质回声,斑块形态规则、纤维帽完整或斑块呈均质中等回声或强回声。
病理学评估易损斑块标准[9]:主要标准(1)活动性炎症(单核细胞或巨噬细胞有时伴T淋巴细胞浸润);(2)薄纤维帽(厚度<65 μm)伴大的脂质核心(脂质成分>40%);(3)血管内皮细胞脱落伴表面有血小板聚集;(4)存在裂隙或受损伤的斑块;(5)血管严重狭窄>90%。次要标准:(1)斑块表面结节性钙化,(2)内镜下黄色反光;(3)斑块内出血及新生血管形成;(4)内皮细胞功能障碍;(5)血管扩张性(正性)重构。
1.2 方法
1.2.1 HE染色 CEA术后斑块进行多节段切面观察粥样斑块形态学表现,然后用4%多聚甲醛溶液固定,脱钙、脱水后石蜡包埋,以5 μm层厚进行组织切片HE染色,观察斑块纤维帽、脂质坏死核心、出血、钙化等。
2.4 两组AECOPD患者肺功能检查结果 两组AECOPD 患 者 肺 功 能 比 较 ,FEV1、FEV1/FVC、FEV1%均有统计学差异,患者病情与FEV1/FVC、FEV1%呈负相关,见表4。
1.2.2 免疫组化 免疫组化检测稳定及易损斑块组织中MMP-2及MMP-14蛋白的表达。斑块组织先放入10%福尔马林溶液中,然后石蜡包埋,以5 μm层厚连续切片。(1)切片脱蜡水化:将切片置于二甲苯溶液中浸泡5 min,取出后置于100%无水乙醇溶液中浸泡3 min,然后依次浸入70%~90%的各级酒精中3 min,最好用PBS溶液冲洗切片3次,每次3 min;(2)参照一抗说明书进行抗原修复;(3)配制DAB工作液:按每毫升B液(DAB稀释液)加入1滴C液(DAB原液)的比例配制工作液,避光保存;(4)实验步骤:①抗原修复后待切片自然冷却,用PBS溶液冲洗切片三次,每次3 min;②将擦拭干净的切片置于湿盒中,滴入3%的过氧化氢进行阻断,然后避光孵育10 min后,用PBS溶液冲洗切片三次,每次3 min,最后将切片擦拭干净;③滴加100 μL一抗工作液于切片中,孵育60 min后,用PBS溶液冲洗切片3次,每次3 min,并将切片擦拭干净;④滴加100 μL A工作液,孵育30 min,并用PBS溶液冲洗切3次,每次3 min,将切片擦拭干净;⑤加入准备好的DAB工作液100 L,孵育切片10 min后,用蒸馏水冲洗,在光镜下控制显色效果,必要时用苏木精复染;⑥用各级酒精(70%~100%)脱水、每级3 min,然后置于二甲苯中,最后封片观察。

2 结 果
2.1 患者相关危险因素统计 纳入分析患者的年龄、性别、一过性黑蒙、短暂性脑缺血发作、卒中史、高血压、糖尿病、高血脂、吸烟史、他汀类药物服用史、血管狭窄率等临床数据(见表1)。表中显示,易损斑块的发生与性别具有相关性,男性相较于女性更容易发展成易损斑块。同时具有易损斑块的患者相较于具有稳定斑块的患者更容易发生TIA。其他临床特征和危险因素在两组斑块中的差异没有统计学意义。
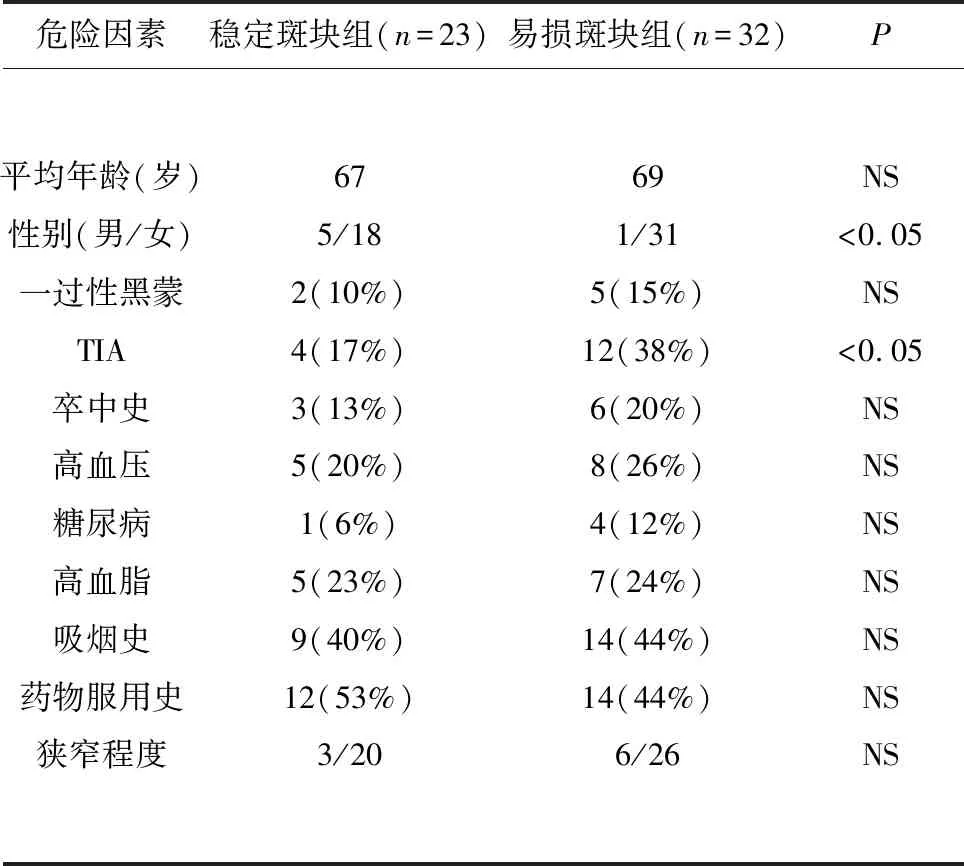
表1 患者一般情况及相关危险因素分析
相关检验指标的诊断标准如下:高血压(收缩压≥160 mmHg);高脂血症(总胆固醇≥220 mg/dl);糖尿病(空腹血糖≥126 mg/dl);吸烟史(≥15 y)。
2.2 稳定斑块及易损斑块的CDU和病理学特征 稳定斑块的CDU及HE染色特征(见图1);易损斑块的CDU及HE染色特征(见图2)。放大的易损斑块的局部组织学特征(见图3)。
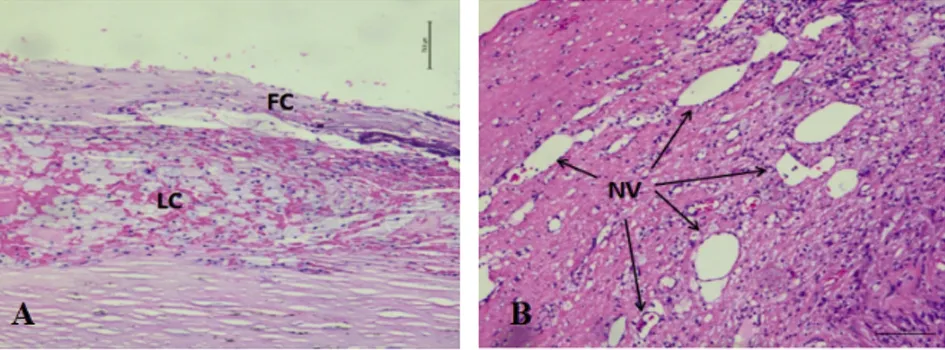
图3 易损斑块的组织学特征 A:可见易损斑块薄的纤维帽(FC)及较大脂质核心(LC);B:可见易损斑块内丰富的新生血管(NV)
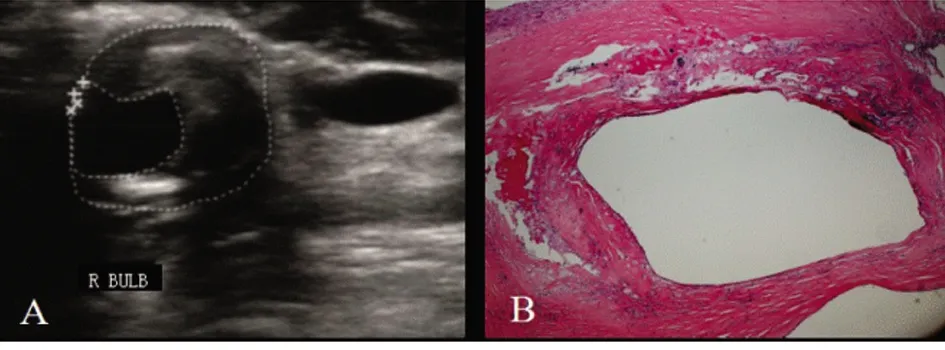
图2 A:易损斑块超声表现为斑块形态不规则,纤维帽不完整,斑块内可见血流信号(蓝色箭头所示),呈混合不均质回声。B:易损斑块病理(HE×10):斑块纤维帽破裂不连续、其内可见血栓、新生血管、脂质核心及较多炎性细胞
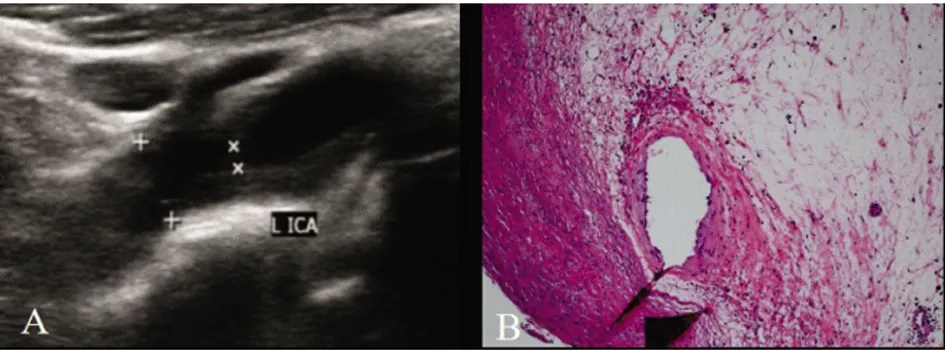
图1 A:稳定斑块超声表现为斑块表面光滑,纤维帽完整;B:稳定斑块病理(HE×10):斑块纤维帽完整连续、表面光滑,其内纤维成分居多
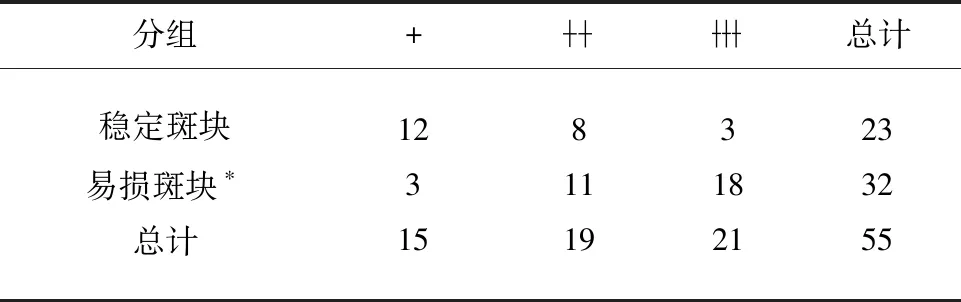
表2 MMP-2在稳定和易损斑块组中染色程度的统计分析
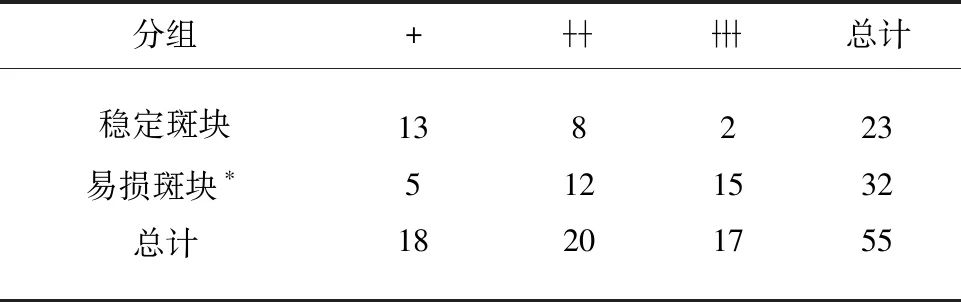
表3 MMP-14在稳定和易损斑块组中染色程度的统计分析
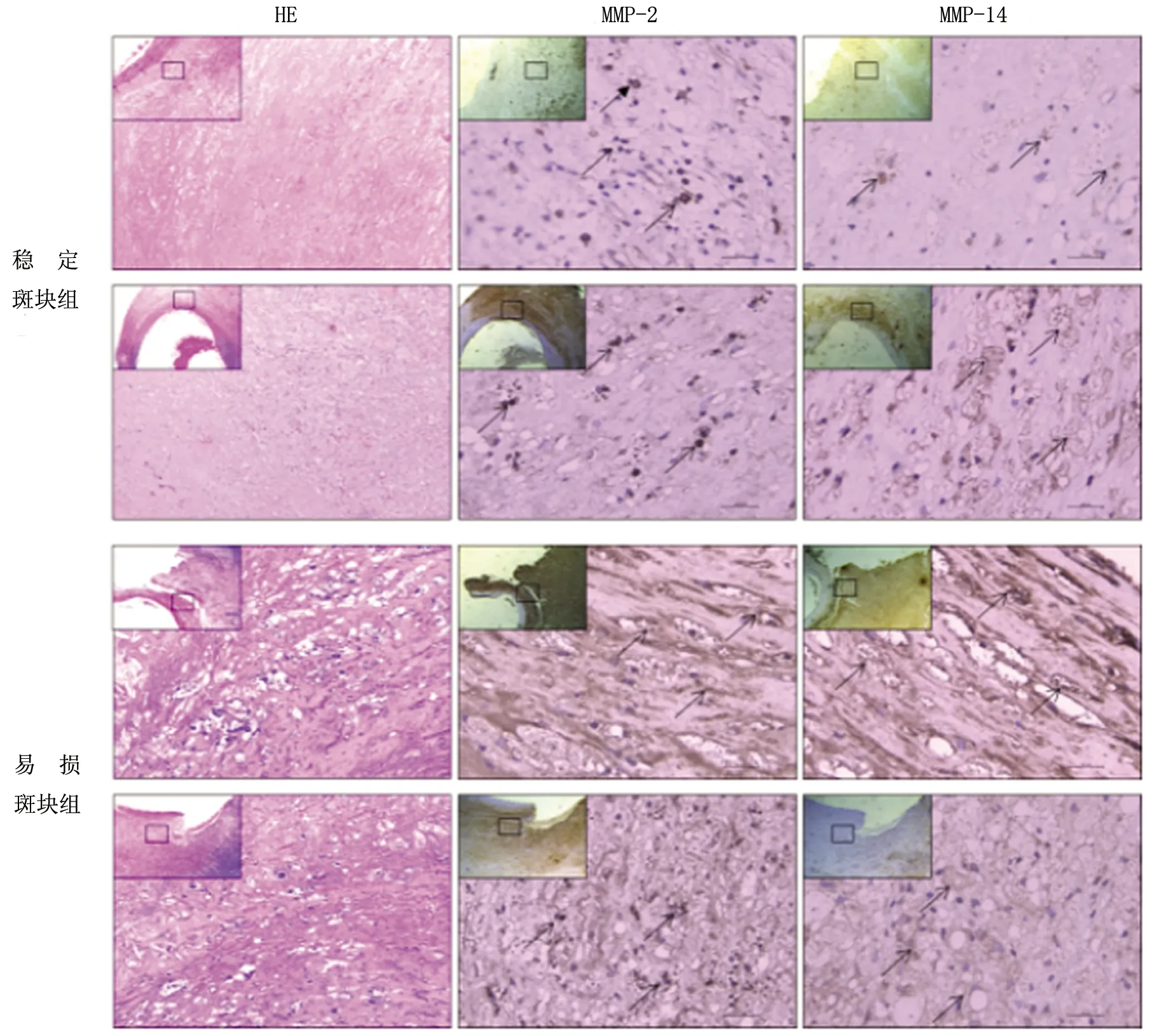
图4 MMP-2,MMP-14在稳定斑块组及易损斑块组的免疫组化结果比较(图中箭头表示染色集聚区域)
3 讨 论
动脉粥样硬化是脑卒中发生发展的重要病理和临床基础,研究表明,颈动脉粥样斑块尤其是易损斑块与缺血性卒中密切相关[10]。我们研究并收集CEA术后的颈动脉斑块组织,根据患者术前相关影像学表现及病理特征分为稳定斑块组、易损斑块组,稳定斑块一般具备脂核小、纤维帽厚、炎症反应轻等特点,不易形成急性缺血事件;易损斑块具有纤维帽薄,脂质核心大及炎症细胞丰富的特点,易损斑块破裂的概率高,因此形成血栓栓塞的危险性也高[11,12]。
越来越多的证据表明MMPs是降解细胞外基质(ECM)导致斑块破裂的重要影响因子[13]。依据他们的结构和底物特异性,MMPs分为5类:(1)间质胶原酶:MMP-1、8、13、18,主要降解Ⅰ、Ⅱ、Ⅲ型胶原纤维;(2)明胶酶:MMP-2、MMP-9,主要降解弹性蛋白酶及基底膜的主要成分Ⅳ型胶原纤维;(3)间质溶解素:MMP-3、MMP-7、MMP-10、MMP-11、MMP-12,可降解大多数ECM 的主要成分,包括蛋白多糖、层粘连蛋白等;(4)膜型基质金属蛋白酶:MMP-14、MMP-15、MMP-16、MMP-MMP-17、MMP-24、MMP-25,能够直接降解多种ECM 成分并激活其它MMPs,由于其分布在细胞膜表面,所以被认为在细胞迁移中发挥着重要作用;(5)其他MMPs[14]。
本研究通过免疫组织化学方法对两组斑块组织中的相关因子进行定位分析。我们对斑块进行连续组织切片研究MMP-2,MMP-14蛋白在稳定和易损斑块组中的分布。结果显示:两组颈动脉斑块在不同强度下均被MMP-2和MMP-14染色。与稳定的斑块相比,其在易损斑块组中的染色更明显更强烈,且在溃疡型斑块,斑块纤维帽破裂等处分布水平较高,而巨噬细胞和泡沫细胞主要分布在斑块破裂的部位。以上结果均表明:MMP-2、MMP-14的过表达可能参与了斑块的进展与破裂过程。
MMP-2是明胶酶的一种,其可由中性粒细胞、单核巨噬细胞、血管内皮细胞等细胞合成并以无活性的酶原形式分泌,MMP-2在体内通过纤溶酶等酶的水解而活化,其作用底物包括Ⅳ型胶原纤维等,这些胶原纤维是粥样斑块基底膜和纤维帽的重要组成部分。已有研究证实,MMP-2的过度表达在血管重构中发挥重要作用。MMP-2通过降解细胞外基质成分、增大内膜面积及细胞核密度等方式,为斑块的发展提供必要空间,当这种过程持续发展无法阻止时,可诱发斑块破裂[15]。已有研究表明,MMP-2在动脉粥样斑块以及基底部的血管内中膜、粥样硬化破裂处的平滑肌细胞、巨噬细胞、血管内皮细胞集聚处显著表达[16]。本研究发现MMP-2在易损斑块组的表达要显著高于稳定斑块组,且在易损斑块的破裂区域表达丰富,这同时也是巨噬细胞和泡沫细胞等炎性细胞集聚的部位。以上现象表明斑块内MMP-2的过度表达与斑块的稳定性存在明显的相关性,MMP-2是形成不稳定性斑块的一个重要促进因素。
最近研究表明,MMP-14通过调节ECM环境,在血管损害、血管壁的细胞迁移、内皮细胞生长、新生血管生成的过程中发挥着重要作用。对小鼠的骨髓移植研究证明巨噬细胞来源的MMP-14在斑块的稳定机制中发挥着至关重要的作用。同时作为一种膜型金属基质蛋白酶,MMP-14的表达水平同时影响MMP-2的活化与表达[17]。通过免疫组化结果可以发现MMP-14的分布区域与MMP-2是一致的,但MMP-14在斑块的分布则主要粘附于巨噬细胞表面,这也说明了MMP-14作为MMP-2的膜活化分子,对MMP-2在斑块内的表达起着信号传递的作用。总之,MMP-14不仅作为蛋白酶而且是一种信号分子影响着细胞的病理生理功能[18]。
综上所述,MMP-2和MMP-14在颈动脉粥样斑块中的表达水平与颈动脉易损斑块存在显著相关性,是影响斑块稳定性的重要因子。本实验研究只进行了体内斑块的表达研究,缺乏对斑块进展的动态研究,具有一定的局限性。未来可在体外进行相应的细胞水平及动物模型研究,以便更加深入地进行相关因子的干扰调控或者信号通路的研究,从而为预测及治疗易损斑块寻找更为有效的方法。
