盆腔腹膜高分化乳头状间皮瘤临床病理分析
2020-08-05刘素贞王文珊龚庆琳
刘素贞,王文珊,龚庆琳
(1.衢州市妇幼保健院,浙江 衢州 324000;2浙江大学医学院附属妇产科医院,浙江 杭州 310006)
高分化乳头状间皮瘤(WDPM)是一种相对少见的间皮瘤亚型[1],最常见于育龄期妇女[2],但也可见于男性和绝经后妇女,与石棉接触史无明确相关性[3]。常发生于腹膜,较少可见于胸膜、心包、阴道和睾丸。该肿瘤的生物学行为不明确,被认为是一种具有恶性潜能的肿瘤。本文报道9例WDPM,结合文献阐述其病理特征,以提高对其的认识。
1 资料与方法
1.1 一般资料 收集2014-2019年9例盆腔腹膜高分化间皮瘤病例(衢州市妇幼保健院5例,浙江大学医学院附属妇产科医院4例),基本资料详见表1。
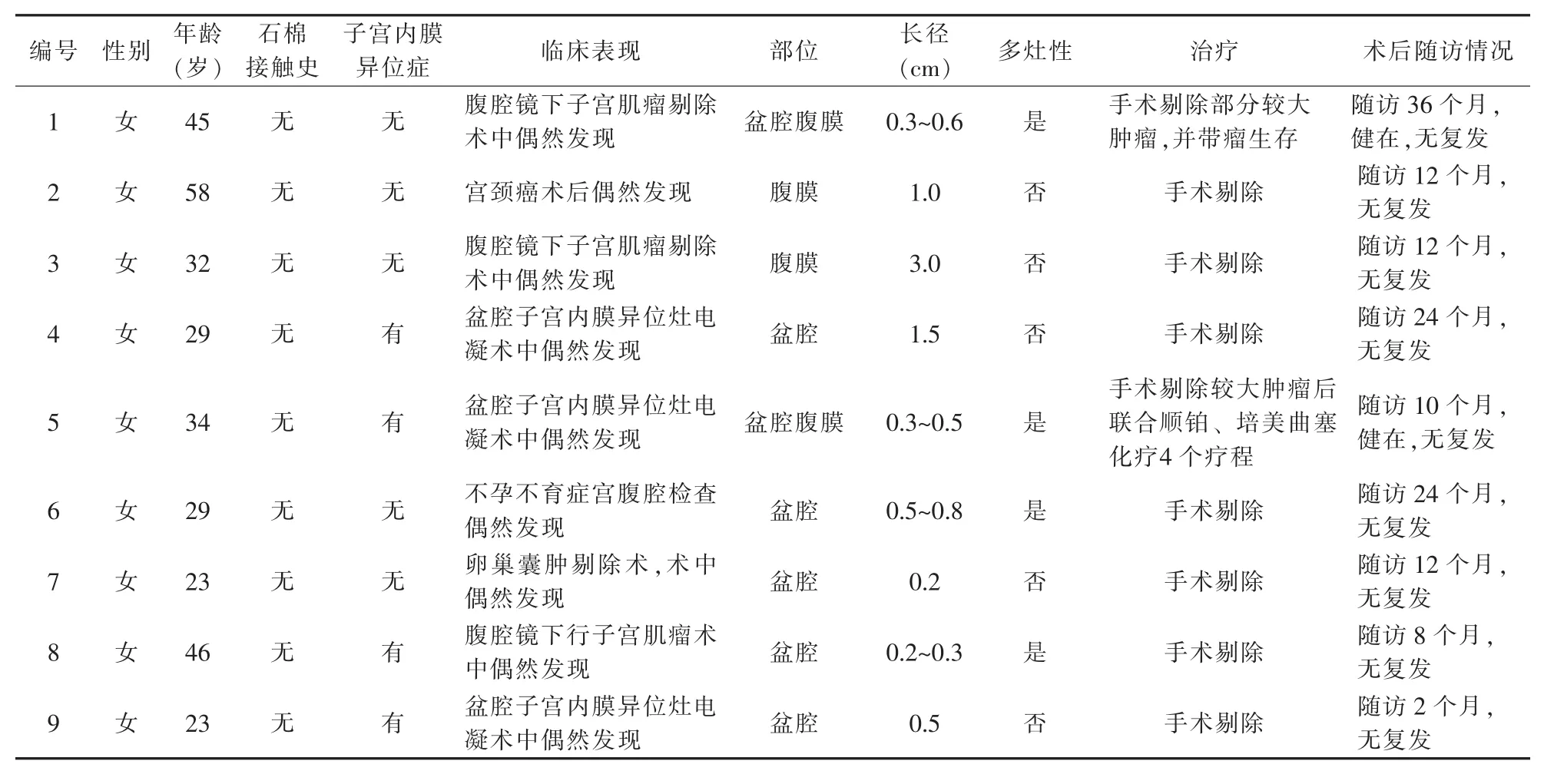
表1 9例高分化乳头状间皮瘤的基本资料
1.2 方法 标本摘除后经3.7%中性福尔马林固定,常规石蜡包埋切片,HE染色,光镜检查。病理切片由高年资医生复片确诊。免疫组化采用EnVision两步法,即用型一抗包括calretinin、CK5/6、CEA、D2-40,均购自福州迈新公司。 PAX8、CA125、P53、Ki-67均购自北京中杉金桥生物科技有限公司,所有标本均行D-PAS染色。免疫组化均设置阴性和阳性对照,以肿瘤细胞胞浆或细胞膜、细胞核内出现棕黄色颗粒为阳性,无着色为阴性。
2 结果
2.1 巨检 肿瘤均为灰黄色软组织,最长径0.3~3.0cm,部分表面呈乳头状结构,切面质地较韧,无出血及坏死。
2.2 镜检 肿瘤由较宽的纤维血管轴心构成乳头状结构(图1A),被覆扁平至单层立方上皮,细胞形态一致且温和,细胞核小且圆,居中,胞质少,未见明显核仁,核分裂罕见,未见坏死。部分区域见管状乳头状结构(图1B),衬覆上皮同乳头状表面上皮一致。
2.3 免疫组化 间皮标志物Calretinin、D2-40和CK 5/6 均为阳性(图 2),CA125、PAX8 阳性表达,CEA、P53为阴性表达,Ki-67指数<5%。
3 讨论

图1 高分化乳头状间皮瘤病理表现。1A:乳头状结构大小不一,乳头中心为纤维血管轴心,乳头表面被覆形态一致的单层扁平至立方状上皮(HE×200);1B:呈管状乳头状结构,衬覆单层扁平至立方状上皮(HE×200)。

图2 高分化乳头状间皮瘤免疫组化结果。2A:乳头表面被覆间皮Calretinin+(EnVison 10×20);2B:CK 5/6+(EnVison 10×20);2C:D2-40+(EnVison 10×20);2D:Ki-67 指数<5%(EnVison 10×20)。
高分化乳头状间皮瘤是一种罕见、低度恶性潜能的间皮肿瘤[4-5],至今全世界文献报道不超过200例,文献报道最多例数56例,多为个例报道。高分化乳头状间皮瘤病因不明,少数病例有石棉接触史[6-7],但未被流行病学所证实。在既往的研究中,石棉暴露诱导了大量内脏间皮细胞的增生,同时有大量炎细胞浸润,可以改变腹膜间皮的基因[8]。本文9例均否认石棉接触史。曾有报道指出,在子宫内膜异位症并发的间皮病变谱系中有几例腹膜高分化乳头状间皮瘤,提出该病可能与子宫内膜异位症相关[9-11]。本文4例有子宫内膜异位症。亦有学者发现,TRAF7或CDC42基因的突变与高分化乳头状间皮瘤发病相关[12]。高分化乳头状间皮瘤可发生于盆腔腹膜、胸膜、网膜、心包膜、睾丸鞘膜及精索,也可见于子宫、卵巢、输卵管、阑尾、直肠表面,但更多发生于盆腔腹膜[13],且主要发生于育龄期女性。本文9例平均年龄28.4岁,与文献报道[4]一致;因病例较多来源于妇产科医院,故男女发病比例无法体现。
3.1 临床特征 高分化乳头状间皮瘤多无特异性临床表现,通常在手术中偶然发现,有些患者可能出现腹痛或腹水。Vogling等[14]报道的56例腹膜高分化乳头状间皮瘤中,最初发现于影像学占16%,腹部/盆腔疼痛占29%,腹水占7%。本文9例均于术中偶然发现,无腹痛及腹水情况。
3.2 诊断 高分化乳头状间皮瘤检查时可发现孤立或多发的乳头状或结节状肿瘤,体积较小,长径常小于2cm,也有报道最大径为4cm和6cm的肿瘤[15]。Malpica等[10]认为应设定WDPM肿瘤大小的安全上限值(<2cm),并且强调多发病灶会出现在50%的病例中,且预后良好,故认为如果仅出现多发病灶并不会增加不良预后的风险。本文9例中5例为单发,长径1.0~3.0cm,4例为多发弥漫性的乳头状病灶,大者长径也只有0.6cm。高分化乳头状间皮瘤大体检查及影像学均无特异性表现,诊断主要依靠组织学,通常镜下表现为:(1)肿瘤的生长方式包括乳头状、管状乳头状、腺瘤样和分支条索样,典型者往往表现为乳头状结构。(2)乳头状结构由纤维性血管轴心构成的,表面被覆单层扁平或立方形间皮细胞。(3)细胞形态温和,罕见核分裂象。(4)免疫组 化 Calretinin、D2-40,C K5/6、CK7、EMA、HBME1阳性, 不同于癌,CEA、B72.3、BerEP4、LeuM1、ER、PR、MOC31阴性,CA125部分表达。本文9例镜下表现及免疫组化与上述描述符合。
3.3 鉴别诊断 高分化乳头状间皮瘤需与以下几种肿瘤相鉴别:(1)恶性间皮瘤。男性远多于女性,常有石棉接触史,病程进展迅速。组织学上有上皮样、肉瘤样、双相型三大类型,其中上皮样最常见,当其组织结构呈乳头状、管状乳头状时容易与高分化乳头状间皮瘤相混淆。上皮性恶性间皮瘤肿瘤细胞轻-中度异型伴不同程度的明显核仁,通常可出现核分裂,但数量不多,出现间质浸润和坏死。而WDPM细胞无异型,核分裂少见,缺少组织浸润,无坏死。两者免疫组化均显示间皮分化的特点,因此,免疫组化特异性欠佳,两者主要依靠形态学鉴别。(2)反应性间皮增生。两者均无明显临床表现,且两者细胞大小一致,形态温和,无核异型,缺乏间质浸润。但反应性间皮增生乳头结构比较少见,结构简单,一般无二级分支乳头,具有纤维或透明变性的轴心并见明显的血管成分,通常伴中-重度炎细胞浸润,而WDPM乳头状结构常见,由较宽的乳头状结构构成,具有纤维血管轴心,缺乏炎症。免疫组化反应性间皮增生不表达EMA,而WDPM通常表达。(3)卵巢浆液性交界性表面乳头状肿瘤(SSPBT)伴卵巢外盆腔腹膜种植。两者均无特异性临床表现,均呈乳头状生长,但SSPBT有乳头状分枝,分枝复杂,上皮细胞层次多,有出芽,细胞中度异型性,常可见砂粒体,而WDPM较前者异型小,且两者组织学来源不同,SSPBT来源于第一苗勒系统,因此免疫组化CA125阳性,间皮标志表达阴性,而WDPM表达间皮标记。(4)原发性腹膜浆液性交界性肿瘤(PPSBT)。两者大多数在手术中偶然发现,病变都可表现为分布在盆腹腔各个脏器表面散在大小不等的粟粒样颗粒或结节。镜下均表现为乳头状结构,无间质浸润,但PPSBT的乳头状结构为高分化,分枝复杂,上皮增生为复层、密集,形成上皮样细胞簇,并易从乳头表面脱落,在囊腔内形成游离细胞簇,细胞有轻-中度异型,常有砂粒体,而WDPM乳头状结构排列粗短,有纤维血管轴心,不形成细胞簇。 免疫组化 PPSBT表达CA125、PAX8、ER、PR标记,不表达间皮标记,而WDPM则表达间皮标记。
3.4 治疗与预后 高分化乳头状间皮瘤生物学行为不明确,目前临床无较规范的治疗指南,最佳治疗方案存在争议[16],部分学者认为,高分化乳头状间皮瘤是一种低度恶性潜能且临床过程惰性的肿瘤,肿瘤切除后如果无症状一般不需要辅助治疗,亦可带瘤生存,定期随诊。有学者认为,如多发性、弥漫性高分化乳头状间皮瘤有症状或肿瘤广泛,可选择顺铂联合培美曲塞化疗[17]。本文1例右侧盆底及盆侧腹膜表面散在20多枚淡黄色乳头状突起,长径0.3~0.5cm,直肠及小肠表面散在数10枚淡黄色乳头状突起,长径0.1~0.2cm,确诊并摘除部分较大肿瘤后予顺铂联合培美曲塞化疗4个疗程,随访10个月健在,一般情况良好。有学者也提出可进行高温灌注化疗[18]。也有学者认为恶性间皮瘤局部可能表现为高分化乳头状瘤的形式,应广泛取材并予排除[19],也有文献报道高分化乳头状间皮瘤数年后可转化为恶性间皮瘤,提出了关于如何以及何时治疗WDPM以根除该病并预防其进展的疑问[20]。本文7例长期随访情况良好,无转移或复发。1例带瘤生存,健在,1例肿瘤范围较广予顺铂联合培美曲塞辅助化疗,密切随访,情况良好。
高分化乳头状间皮瘤是罕见的潜在低度恶性肿瘤,临床及B超无特异性表现,诊断需依靠病理组织学及免疫组织化学。作者认为临床及病理医生应提高对高分化乳头状间皮瘤的认识,并对患者进行密切随访。
