连翘苷调控炎症的抑制作用及机制研究
2020-08-05杨本军武明飞
杨本军,武明飞,徐 涛
急性肺损伤(acute lung injury, ALI)是一种具有高发病率和死亡率的急性炎症性疾病[1]。ALI直接或间接由肺炎、吸入性损伤、溺水等引起,其临床表现包括肺水肿、呼吸困难、低氧血症[2]。虽然针对ALI已经进行了很多研究,但到目前为止,还没有发现有效的治疗药物[3]。越来越多的研究[4]表明,抑制炎性细胞因子的过度分泌被视为治疗ALI的有效策略。
连翘是我国40种常用大宗中药材之一,具有抗氧化、保肝、降血脂等多种活性。连翘苷(phillyrin,PHN) 为连翘的干燥果实的提取物,是由两分子苯丙素侧链相互连接形成两个环氧结构的一类木脂素。其结构上连桥是多种天然产物单体发挥抗氧化,抗菌和抗炎作用中起着重要基团之一[5]。基于这一特点,在本研究中使用细胞和动物模型研究PHN抗炎活性和初步分子机制。
1 材料与方法
1.1 材料PHN购自阿拉丁试剂(上海)有限公司;脂多糖(lipopolysaccharide,LPS)购自美国 Sigma-Aldrich公司;小鼠巨噬细胞RAW264.7作为实验细胞株来自安徽医科大学药学院;PBS缓冲液、培养基(DMEM)和胎牛血清购自美国Thermo Fisher Scientific公司;10% FBS购自以色列Biological Industries公司;一氧化氮(NO)检测试剂盒购自南京建成生物工程研究所;白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)酶联免疫吸附测定法(ELISA) 检测试剂盒购自杭州联科生物有公司;一抗购自美国Cell Signaling Technology公司;、二抗、TBST、RIPA裂解缓冲液购自上海碧云天生物技术有限公司;PVDF膜购自杭州联科美讯生物医药技术有限公司;酶标仪(型号:MQX200,Bio-Tek);分子对接软件Discovery Studio(型号:2017 R2,BIOVIA Software);其余试剂均为国产分析纯。
1.2 方法
1.2.1细胞培养 将RAW264.7细胞在含有10% FBS、100 U/ml青霉素和100 μg/ml链霉素的DMEM中,于37 ℃下,在含有5% CO2的培养条件中培养。
1.2.2炎性细胞因子的测定 将生长状态良好的对数期RAW264.7细胞(细胞密度:6×104个细胞/孔)接种到48孔细胞培养板上,并在培养箱中孵育24 h。弃去培养基,用不同浓度的PHN及阳性对照药物塞来昔布(celecoxib) 预处理细胞1 h,然后在LPS(0.5 μg/ ml)诱导下温育24 h。收集上清液,并使用按照NO试剂盒Griess试剂检测NO含量。按照ELISA试剂盒说明书,进行实验操作测定上清液中TNF-α、IL-6 细胞因子的分泌水平。
1.2.3细胞毒性测定 将生长状态良好的对数期RAW264.7细胞(细胞密度:6×103个细胞/孔)接种到96孔细胞培养板上,培养箱中孵育24 h。弃去培养基,用不同浓度的PHN及阳性对照药物塞来昔布(10、20、30 μmol/L)预处理细胞1 h,然后与LPS(0.5 μg/ml)一起在培养箱中温育24 h。通过MTT方法测试细活力,具体的方法:弃去培养基,向每个孔中加入MTT溶液(在PBS中5 mg/ml)并在37 ℃下孵育4 h。除去含MTT的培养基,然后加入150 μl二甲基亚砜(DMSO)溶液,置于摇床上振荡30 min。通过酶标仪在492 nm处检测吸光度,并计算细胞增殖率。
1.2.4Western blot检测 将生长状态良好的对数期RAW264.7细胞(细胞密度:3×105个细胞/孔)接种到6孔细胞培养板上,然后培养24 h。弃去培养基,用不同浓度的PHN(1.25、2.5、5、10 μmol/L)预处理细胞12 h,然后与LPS(0.5 μg/ml)一起在培养箱中温育1 h后提取细胞总蛋白。用含有PMSF和磷酸酶抑制剂的RIPA裂解缓冲液裂解细胞,然后在冰上孵育30 min。通过12% SDS-PAGE分离蛋白质裂解物,随后转移到PVDF膜上。将封闭的膜与指定的一抗(以抗体 ∶5% BSA溶液1 ∶1 000稀释)在4 ℃温育过夜。用TBST洗涤3次后,将膜与HRP偶联的二抗在室温下孵育1 h,以GAPDH作为内参。显影并计算光密度值。
1.2.5分子对接 采用分子对接研究PHN与TLR4之间的潜在相互作用,使用Discovery Studio,软件进行模拟测试。TLR4蛋白(PDB代码:2Z64)的X射线晶体结构获自RCSB蛋白质数据库。将TLR4蛋白晶体结构导入DS软件中,对蛋白结构进行去水、加氢处理,然后利用该软件中的准备蛋白工具对蛋白进行处理。PHN结构进行能量最小化处理。使用CDOCKER模块进行分子对接研究。
1.2.6体内实验 50只雄性C57BL/6小鼠(体重18~25 g)购自安徽医科大学实验动物中心。将C57BL/6小鼠随机分为5组(n=10),分别对照组(生理盐水)、模型组、PHN低剂量组、PHN中剂量组、PHN高剂量组。对照组小鼠正常饲养,除了对照组外,其余组通过尾静脉注射20 mg/kg LPS。在注射LPS之前0.5 h,PHN低剂量组和PHN高剂量组通过腹膜内注射分别给予浓度为10 mg/kg和20 mg/kg的PHN。在LPS注射后48 h对小鼠进行麻醉并处死。收集肺组织并将其固定在4%多聚甲醛溶液中,然后包埋在石蜡中。脱水后用苏木精和伊红(HE)染色切片并进行免疫组织化学染色。该研究经安徽医科大学伦理委员会批准。
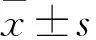
2 结果
2.1 PHN抑制LPS诱导的NO释放用LPS处理RAW 264.7细胞导致炎症因子的分泌,包括NO、IL-6和TNF-α。与空白对照组相比,LPS模型组细胞上清液的NO含量明显增加。PHN作用的细胞上清液中NO含量明显低于LPS模型组。其中,当浓度为10 μmol/L时,PHN对NO释放的抑制率为63.34%;当浓度为20 μmol/L时,抑制率为45.49%(P<0.05)(图1)。
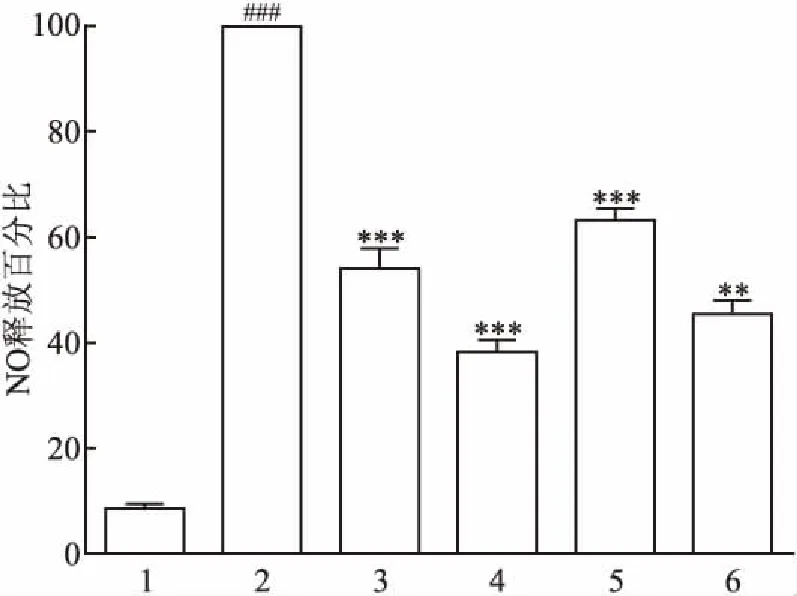
图1 PHN对LPS诱导的RAW264.7细胞中NO释放的抑制率
2.2 细胞毒性评估为了避免对NO释放的抑制作用与细胞活力相关,采用MTT测定法检测不同浓度PHN及塞来昔布对细胞活力的影响。如图2,PHN和阳性药物在不同浓度范围内(10、20、30 μmol/L)对细胞增殖无明显抑制作用,细胞存活率均大于95%,不同剂量的PHN组间差异无统计学意义。结果表明PHN的抗炎活性不是由细胞毒作用介导的。因此,PHN的抗炎作用机制值得进一步探索。
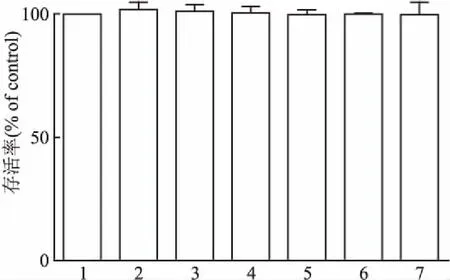
图2 PHN对RAW264.7细胞活力的影响
2.3 PHN抑制LPS诱导的细胞因子分泌用PHN进一步评估LPS诱导的TNF-α和IL-6分泌量的影响作用。当予以0.625、1.25、2.5、5和10μmol/L PHN时,IL-6浓度分别降低到(840.66±8.09)、(781.67±13.59)、(644±13.45)、(516.66±44.09)和(452.66±23.56) pg/ml(图3A),TNF-α浓度分别降低到(2 255.67±67.36)、(2 037.66±42.31)、(1 691.66±13.19)、(1 493.66±39.57)和(1 294.33±84.68) pg/ml(图3B)。该结果表明PHN以浓度依赖性方式降低IL-6和TNF-α分泌。

图3 PHN对RAW264.7细胞中LPS诱导的细胞因子分泌量的变化
2.4 PHN抑制LPS诱导的TLR4表达课题组研究了TLR4的表达是否受到PHN的调控。如图4所示,LPS(0.5 mg/mL)刺激的RAW264.7细胞可显着增强TLR4的表达。PHN通过以浓度依赖性方式,抑制了TLR4的表达水平。该结果再次证明PHN可以抑制LPS诱导的RAW264.7细胞中的炎性反应。
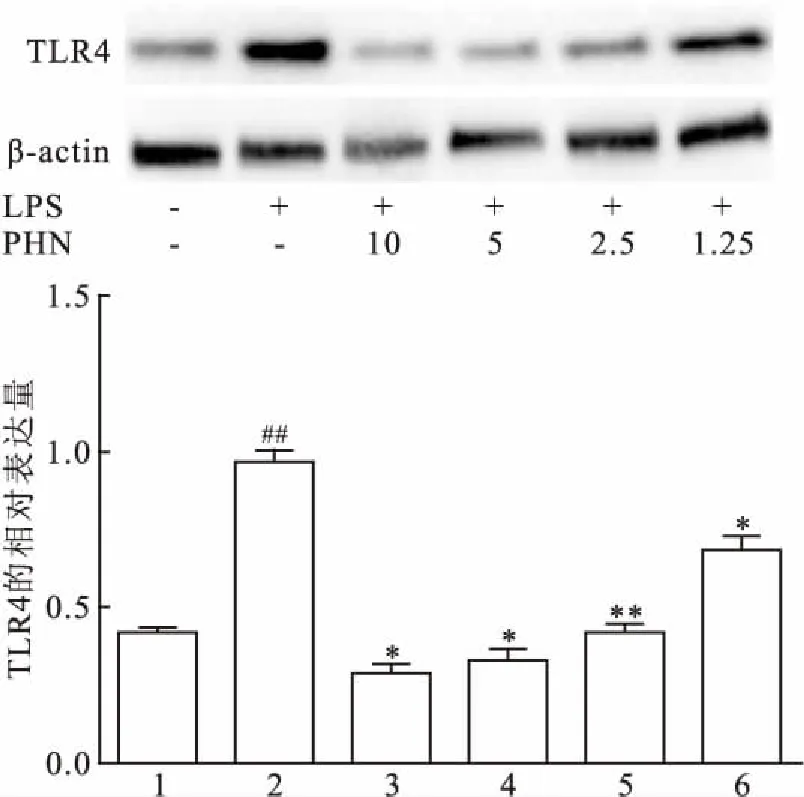
图4 PHN对LPS诱导RAW264.7细胞TLR4蛋白表达水平的影响
2.5 PHN结合TLR4的对接分析为了阐明PHN可以抑制炎性细胞因子分泌的机制,通过分子对接来研究PHN与TLR4(PDB代码:2Z64)之间的结合模式。对接结果显示,PHN与TLR4之间的结合能量最高打分为440.571 kJ/mol 如图5所示,PHN通过与TLR4上的THR614和ASP619形成2个常规氢键,与GLU611、SER623、CYS580、ASP619和ASN622形成7个碳氢键,以及多个范德华力等。以上结果表明,PHN与TLR4的活性位点稳定结合,两者之间具有较好的亲和力。

图5 PHN插入TLR4活性位点的结合模式图
2.6 PHN对LPS诱导的ALI小鼠的保护作用通过肺组织切片病理形态学变化评估PHN对LPS诱导的ALI小鼠模型的保护作用。如图6所示,在正常小鼠中,肺泡结构清晰、完整,肺泡腔内无分泌物和炎性细胞浸润。LPS刺激导致显著的炎症改变,用PHN预处理LPS诱导的肺损伤炎症小鼠,则明显地改善了肺组织病变,肺泡腔炎性细胞减少,肺小叶的组织结构完整,并且低剂量组的改善作用优于高剂量组。结果表明,PHN对LPS诱导ALI小鼠模型的组织病理损伤具有保护作用。
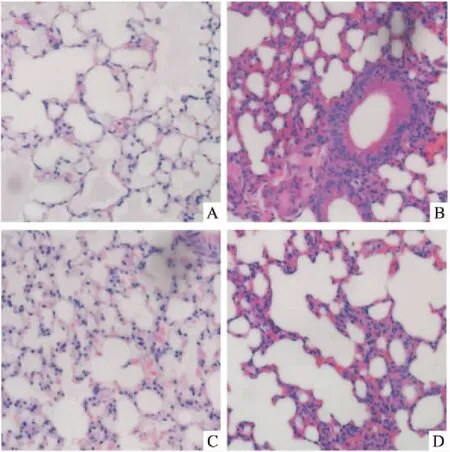
图6 PHN改善LPS诱导的急性肺损伤模型的病理变化HE染色×100
3 讨论
当受到外界刺激时,机体做出的适应性反应,如急性炎症,是人体极为重要的病理过程。受到外界刺激后,炎性细胞主力军之一的巨噬细胞会产生大量炎性因子促进炎症反应和组织损伤[6]。促炎细胞因子在疾病的防御中发挥重要作用。然而,不受控制和过量释放促炎介质,如NO、IL-6、TNF-α、IL-1β等,可导致多种类型的炎症性疾病,如ALI[7]。ALI是由于过度炎症引起的严重疾病,表现为急性呼吸窘迫、非心源性肺水肿和低氧血症[8]。已经证实NO、TNF-α、IL-6等,通过一系列细胞信号通路调节ALI的发病进程[9]。
LPS是革兰阴性细菌主要的致病因子之一,可以引起人及动物多种急、慢性炎症反应,从而导致组织器官的损伤。据报道,液体咽后壁吸入LPS所造成的肺部炎症比较均一稳定,并且可以进行定量研究[10-11]。其机制可能是LPS通过激活其主要受体TLR4起作用,触发先天免疫系统,随后激活MAPK以诱导释放促炎细胞因子。在用LPS刺激后,TLR4启动一系列信号级联,导致MAPK的活化,从而诱导促炎性细胞因子如NO、TNF-α和IL-6的分泌[12]。
本研究采用LPS诱导巨噬细胞RAW264.7损伤模型,考察PHN对ALI的病程发展中起关键作用的各种炎性细胞因子,如NO、IL-6和TNF-α的变化影响。初步结果表明,与空白对照组比较,0.5 μg/ ml LPS能显著提高NO、IL-6和TNF-α的分泌量(P<0.01),说明细胞炎症的模型成功建立;与模型组比较,PHN以剂量依赖性方式抑制NO、IL-6和TNF-α的分泌(P<0.05或P<0.01)。并且在30 μmol/L以下浓度范围,PHN对细胞增殖无明显抑制作用。初步机制探讨,PHN以浓度依赖性方式通过抑制TLR4信号传导途径调节ALI的发病机制(P<0.05或P<0.01)。根据分子对接结果分析,PHN通过与TLR4上重要氨基酸残基THR614、ASP619、GLU611等形成了9个牢固氢键,结合能量最高打分为440.571 kJ/mol。提示PHN与TLR4蛋白之间具有较强的亲和力。通过肺组织病理检查,LPS的吸入可导致小鼠出现严重的肺损伤,包括肺水肿、炎性细胞浸润和肺泡结构的破坏,说明小鼠急性肺炎模型的建立是成功的。在接受PHN治疗后,小鼠的肺水肿开始趋于缓和,肺泡腔炎性细胞数量也较未接受治疗的模型组有显著降低,肺小叶的组织结构完整,充血现象也有所减轻。本研究表明PHN在小鼠ALI模型中有效地减少了LPS诱导的肺部炎症和急性肺损伤。
综上所述,PHN可以有效地抑制LPS诱导的肺部感染引发的炎症反应的发展进程,对急性炎症导致的肺损伤有较显著的保护作用,其机制可能是影响 TLR4信号通路,抑制RAW264.7细胞的相关炎性因子的分泌有关。因此,PHN在临床ALI的治疗中具有潜在的研究价值。
