hMSCs来源的外泌体对单核细胞增殖和分泌炎性因子的影响
2020-08-05孔祥伟刘向辉程义成
孔祥伟,刘向辉,程义成
外泌体是一类直径40~150 nm 的膜性脂质小囊泡,内含功能性蛋白质、mRNA、microRNA等物质,在细胞间的信息传递过程中发挥重要作用[1]。1983年Harding et al[2]在大鼠的网织红细胞中发现了一种由细胞分泌的小囊泡,1987年Johnstone et al[3]也在网织红细胞中发现了这种双层膜小囊泡并正式命名为外泌体。外泌体具有比细胞因子更强、更广泛的信号分子转运和调控能力。目前已经从多种细胞的培养基中分离得到了外泌体,如巨噬细胞、T细胞、间充质干细胞(mesenchymal stem cells, MSCs)、上皮细胞、脂肪细胞等。间充质干细胞较其他种类细胞能够分泌更多的外泌体[4]。研究[5]表明人间充质干细胞(human mesenchymal stem cells, hMSCs)来源的外泌体能够模拟MSCs的生物学功能,这提示外泌体可能是MSCs发挥生物学功能的重要方式。该研究从人骨髓间充质干细胞中提取外泌体,观察其对单核细胞增殖和分泌炎性因子的影响。
1 材料与方法
1.1 主要试剂和仪器
1.1.1主要试剂 α-MEM 培养基、青霉素、链霉素、胎牛血清、PBS(美国Gibco公司);谷氨酰胺、TRIzol Reagent(美国Invitrogen公司);I型胶原酶、胰蛋白酶、LPS、MTT(美国Sigma公司);酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)试剂盒(美国R&D Systems公司);人单核细胞分离液(天津灏洋生物制品科技有限公司);二甲基亚砜(DMSO)(西安化学试剂厂);Bradford蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);ECL发光试剂盒(美国Pierce公司)。
1.1.2主要仪器 酶联免疫检测仪(型号:ELX800,美国BioTek公司);倒置相差显微镜(型号:TS100,日本尼康株式会社);扫描电镜(型号:S-4800,日本日立公司)。
1.2 实验方法
1.2.1hMSCs的分离和培养 选取5例骨折需手术的患者,术前排除骨质疏松症和其他系统性疾病,术中用注射器抽取骨髓5 ml,并置于抗凝管中。将抽取的骨髓与等量的无血清α-MEM培养液混合均匀,4 ℃、400 r/min离心10 min;吸弃上清液,用培养液重悬细胞,并将其缓慢加入置有等体积Percoll分离液的离心管内,使稀释血液位于上层,Percoll分离液位于下层,注意保持液体分界面完整;4 ℃、400 r/min离心30 min,吸取中间的细胞层,PBS洗涤2次,用含胎牛血清的α-MEM培养液重悬细胞;调整细胞密度为1×106/L,接种于培养瓶中。待细胞生长至80%~90%融合时,用胰蛋白酶消化、传代。本实验经东部战区总医院伦理委员会批准,所有研究个体均征得患者知情同意。
1.2.2hMSCs来源的外泌体的提取和鉴定 取1 ml培养液以2 000 r/min离心30 min,吸取上清液,以2 ∶1比例加入外泌体提取试剂充分混匀,4 ℃ 过夜,10 000 r/min离心l h,吸弃上清液,用100 μl PBS重悬,即为外泌体。将20 μl 外泌体混匀后滴于铜网表面,室温静置1 min,滤纸吸干;磷钨酸室温复染5 min,滤纸吸干复染液,置于透射电子显微镜下观察外泌体的大小和形态并照相。Western blot检测CD63、CD81的表达。
1.2.3Ficoll-hypaque密度梯度离心法分离外周血单核细胞 取肝素抗凝全血与Hank′s液按1 ∶1比例混匀,轻轻加于2两倍的Ficoll-hypaque分离液表面,以1 500 r/min离心20 min。离心后由上至下细胞分为4层,收集第2层白膜层细胞,放入含细胞洗涤液的试管中,充分混匀,1 500 r/min离心10 min,沉淀反复洗涤2次,即为单核细胞。用RPMI-1640培养液悬浮细胞,置于玻璃培养皿中,37 ℃孵育2 h,收集贴壁的单核细胞,调整细胞浓度至1×105/L备用。
1.2.4MTT检测hMSCs来源的外泌体对单核细胞增殖的影响 将100 μl单核细胞悬液加入96孔板中,然后加入终浓度20 mg/L 的LPS用以刺激单核细胞增殖。将hMSCs来源的外泌体分别按照1、10、50、100 mg/L的终浓度加入孔中设为实验组,未加入外泌体的孔设为对照组,另以100 μl PBS作为空白对照。每组均设3个复孔进行实验。在第一天的孔中加入20 μl MTT液,37 ℃孵育4 h,PBS洗涤后加入150 μl DMSO,避光震荡10 min后在酶联免疫检测仪490 nm波长下检测吸光光度值。连续测量7 d。
1.2.5流式细胞仪检测外泌体对单核细胞凋亡的影响 将100 mg/L 外泌体与单核细胞共培养3 d,将消化下来的细胞用PBS洗涤离心后,用2.5 ml带血清培养基重悬细胞,流式上机检测外泌体对单核细胞凋亡的影响。
1.2.6ELISA检测单核细胞炎性因子的表达 将hMSCs来源的外泌体按照100 mg/L 的浓度加入含10%胎牛血清(去除外泌体)的α-MEM培养液设为实验组,未加入外泌体的常规培养基设为对照组。在培养的单核细胞中加入终浓度20 mg/L LPS刺激炎性因子的分泌,24 h后收集细胞培养液。待测样品中每孔各加入待测样品100 μl,37 ℃孵育120 min。用洗涤液将反应板充分洗涤5次,向滤纸上印干。加入肿瘤坏死因子-α( tumor necrosis factor-α,TNF-α )、白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)及白介素-8(interleukin-8,IL-8)第一抗体工作液50 μl,混匀后37 ℃ 孵育60 min,洗板;加入酶标抗体工作液100 μl,37 ℃孵育60 min,洗板;加入底物液100 μl,37 ℃避光反应10 min;加入50 μl终止液,混匀;在450 nm处检测吸光值。
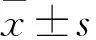
2 结果
2.1 hMSCs来源的外泌体的鉴定将提取到的外泌体溶于PBS,透射电镜下观察,外泌体为直径介于40~150 nm之间、呈圆形或椭圆形的膜性小囊泡,囊泡外周可见其膜性结构,中央为低电子密度成分(图1A、1B)。Western blot结果显示沉淀物CD63和CD81表达阳性,而对照组无CD63和CD81的表达(图1C)。

图1 外泌体的鉴定
2.2 外泌体对单核细胞增殖的影响在LPS的刺激下,单核细胞增殖增加,生长曲线呈典型的“S”型;而加入外泌体后单核细胞的增殖受到抑制。终浓度为1 mg/L 的外泌体对单核细胞增殖的抑制作用不明显;终浓度为10、50和100 mg/L的外泌体均能抑制单核细胞的增殖,随着浓度的增加,抑制作用明显,显示剂量依赖性,差异有统计学意义。见图2。

图2 MTT检测梯度浓度外泌体对单核细胞增殖的影响
2.3 外泌体对单核细胞凋亡的影响hMSCs来源的外泌体具有促进单核细胞凋亡的作用,实验组(图3A)的早期凋亡率(B4:13.8%)、晚期凋亡率(B2:9.5%)以及总凋亡率(B2+B4:23.3%)均高于对照组(图3B)。
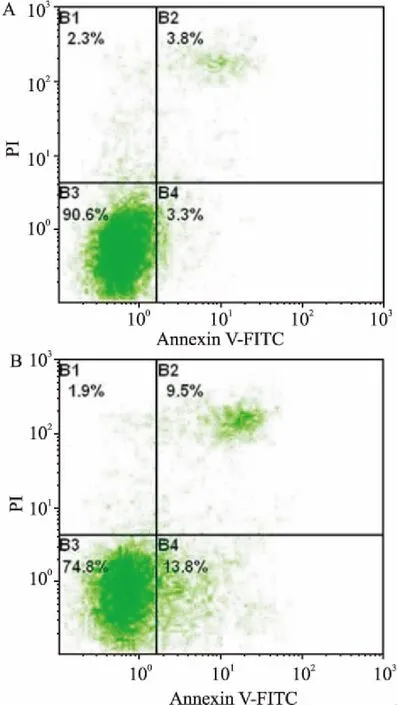
图3 流式细胞仪检测外泌体对单核细胞凋亡的影响
2.4 外泌体对单核细胞分泌炎性因子的影响在LPS的刺激下,单核细胞会分泌炎性因子,其中TNF-α(89.89±9.59)mg/L、IL-1β(67.62±7.00)mg/L、IL-6(442.70±28.38)mg/L、IL-8(54.38±7.19)mg/L;而加入终浓度为100 mg/L 外泌体后TNF-α(26.65±5.44) mg/L(F=118.40,P<0.05)、IL-1β(35.53±4.71) mg/L(F=51.67,P<0.05)、IL-6(185.25±10.10) mg/L;(F=403.31,P<0.05)、 IL-8(45.36±5.67) mg/L(F=68.06,P<0.05)。结果显示hMSCs来源的外泌体可以降低外周血单核细胞分泌炎性因子。见图4。
图4 ELISA检测外泌体对单核细胞分泌炎性因子的影响
3 讨论
早期的研究认为,外源性MSCs是通过归巢、分化,从而修复损伤组织。但在实验中观察到,移植的MSCs大部分都停留在肝、脾、肺,到达损伤部位的MSCs不足1 %,而参与再生的细胞主要来源于模型中的固有细胞[6]。MSCs 的条件培养基同样具有MSCs 的再生修复能力[5]。由此推测,外源性MSCs的组织再生作用可能不是因其分化能力,而是通过旁分泌的方式来实现的。随后这些起修复作用的因子被证实为MSCs分泌的外泌体[7]。外泌体是一类直径30~150 nm、密度为1.13~1.19 g/ml的膜性脂质小囊泡,其内含有功能性蛋白质、mRNA及microRNA等物质,可通过多种信号通路,影响细胞的生物学行为,参与组织的再生修复[8]。多种细胞均可以分泌外泌体,其中MSCs 是分泌外泌体能力最强的细胞之一[9]。
现已明确,hMSCs具有免疫调节的功能,可抑制T淋巴细胞、B淋巴细胞、NK-T细胞等的增殖,这种免疫调节能力可通过细胞直接接触或旁分泌免疫调节因子,如TGF-β1、PGE2、IL-10等来实现。近年来的研究发现MSCs通过分泌外泌体参与多种细胞间的信息交流,可以保护急性肾小管损伤、促进神经再生、减少心肌损伤的范围[10-11]等,这可能是MSCs发挥治疗功能的重要机制之一。因此,本实验初步探索hMSCs来源的外泌体是否具有免疫调节功能。
本实验采用外泌体试剂盒成功提取了MSCs来源的外泌体,进行了形态学的观察,透射电镜观察下,hMSCs来源的外泌体为圆形或椭圆形的膜性小囊泡,大小不一,直径在40~100 nm,腔内呈现低密度;Western blot结果显示hMSCs来源的外泌体 CD63和CD81表达阳性,与其来源细胞表达一致。本实验采用MTT法检测,在hMSCs来源的外泌体与经LPS刺激的单核细胞共培养体系中,外泌体对单核细胞增殖的影响,实验结果证实hMSCs来源的外泌体能抑制单核细胞的增殖;同时,流式细胞仪检测结果表明,hMSCs来源的外泌体能促进单核细胞的凋亡。Taganov et al[12]用LPS刺激人单核细胞,运用miRNA基因芯片技术,发现miR-146a、miR-155和miR-132的表达增高。熊旭明 等[13]采用LPS诱导人单核细胞株THP-1,模拟免疫细胞炎症反应过程,并通过细胞转染的方法上调或下调细胞内miR-29a的表达水平,结果显示miR-29a能通过靶向作用于两个抗凋亡基因Bcl-2和Mcl-1调控THP-1细胞凋亡水平。Pauley et al[14]通过转染上调人单核细胞株THP-1细胞中的miR-146a,可以促进由LPS诱导的细胞凋亡。这些都提示外泌体可能通过miRNA调控单核细胞的凋亡过程。
为了进一步探明hMSCs来源的外泌体对单核细胞免疫调节功能的影响,本实验采用ELISA法检测外泌体与单核细胞共培养3 d后上清液中细胞因子的表达水平,结果显示hMSCs来源的外泌体能够抑制LPS刺激下单核细胞产生TNF-α、IL-1β、IL-6和IL-8,提示hMSCs来源的外泌体有望在炎症、自身免疫性疾病治疗中发挥治疗作用。但其免疫调节作用的具体机制还有待进一步研究。
