miR-155对IL-1β诱导髓核细胞凋亡、炎症和氧化应激的影响
2020-08-05杨利斌王善坤赵恩典梁秋冬
杨利斌,杨 林,王善坤,赵恩典,路 坦,梁秋冬
椎间盘易受损伤而发生形态学改变,因此造成疼痛性症状和神经功能损伤给患者家庭和社会造成了沉重的压力[1-2]。目前,椎间盘退变(intervertebral disc degeneration,IDD)的治疗方法包括保守治疗、椎间盘切除和脊柱融合等,但这些方法疗效有限,不能产生可预测和可靠的结果[3-4]。研究[2,5]表明,炎症微环境和新神经支配产生是椎间盘性疼痛的来源,其中白介素1β(interleukin-1β, IL-1β)可影响椎间盘细胞衰老、自噬和与增殖、再生有关的基因表达。微小RNA(microRNAs, miRNAs)对编码基因表达有负性调控作用,参与炎症性疾病的调控[6]。研究[7]表明,miR-155在髓核细胞变性过程中表达下调。但miR-155对大鼠椎间盘细胞凋亡、炎症反应和氧化应激的影响尚不清楚。基于此,该文探究miR-155对IL-1β诱导的大鼠髓核细胞凋亡、炎症和氧化应激的作用及其机制。
1 材料与方法
1.1 材料
1.1.1实验动物 清洁级SD大鼠10只,雌雄不限,180~220 g,购自北京维通利华实验动物公司[SCXK(京)2015-0001]。饲养于新乡医学院实验室,适应性喂养1周,温度(25±2)℃,湿度(40±5)%,光照10~12 h,自由采食和饮水。试验均经过本院动物伦理委员会批准,并按照实验动物使用的3R原则给予人道关怀。
1.1.2主要试剂 Ⅱ型胶原酶(C6885)、0.25%胰蛋白酶(T6424)和IL-1β(SRP3083)购自美国Sigma公司;TUNEL细胞凋亡检测试剂盒(T2190)、软骨染色液(甲苯胺蓝法)(G2543)、软骨染色液(番红O法)(G2540)、总RNA提取试剂盒(R1200)、定量PCR试剂盒(T2210)购自索莱宝公司;DMEM/F12培养液(11320082)、青链霉素溶液(15070063)、胎牛血清(12483020)购自美国Gibco公司;miR-155 mimic、miR-155 inhibitor和阴性质粒购自美国Hyclone公司;兔源Caspase-3(ab4051)、Caspase-9(ab32539)、p-p65(ab76302)、p65(ab32536)、TNF-α(ab221921)和GAPDH(ab181602)单克隆抗体购自Abcam公司;引物使用Primer5.0软件设计,由南京金斯瑞生物科技有限公司合成。
1.2 方法
1.2.1大鼠髓核细胞培养[8]CO2麻醉法处死大鼠,75%酒精体表浸泡消毒;分离胸腰段脊柱,充分暴露椎间盘,髓核组织;磷酸盐缓冲液(PBS)液漂洗,切成约1 mm3组织块,移入灭菌离心管,加0.1% Ⅱ型胶原酶,37 ℃振荡消化30 min;1 000 r/min×5 min,弃上清液;PBS液漂洗;加0.1% Ⅱ型胶原酶重悬,37 ℃、5% CO2条件下孵育4 h;将细胞悬液用70 μm孔径细胞筛网过滤,用DMEM/F 12离心洗涤;转入25 cm2细胞培养瓶,加含10%胎牛血清DMEM培养液,37 ℃、5% CO2恒温培养箱中培养。观察生长情况,一般4~5 d换液,去除未贴壁组织块,以后每3 d换液1次,当细胞融合率达到85%时可进行传代。取第2代细胞用于鉴定,第3代细胞进行后续实验研究。
1.2.2髓核细胞鉴定 采用番红O和甲苯胺蓝染色进行:将第2代细胞接种于24孔板,待细胞贴壁后PBS充分洗涤;加4%多聚甲醛固定细胞30 min,PBS充分洗涤;用1%甲苯胺蓝染色10 min或0.5%番红O染液滴染1 min,双蒸水洗涤1 min。镜下观察细胞染色情况及形态特征。
1.2.3细胞转染 以1×105个/ml密度将第3代髓核细胞接种于6孔培养板中,待细胞贴壁后,分为4组:对照组、模型组、IL-1β+miR-155 mimic组和IL-1β+miR-155 inhibitor组。融合率达80%时,采用Lipofectamine 2000转染。对照组和模型组转染miR-155阴性质粒。24 h后,换无血清培养基继续培养12 h;再加入终浓度10 ng/ml的IL-1β处理,24 h后进行后续实验。
1.2.4qRT-PCR检测miR-155表达 以1×105个/ml密度将第3代髓核细胞接种于6孔培养板中,融合率达80%时,① 分为Control组(对照组)和IL-1β组(模型组),前者不作处理,后者加入终浓度10 ng/ml的IL-1β;② 分为对照组和miR-155 mimic组,前者转染miR-155阴性质粒,后者转染miR-155 mimic;③ 分为对照组和miR-155 inhibitor组,转染miR-155阴性质粒,后者转染miR-155 inhibitor。
24 h后收集各组细胞,提取总RNA并反转录成cDNA,之后进行qRT-PCR。引物:miR-155上游:5′-AAC TTG TAA ACT CCC TCG ACT G-3′,下游:5′-CCT TAC GTG ACC TGG AGT CG-3′;GAPDH上游:5′-CGC TCT CTG CTC CTC CTG TTC-3′,下游:5′-ATC CGT TGA CTC CGA CCT TCA C-3′。按照2-ΔΔCT法计算miR-155表达量。
1.2.5流式细胞术检测细胞凋亡 按1.2.3项处理,收集各组细胞调整为1×106个/ml,每个样本加入5 μl的膜联蛋白V-荧光素异硫氰酸盐(annexin V-fluorescein isothiocyanate, Annexin V-FITC)和5 μl碘化丙叮(propyl iodide, PI)染色液,室温避光孵育15 min后上机检测。
1.2.6ELISA检测髓核细胞炎症因子白介素6(interleukin-6, IL-6)、诱导性一氧化氮(inducible nitric oxide,iNOS)和白介素10(interleukin-10, IL-10)的表达 按1.2.3项处理后,按照说明书操作,检测各组髓核细胞内炎症因子IL-6、iNOS和IL-10的表达水平。
1.2.7试剂盒检测髓核细胞氧化应激因子乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、 丙二醛(malondialdehyde,MDA)和谷胱甘肽(glutathione,GSH)的含量 按1.2.3项处理后,按照说明书操作,检测各组髓核细胞内氧化应激因子LDH、SOD、 MDA和GSH含量。
1.2.8蛋白印迹检测相关蛋白表达水平 按1.2.3项处理后,收集各组细胞提取总蛋白,用二喹啉甲酸(bicinchoninic acid,BCA)法检测蛋白浓度并调平,取30 μg蛋白用12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)分离蛋白并转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,室温封闭2 h,以1 ∶800稀释度加入半胱氨酸天冬氨酸蛋白酶-3(cysteine aspartic protease 3, Caspase-3)、Caspase-9、核转录因子kappa B P65(nuclear transcription factor kappa B P65, NF-κB p65)、p-p65和TNF-α抗体,4 ℃孵育过夜。次日弃一抗,加入二抗室温封闭1 h,滴发光液于暗室曝光显影。以GAPDH为内参计算蛋白相对表达量。
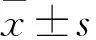
2 结果
2.1 原代培养大鼠髓核细胞的鉴定采用番红和甲苯胺蓝染色鉴定第二代髓核细胞,重复3次实验的结果如图1显示:番红染色后髓核细胞胞质和核呈棕黄色,甲苯胺蓝染色胞质和核呈蓝色;且两种染色细胞均呈多边形的“铺路石”样,符合髓核细胞(特殊的软骨细胞)形态特点。
2.2 miR-155表达水平比较qRT-PCR检测miR-155表达水平,结果如图2显示:与对照组相比,模型组miR-155表达水平降低(P<0.01);miR-155 mimic组miR-155的表达增加(P<0.01);miR-155 inhibitor组miR-155的表达降低(F=20.15,P<0.01)。
2.3 miR-155抑制IL-1β诱导的髓核细胞凋亡流式细胞术检测各组细胞凋亡率,结果如图3显示:与对照组相比,模型组细胞凋亡率增加(F=19.56,P<0.01);与模型组相比,miR-155 mimic降低IL-1β诱导的细胞凋亡率(F=15.24,P<0.01),而miR-155 inhibitor增加细胞凋亡率(F=12.28,P<0.01)。蛋白印迹进一步检测凋亡相关蛋白表达水平,结果如图3显示:与对照组相比,模型组髓核细胞中Caspase-3、Caspase-9蛋白表达水平增加(F=19.22,F=23.45,P<0.01);与模型组相比,IL-1β+miR-155 mimic组Caspase-3、Caspase-9蛋白表达水平降低(F=13.14,F=18.52,P<0.01),而IL-1β+miR-155 inhibitor组Caspase-3、Caspase-9蛋白表达水平则上调(F=25.24,F=16.59,P<0.01)。

图1 番红和甲苯胺蓝染色鉴定大鼠髓核细胞 ×400
2.4 miR-155抑制IL-1β诱导的髓核细胞炎症反应ELISA检测各组髓核细胞中炎症细胞因子的表达水平,结果显示:与对照组相比,模型组髓核细胞中IL-6、iNOS表达增加,IL-10表达降低(F=23.54、F=14.55、12.53,P<0.01);与模型组相比,IL-1β+miR-155 mimic组IL-6、iNOS表达降低,IL-10增加(F=10.88、8.69、12.41,P<0.01),而miR-155 inhibitor组IL-6、iNOS表达增加,IL-10降低(F=11.26、8.61、8.27,P<0.01)。见图4。
2.5 miR-155抑制IL-1β诱导的髓核细胞氧化应激ELISA检测各组髓核细胞中氧化应激因子的含量,结果显示:与对照组相比,模型组髓核细胞中SOD、GSH含量降低,MDA、LDH含量升高(F=32.56、29.62、25.46、23.47,P<0.01);miR-155 mimic部分逆转了IL-1β对上述氧化应激分子的调节作用(F=15.47、19.25、12.36、16.48,P<0.01),miR-155 inhibitor则加剧了IL-1β的调节作用(F=12.19、8.69、13.44、8.79,P<0.01)。见图5。
2.6 miR-155抑制IL-1β诱导的髓核细胞NF-κB p65磷酸化、TNF-α表达和P65入核蛋白印迹实验检测各组髓核细胞NF-κB p65磷酸化情况,及下游TNF-α表达水平,结果显示:与对照组相比,模型组p-p65/p65和TNF-α相对表达量增加(F=10.28、21.49,P<0.01;与模型组相比,IL-1β+miR-155 mimic组p-p65/p65和TNF-α表达水平降低(F=8.92、12.56,P<0.01),而miR-155 inhibitor组p-p65/p65和TNF-α表达水平则增加(F=33.59、26.74,P<0.01)。见图6。
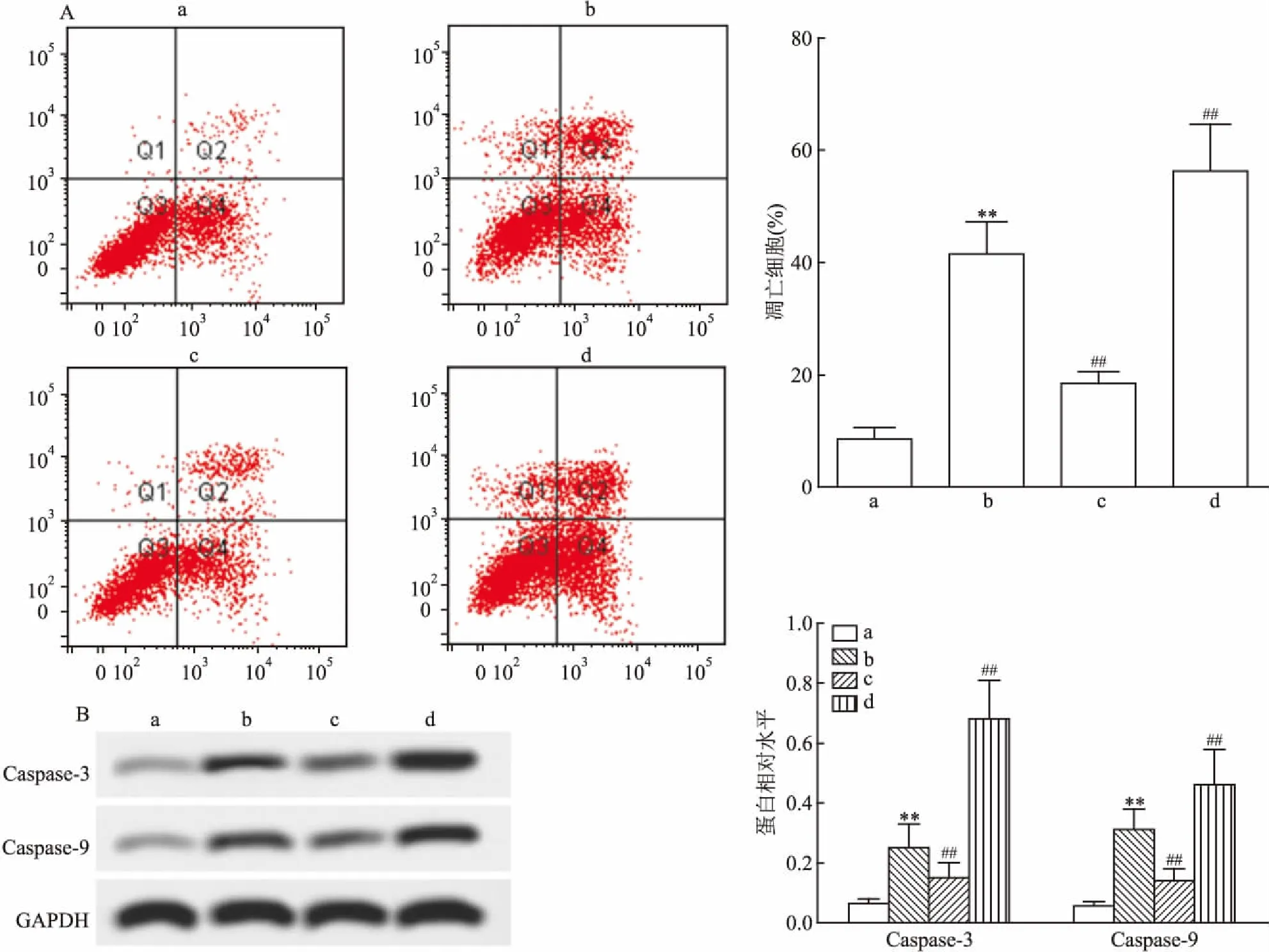
图3 miR-155对IL-1β诱导的髓核细胞凋亡和凋亡相关蛋白表达的影响

图4 miR-155对髓核细胞炎症细胞因子含量的影响
3 讨论
炎症细胞因子IL-1β是IL-1家族中最重要的成员,参与调节机体免疫应答和炎症反应过程,加速多种炎症性疾病的进程[9]。Kang et al[10]研究发现,IL-1β刺激髓核细胞后,细胞外基质降解增加,推进椎间盘退化的发展,而miR-15b的表达抑制成功干扰了该进程。在本研究中,成功采用Ⅱ型胶原酶法分离得到较纯的大鼠髓核细胞,并用10 ng/ml的IL-1β处理髓核细胞以建立椎间盘退变细胞模型。IL-1β刺激降低了髓核细胞中miR-155的表达量,这可能与引起促炎细胞因子过度产生有关。
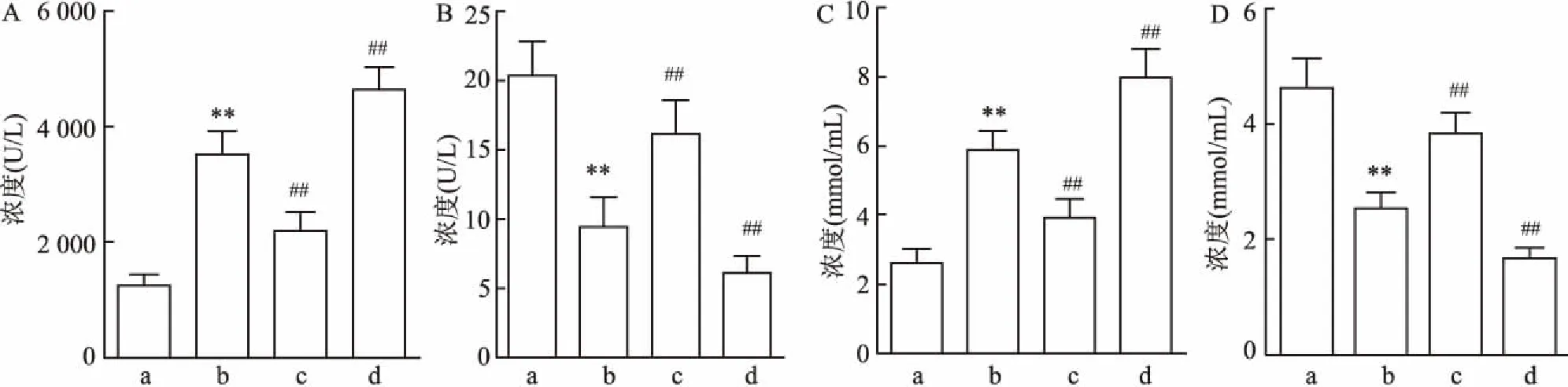
图5 miR-155对髓核细胞氧化应激因子表达的影响
图6 miR-155对髓核细胞p-p65、TNF-α表达的影响
在变性的椎间盘组织中,炎性细胞因子水平升高,持续压迫脊髓或神经根,激活iNOS,产生大量一氧化氮,进一步增加受损区域的iNOS表达,进而诱导过度的髓核细胞凋亡,从而导致椎间盘退化[11]。本研究也证实,IL-1β处理大鼠髓核细胞后,促炎细胞因子大量表达,而抗炎细胞因子表达减少;可见,在椎间盘退变过程中,炎性细胞因子的含量增加是必然过程。大量研究[12]表明,在老化和退变的椎间盘中存在氧化应激和氧化产物浓度的增加,并通过线粒体途径诱导髓核细胞凋亡,是椎间盘退变的发病机制之一。该实验结果也表明,在IL-1β诱导的椎间盘退变细胞模型中存在氧化应激和产物消除的平衡失调,但miR-155过表达成功减少了髓核细胞内炎症细胞因子和氧化应激分子的产生,加速了氧化产物的消除,进而降低了髓核细胞凋亡率和凋亡关键蛋白表达水平,而抑制miR-155表达则加速了髓核细胞凋亡进程。综合实验结果表明,miR-155能降低IL-1β诱导的椎间盘退变细胞模型髓核细胞的体外凋亡水平。
NF-κB 是一种多向性核转录调节因子,P50/P65 二聚体是其最常见形式,NF-κB 激活入核后可调节炎症介质、细胞因子等表达[13]。NF-κB信号通路在多种疾病中均有重要的调节作用,在骨关节炎细胞中,NF-κB p65磷酸化水平升高,进而增加其下游TNF-α等炎性细胞因子的表达[14]。本研究发现,miR-155过表达能有效降低p65入核量,进而抑制p-p65和下游炎性细胞因子TNF-α的表达水平,从而减少因此造成的髓核细胞凋亡。这与王金海等[15]的观点基本一致。综合实验结果表明,在IL-1β诱导的椎间盘退变细胞模型中,miR-155降低髓核细胞凋亡的机制与抑制NF-κB信号通路激活有关,但其中是否还有其他信号途径的参与还有待进一步研究。
综上所述,Ⅱ型胶原酶可分离得到纯度较高的大鼠髓核细胞,miR-155表达增加能有效降低IL-1β诱导大鼠髓核细胞凋亡、炎症反应和氧化应激,且可能与抑制NF-κB信号通路有关。该文旨在为椎间盘退化的治疗提供一个新的方向。
