LOX-1作为潜在的肺特异性衰老标志物的相关研究
2020-08-05曾律滔范国庆欧阳秋庚蔡剑平
曾律滔 范国庆 欧阳秋庚 崔 菊 蔡剑平
目前我国人口老龄化形势严峻,与增龄相关的疾病发生率显著增加,深入了解衰老过程的各种分子机制,揭示生物个体、组织脏器以及细胞的衰老机制,筛选衰老的生物学标志物是一项紧迫的工作[1]。
根据衰老的自由基理论,生物体在各种因素的刺激下会产生大量的自由基和活性氧(reactive oxygen species, ROS),造成核酸、蛋白质和脂质的氧化损伤。研究发现,暴露于ROS的核酸会产生各种碱基修饰,已经发现不同类型氧化修饰的嘌呤和嘧啶超过20多种。由于鸟嘌呤(guanine, G)具有最低的氧化电势,其结构中第8位的碳原子最容易被氧化形成8-氧化鸟嘌呤(8-oxo-7,8-dihydroguanine,8-oxoG),是修饰碱基中含量最丰富的[2,3]。笔者所在实验室前期研究发现,8-oxoG是衡量体内氧化应激水平和衰老的敏感标志物[4,5]。
促进ROS累积的各种因素可能均与衰老过程相关,有可能成为潜在的衰老标志物。凝集素样氧化型低密度脂蛋白受体1(lectin like oxidized low density lipoprotein receptor 1,LOX-1)是一种跨膜糖蛋白,在小鼠的肺内高表达[6]。有研究表明,LOX-1可诱导NADPH的激活,促进ROS的生成,影响机体的氧化应激反应[7]。LOX-1还可以通过激活Bcl-2相关的X蛋白(Bcl-2-associated X protein,Bax)/Bcl-2通路增加Bax/Bcl-2比值,或通过激活促凋亡因子caspase-3/caspase-9的级联反应来介导细胞凋亡[8,9]。
本研究采用蛋白质芯片和免疫组化方法检测了4月龄和20月龄C57BL/6小鼠血清和肺中LOX-1和其他氧化应激相关蛋白的表达,探讨了LOX-1作为肺特异性衰老标志物的可能性。
材料与方法
1.实验动物:本研究所用C57BL/6小鼠均购自江苏集萃药康生物科技有限公司。
2.主要试剂及仪器:免疫组化染色试剂盒(北京中杉金桥生物技术有限公司,货号:PV-6001、PV-6002);封闭用山羊血清(北京中杉金桥生物技术有限公司,货号:ZLI-9056);Anti-LOX-1抗体(英国Abcam公司,货号:ab60178);Anti-DNA/RNA Damage抗体[15A3] (英国Abcam公司,货号:ab62623);Recombinant DNase Ⅰ(RNase-free)(日本TaKaRa公司,货号:2270A);DAB显色液(北京中杉金桥生物技术有限公司,货号:ZLI-9018);QAM-CAA-4000试剂盒(广州瑞博奥生物有限公司);InnoScan 300 Microarray Scanner荧光扫描仪;Thermo Scientific Wellwash Versa芯片洗板机;Milli-Q Plus超纯水装置(美国Millipore公司);120S型精密电子分析天平(德国赛多利斯公司)。
3.动物分组及样本收集:健康C57BL/6小鼠,购买时为2月龄,标准饮食喂养,可自由饮水及进食,分为4月龄组与20月龄组,每组各3只。待其成长至4月龄和20月龄,腹腔注射戊巴比妥钠麻醉,冰上解剖取血清冻存于-80℃,摘除肺、肝脏、脾脏、肾脏和小肠一部分放液氮冻存,另一部分放于10%甲醛溶液进行固定。
4.蛋白质芯片检测:取血清于4℃放置,冻存组织在液氮下研磨成粉末,按比例加入细胞裂解液和蛋白酶抑制剂,裂解30min,冷冻离心机离心后取上清液,获得蛋白提取液。BCA法测量蛋白浓度。将玻片芯片从试剂盒中取出,室温平衡30min,揭开密封条,放在真空干燥器活室温干燥1~2h。配置细胞因子标准品后,于芯片各孔中加100μl的样品稀释液,孵育1h,封闭定量抗体芯片。抽取每孔中的缓冲液,添加60μl的标准液和稀释混合后的样品到孔中,摇床4℃孵育过夜(组织按500μg/ml上样,血清2倍稀释上样)。使用Thermo Scientific Wellwash Versa芯片洗板机清洗玻片,分为两步,首先用1×洗液Ⅰ进行清洗,每孔250μl的1×洗液Ⅰ,清洗10次,每次震荡10s,震荡强度选择高,用去离子水稀释20×洗液Ⅰ。然后换用1×洗液Ⅱ通道进行清洗,每孔250μl的1×洗液Ⅱ,清洗6次,每次震荡10s,震荡强度选择高,用去离子水稀释20×洗液Ⅱ。离心检测抗体混合物小管,然后加入1.4ml的样品稀释液,混合均匀后再次快速离心。每孔加入80μl的检测抗体,37℃孵育2h后再清洗1次,方法同前。离心Cy3-链霉亲和素小管,然后加入1.4ml的样品稀释液,混合均匀后再次快速离心。每孔添加80μl的Cy3-链霉亲和素,用铝箔纸包住玻片避光37℃孵育1h后再次清洗,方法同前。使用InnoScan 300 Microarray Scanner荧光扫描仪扫描信号,采用Cy3或者绿色通道(激发频率=532nm)。采用QAM-CAA-4000的数据分析软件来进行数据分析。
5.石蜡包埋组织的制备与切片:将各组小鼠的肺从甲醛溶液中取出,在生物组织脱水机按30%、50%、70%、80%、90%、95%、100%、二甲苯Ⅰ、二甲苯Ⅱ、切片石蜡Ⅰ、切片石蜡Ⅱ及切片石蜡Ⅲ的顺序进行脱水,各级乙醇和石蜡中设定的时间均为40min,二甲苯中设定的时间均为30min。脱水完毕后,将组织取出,倒入预先开启并熔蜡的包埋机内。将铁模具盒放在温台上预热,将少许石蜡滴入铁盒内,轻夹组织按实验需求放入盒内,再将相应的包埋盒固定于模具上并滴加石蜡至其饱满。稍凝固后放于冰台上加速凝固,3min后放入-20℃冰箱,待其完全凝固后取出,室温保存。包埋好的蜡块用石蜡切片机切片,厚度为5μm,先放入冷水中展平,再放入42℃水中完全展平后用载玻片捞出。
6.免疫组化检测:将制备好的石蜡切片于70℃下烤120min,取出后在二甲苯中脱蜡2次,每次10min。按照无水乙醇,95%、85%、75%乙醇的顺序过缸,每次5min。浸泡入自来水洗10min,再用磷酸盐缓冲溶液(PBS)洗5min,直至玻片清晰。然后以枸橼酸缓冲液加热煮沸进行抗原修复,PBS清洗3次。将准备孵15A3抗体的切片取出,滴加重组DNA酶Ⅰ,37℃孵育12h。滴加3% H2O2工作液消除内源性过氧化物酶的影响。PBS清洗后以山羊血清封闭液封闭30min,1∶400稀释LOX-1抗体,1∶700稀释15A3抗体,4℃孵育12h。PBS清洗3次,用山羊抗兔IgG/HRP聚合物(LOX-1)和山羊抗小鼠IgG/HRP聚合物(15A3)室温孵育30min,DAB显色液显微镜下观察显色。显色完毕后,75%、85%、95%乙醇、无水乙醇的乙醇梯度脱水,均为5min,二甲苯Ⅰ和二甲苯Ⅱ各10min透明,常温风箱内干燥,中性树胶封片。在研究级显微镜下进行拍照,应用Image Pro Plus进行定量,采集单位面积内的平均吸光度值,应用GraphPad 8.0作图。
7.统计学方法:应用SPSS 19.0统计学软件对数据进行统计分析,采用独立样本t检验比较组间差异,以P<0.05为差异有统计学意义。
结 果
1.小鼠肺组织中8-oxoG的表达:含8-oxoG的RNA主要表达于细胞质内,阳性染色为棕黄色。免疫组化染色结果显示,4月龄小鼠的肺组织染色强度很弱,20月龄小鼠的肺染色强度增强,差异有统计学意义(图1)。
2.小鼠肺和血清中氧化应激相关细胞因子的表达:蛋白质芯片结果显示,20月龄组与4月龄组比较,LOX-1和其他4种氧化应激相关的细胞因子IL-6、CD36、MIP-1b、RANTES水平在肺组织中LOX-1、IL-6差异有统计学意义(P<0.05),其中LOX-1的表达为上调,且上调了1.5倍(表1)。在血清中的随增龄差异有统计学意义的有LOX-1、MIP-1b、RANTES(P<0.05),其中仍然只有LOX-1为上调,上调倍数为2.54倍,详见表2。
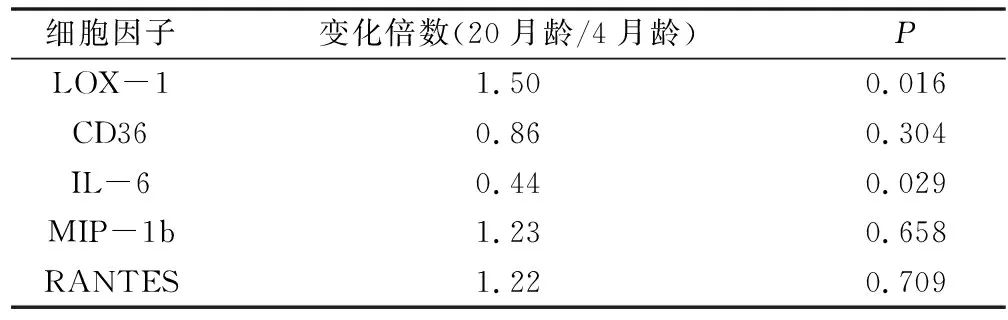
表1 氧化应激相关细胞因子在肺组织中的表达

表2 氧化应激相关细胞因子在血清中的表达
3.LOX-1蛋白的表达:免疫组化染色结果显示,4月龄的肺组织中染色强度较弱,20月龄的肺组织中染色显著增强,差异有统计学意义(图2、图3)。LOX-1在小肠、肾脏、肝脏和脾脏中4月龄和20月龄组比较,差异无统计学意义。
讨 论
1939年,McCay等发现卡路里限制可以延长大鼠和小鼠的寿命,从此拉开了对衰老研究的序幕[10]。1983年,美国国家科学研究委员会(United States National Research Council,NRC)首次提出生物学标志物的概念,成为了生物医药领域最热门的研究领域。目前衰老机制主要被归纳为两类,一是表现为发育过程中遗传编程的衰老,如细胞衰老,神经内分泌改变和免疫学改变等。另一类表现为随机损伤引起的衰老,即体细胞突变和活性氧(ROS)的积累[11]。
本研究发现与低月龄组小鼠比较,高月龄组小鼠肺RNA中8-oxoG的表达显著升高,由于8-oxoG是RNA氧化损伤的标志物,这说明在高龄小鼠肺中的RNA氧化水平显著高于低龄小鼠[5]。根据López-Otín等[12]的研究观点,衰老具有与渐进性生理完整性和功能相关的衰老标志物,其中ROS的累积占据了重要的地位。衰老的线粒体自由基理论认为,随着衰老的发生,线粒体功能障碍导致活性氧的产生增加,又反过来导致线粒体进一步恶化和整体细胞的损伤。肺是少数不断暴露于外部环境的内部器官,环境对肺结构和功能的影响很大程度上决定了肺的健康,这同时也使得肺成为了氧化应激水平最高的器官之一。肺部疾病往往是由多方面因素导致的,在慢性肺疾病(chronic lung diseases,CLDs),如慢性阻塞性肺疾病(COPD)、肺癌以及特发性肺纤维化(IPF)的发病机制中,环境应激源以及生物防御系统的功能严重依赖于年龄。研究表明,以上3种CLDs的发生率都随着年龄的增长而急剧上升[13]。
本研究发现与4月龄组小鼠比较,20月龄组小鼠血清和肺中LOX-1浓度显著升高,但在其他脏器中比较差异无统计学意义。LOX-1最早由Sawamara于1997年内主动脉内皮细胞中发现,是一种50kDa的跨膜糖蛋白,属于C型凝集素家族。LOX-1在除了在内皮细胞表达外,还在血管平滑肌细胞、血小板以及大量免疫细胞如B细胞、NK细胞、巨噬细胞中表达[14]。LOX-1可以与MMP14结合以激活RhoA和Rac1,RhoA可以抑制内皮一氧化氮的合成,而Rac1可以增加NADPH氧化酶的活性,导致ROS的产生和累积。氧化低密度脂蛋白(ox-LDL)可以通过LOX-1激活NF-κB,这不仅激活了促炎途径,还同时促进了LOX-1的产生,从而形成了一个正反馈循环,这可能是高龄组小鼠体内LOX-1浓度升高的分子机制之一[15]。LOX-1还可以通过和ox-LDL的相互作用,使黏附分子(如VCAM-1)和细胞因子(如MCP-1)的产生增加,导致单核细胞附着于内皮细胞。LOX-1和ox-LDL结合还可以导致丝裂原活化蛋白激酶(MAPK)磷酸化并导致凋亡[15]。
本研究结果显示,在增龄过程中,肺受到了多方的刺激而产生了大量的ROS,这些ROS在肺组织中累积,并随着衰老的进程不断地对组织造成损伤,而其中一条途径可能就是通过LOX-1介导的,LOX-1的表达增加不仅会产生大量的ROS,还促进了炎症的发生以及凋亡,这不仅会加速衰老的过程,还有可能导致疾病的发生,例如CLDs。
由于本研究样本量较少,仅选取了4月龄和20月龄的小鼠,中间月龄的相应指标的变化是否符合本次研究的趋势尚且未知,并且目前所选取的脏器较少,还需要在更多脏器中验证,同时,本研究尚未深入探讨LOX-1对衰老及氧化的影响的精确机制。
综上所述,本研究发现,高龄小鼠血清和肺中LOX-1浓度较低龄小鼠显著升高,而在其他脏器中无显著变化,可作为小鼠肺特异性衰老标志物,其衰老机制以及在慢性肺疾病发病中的作用和潜在的临床应用价值有待于进一步研究。
