安化黑茶减轻高脂诱导的ApoE-/-小鼠非酒精性脂肪肝*
2020-08-04张文将刘圆月张晓芹侯菊花刘柏炎
张文将, 刘圆月, 易 健, 张晓芹, 侯菊花, 刘柏炎△
(1陕西中医药大学基础医学院,陕西咸阳712046;2益阳医学高等专科学校,湖南益阳413000;3湖南中医药大学,湖南长沙410208)
随着人们饮食结构和生活方式的改变,非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的发病率呈现上升趋势,成年人NAFLD 患病率为17%~33%,已成为仅次于病毒性肝炎的第2大肝病,尤其在肥胖和超重的人群中最为多见,如若病情持续发展,导致肝细胞反复变性坏死,最终将会转化为肝硬化甚至肝细胞癌[1-4]。
目前NAFLD 缺乏一线有效的治疗药物,替代药物具有潜在的肝毒性和肾毒性。临床实践指南认为抗氧化剂的应用可以减轻肝脏脂肪变性和炎症反应[5]。茶作为一种公认的天然抗氧化剂,为NAFLD预防和治疗提供了新的思路。安化黑茶作为一种以绿茶为原料的后发酵茶,隶属黑茶类,在发酵的过程中产生了茶黄素、茶红素、茶褐素、冠突散囊菌等新的物质,其中冠突散囊菌存在类他汀成分[6],是具有很大优势的微生物[7-8]。本课题组前期实验证实安化黑茶可显著降低载脂蛋白E 敲除(apolipoprotein E knockout,ApoE-/-)小鼠体重、肝脾重量和肝指数,抑制腹部、肾周部位脂肪的合成,降低血清中甘油三酯(triglyceride,TG)和低密度脂蛋白含量并抑制炎症因子的表达[9]。由此可见,安化黑茶具有很好的调节脂类代谢紊乱的效果。内源性脂类物质合成增加是造成脂代谢紊乱的重要因素,与NAFLD 的发生密切相关。但安化黑茶能否抑制内源性脂类物质的合成,以往的研究中鲜有报道,需要通过动物实验来探索其相关机制。于是,本研究采用ApoE-/-小鼠配合高脂饲料喂养的方法复制NAFLD 模型,应用羟甲基戊二酸单酰辅酶A 还原酶(hydroxymethyl glutaryl coenzyme A reductase,HMGCR)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptorγ,PPAR-γ)和硬脂酰辅酶A脱饱和酶1(steroyl coenzyme A desaturase-1,SCD-1)3 个指标来观察安化黑茶对于脂类合成的相关影响,通过检测超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性及丙二醛(malondialdehyde,MDA)含量来观察安化黑茶预防性给药的抗氧化效果,通过肝脏丙氨酸转氨酶(alanine aminotransfease,ALT)和天冬氨酸转氨酶(aspartate transaminase,AST)检测来判断肝细胞受损情况,以期深入研究安化黑茶预防NAFLD 的相关机制。
材 料 和 方 法
1 材料
1.1 实验动物 8 周龄雄性SPF 级ApoE-/-小鼠50只,购于南京大学模式动物研究所,体质量(25±5)g,品系名ApoE Cas9-KO,品系编号T001458,遗传背景C57BL/6,配 繁信 息 为-82bp/wt 配 B6J,基 因 型为(ApoE)KO/KO,许可证号为SCXK(苏)2015-0001;8周龄野生型C57BL/6J 雄性小鼠10 只,许可证号为SYXK(湘)2016-0002。本次实验通过了湖南中医药大学伦理委员会审查,动物伦理批准号为20171001,实验单位许可证号为SYXK(湘)2013-0005。
1.2 药物及试剂 2014年天茯茶(安化黑茶的一个品种,由湖南省白沙溪茶厂出品);阿托伐他汀(辉瑞制药有限公司,规格:10 mg,批号 110590);MDA 测定试剂盒(TBA 法)、GSH-Px 测定试剂盒(比色法)、总SOD 测定试剂盒(WST-1 法)、ALT 测定试剂盒和AST 测定试剂盒购于南京建成生物工程研究所;TRIzol Reagent(Invitrogen);TB GreenTMPremix Ex TaqTM(TaKaRa);RevertAid First Strand cDNA Synthesis Kit(Thermo Scientific)。
1.3 饲料配方 高脂饲料(型号:H10141)由北京华阜康生物科技股份有限公司提供,生产许可证号为SCXK(京)2014-0008,含21%脂肪和0.15%胆固醇,具体配方:胆固醇、碳酸钙、玉米油、无水奶油、酪蛋白、蛋氨酸、麦芽糖糊精、玉米淀粉、纤维素、矿物质混合物和维生素混合物。
1.4 主要仪器 高速冷冻离心机(Hermle,型号:Z32HK);分光光度计(岛津,型号:UV-1700);多功能酶标仪(PerkinElmer,型号:Enspire);光学显微镜(奥林巴斯,型号:BX-51);核酸蛋白浓度测定仪(BioDrop);PCR 扩增仪(Bio-Rad);荧光定量PCR 仪(Eppendorf)。
2 方法
2.1 药物制备 黑茶每天饮用量按照推荐成人饮用量每天10 g,将2014 年白沙溪牌天茯茶用干净茶刀撬下少许,称量至所需量,随后戴无菌手套将所撬茶叶掰成小块,用无菌纱布包裹系紧,放入无菌烧杯中,加入实验室Ⅲ级水,加水量高于茶叶2~3 cm并浸泡30 min,随后将烧杯放在实验电炉上进行加热,武火煮开后改为文火慢炖30 min 左右,冷却后过滤,取汁另置,将黑茶残渣加蒸馏水适量(与药渣齐平)继续煎熬,沸腾后冷却少许,将两次药液合并一起小火浓缩至所需体积,2 683×g离心 15 min 后,取上清液浓缩成含生药量,将上述药液用无菌纱布过滤后放入消毒磨口瓶中,4℃冰箱保存备用。为防止药液变质,每次浓缩的药量用1 周左右。参考茶吸收试验中60 kg 成人每日推荐饮用量为10 g,即每人每日为166.7 mg/kg,根据人和动物的体表面积换算小鼠所用剂量为 1.44 g·kg-1·d-1[10]。黑茶高、中、低剂量分别为 2.16、1.44 和 0.72 g·kg-1·d-1,相当于人体推荐剂量的13.5、9 和4.5 倍。阿托伐他汀按照 10 mg·kg-1·d-1剂量进行灌胃,实验前将药片放入干净研钵中碾碎,加入所需体积的生理盐水溶解,现配现用。
2.2 小鼠饲养 实验小鼠饲养于SPF 级独立通气笼盒中,仪器压差20 Pa,温度(24.0±0.5)℃,相对湿度(50%~70%),昼夜光照节律。ApoE-/-小鼠采用高脂辐照饲料,饲料于-20℃低温保存,短期使用于4℃保存;空白对照组小鼠予以普通生长饲料(湖南斯莱克景达实验动物公司提供);饲养密度为每笼5 只小鼠,饮水为Ⅲ级水,自由饮水;垫料按照一周3 次的频率予以更换,定期对笼具及水瓶进行消毒。
2.3 动物分组、造模与给药 实验动物适应性饲养1 周后,随机将50 只8 周龄ApoE-/-雄性小鼠分为模型组(10 mL/kg 生理盐水灌胃)、阿托伐他汀组及安化黑茶高、中、低剂量组,每组10 只,每天定量给予高脂饲料喂养;另取10 只8 周龄的雄性C57BL/6J 小鼠作为空白对照组(10 mL/kg 生理盐水灌胃),每天定量予以普通生长饲料喂养。各组小鼠每天早晨9 点左右给予药物灌胃干预,连续给药17周[11-13]。
2.4 标本收集与处理 各组小鼠于灌胃给药第17周末禁食不禁水12 h,腹腔麻醉后摘除眼球取血,收集于 1.5 mL EP 管中,室温静止 2 h 后 12 000×g、4℃离心15 min,移液器收集血清后分装于EP 管中,保存于-80℃待测。采用颈椎脱臼处死小鼠,遂将小鼠放置于冰上操作取材,腹腔打开暴露肝脏,用眼科剪迅速剪掉整个肝脏,放在袖珍型精密天平上称量肝脏重量,预冷生理盐水漂洗后剪取同一部位部分肝脏小叶放入4%多聚甲醛中用于HE 染色;称取100 mg 左右肝脏组织放入无RNA 酶的冻存管中,加入1 ml 预冷TRIzol,迅速放入液氮中进行速冻,随后将标本移至-80℃冰箱中备RT-qPCR 检测;部分肝脏组织放入无RNA 酶的冻存管中液氮速冻后移至-80℃冰箱保存以备肝功能和氧化应激指标的检测。
2.5 氧化应激指标的测定 从-80℃冰箱中取小鼠肝组织若干,在冰生理盐水中漂洗,除去血液,滤纸擦干,放入无菌离心管中,用消毒眼科剪尽量将肝组织剪碎,加9 倍冰生理盐水于自动匀浆机冰上操作制成10%肝匀浆,4℃、670×g离心15 min,取上清液加生理盐水稀释成适宜浓度备测,测定肝脏组织中SOD 和GSH-Px 活性及MDA 含量,预实验得出最佳抑制率后进行正式实验;将所得数值代入公式中计算并进行数据分析。
2.6 肝功能检测 取10%肝匀浆用BCA 试剂盒测定各组样本的蛋白浓度,按照说明书步骤进行操作,计算出肝组织中ALT和AST的活性。
2.7 病理形态学检测及评估 多聚甲醛固定肝脏组织后转移4℃冰箱中保存,48 h 后常规脱水包埋处理,4 μm 厚度切片染色,显微镜下观察肝脏形态,拍照对比。按照《NASH 临床研究网病理工作指南》对NAFLD 活动度积分(NAFLD activity score,NAS)进行半定量分析[14]。
2.8 RT-qPCR检测
2.8.1 引物设计 从NCBI 网站搜索小鼠以下基因mRNA 序列,采用Primer 6.0 软件设计引物,引物序列信息见表1。
2.8.2 组织总RNA 的提取 采用TRIzol 法来提取小鼠肝脏组织中的总RNA。用液氮低温研磨法对肝脏组织进行研磨,用无RNA 酶200 μL 的吸头收集研钵中的肝脏组织粉末,转移至1.5 mL 的无RNA 酶的EP管中,加入1 mL TRIzol室温放置10 min。按照Invitrogen 所提供的说明书步骤提取肝组织中的总RNA。用移液器抽取2 μL 的RNA 提取液采用核酸蛋白浓度测定仪对浓度进行检测,并记录吸光度比值(A260/A280),从而判断 RNA 提取的质量(A260/A280在1.8~2.0之间说明RNA的质量较好)。
2.8.3 RNA 逆转录为cDNA 具体步骤按照Ther-mo Scientific 所提供的实验操作步骤进行。总反应体系20 μL。逆转录第1步,RNA 变性:模板RNA(总RNA)4 μg,Oligo(dT)18引物 1 μL,加 RNase-free water 配成 12 μL 体系,于 65℃孵育 5 min 进行变性,完毕后迅速于冰上冷却。将RNA 逆转录为cDNA 第1链:5× Reaction Buffer 4 μL、RiboLock RNase Inhibitor(20 U/μL)1 μL、10 mmol/L dNTP Mix 2 μL 和 RevertAid M-MuLV逆转录酶(200 U/μL)1 μL瞬时涡旋混匀,置于冰盒中备用,再放入提前预热的PCR 仪中完成以下程序的设置:42℃60 min→70℃ 5 min→4℃,完成RNA逆转录为cDNA第1链。
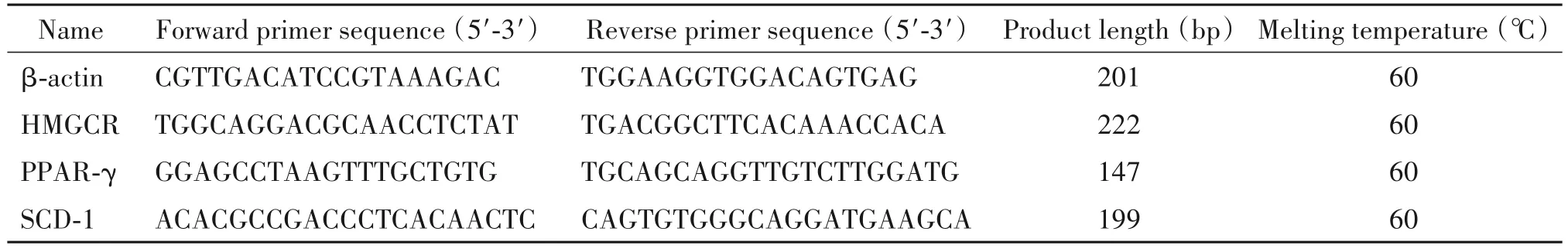
表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-qPCR
2.8.4 RT-qPCR 扩增 根据上海生工所提供的相应引物的Tm值设置56、58、60和62℃4个退火温度梯度,根据溶解曲线确定最佳的退火温度,然后进行正式的RT-qPCR 扩增,具体反应条件为:95℃2 min;95℃ 15 s,60℃ 1 min,循环40次。
2.8.5 结果分析方法 内参照选用β-actin,采用2-ΔΔCt法进行相对定量,ΔCt=基因 Ct-内参照 Ct,ΔΔCt=实验组Ct-对照组Ct。
3 统计学处理
运用SPSS 18.0 软件进行分析,数据以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析,组间两两比较采用LSD 法。以P<0.05 为差异有统计学意义。
结 果
1 肝脏镜下观图片
正常组小鼠肝小叶结构完整,肝细胞大小一致,细胞核居中,胞浆红染,见图1A、G;模型组小鼠肝细胞体积变大,大小不一,细胞核偏位,胞浆呈现疏松化和空泡脂肪变性现象,见图1B、H;安化黑茶高剂量组小鼠肝小叶结构清晰,肝细胞核居中,胞浆呈现红染,部分区域出现少量空泡变性现象,见图1C、I;中剂量组小鼠肝脏轮廓清晰,肝细胞大小一致,细胞核居中,胞浆红染,个别区域出现少量的空泡变性现象,见图1D、J;低剂量组小鼠肝小叶结构基本完整,肝细胞大小基本一致,肝细胞空泡变性和胞浆疏松化的现象稍多,见图E、K;阿托伐他汀组小鼠肝细胞大小不等,可见胞浆疏松化和大小不等的空泡脂肪变性现象,见图1F、L。各组NAS见表2。
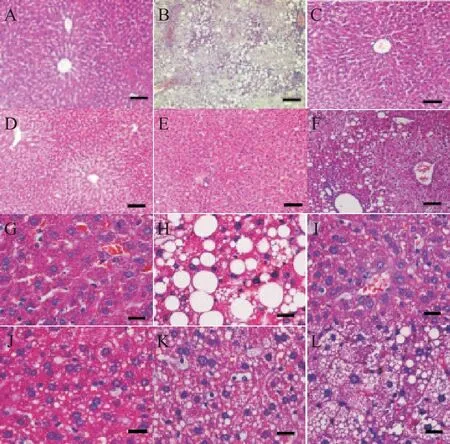
Figure 1.The microscopic changes of hepatic tissues in mice(HE staining).A~F:scale bar=200 μm;G~L:scale bar=50 μm.A,G:control group;B,H:model group;C,I:high-dose Anhua dark tea group;D,J:mediumdose Anhua dark tea group;E,K:low-dose Anhua dark tea group;F,L:atorvastatin group.图1 小鼠肝组织镜下观变化
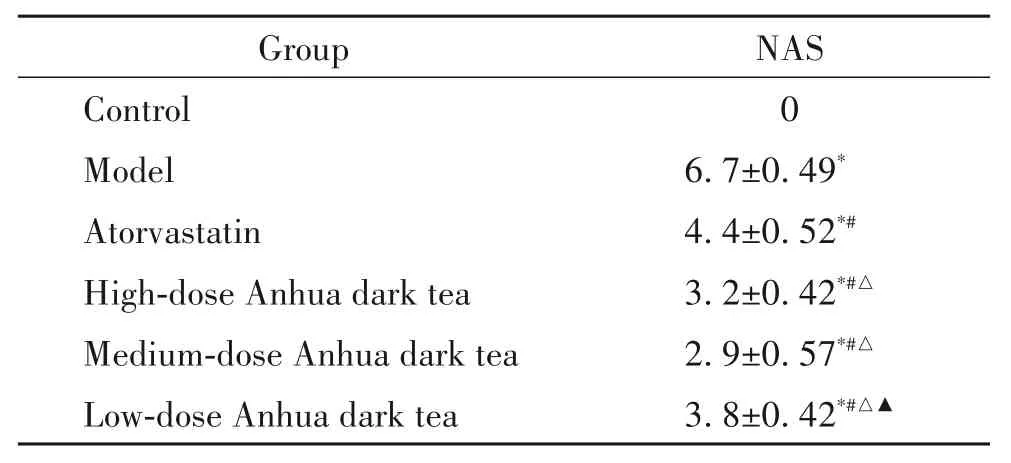
表2 NAFLD活动度积分在各组间的比较Table 2.Comparison of NAFLD activity scores(NAS)among the 6 groups(Mean±SD. n=10)
2 肝脏肉眼观图片
正常对照组小鼠肝脏体积偏小,颜色暗红色,见图2A;模型组小鼠肝脏体积偏大,黄色油腻感严重,见图2B;安化黑茶高剂量组小鼠体积增大,肝脏呈现暗红色,油腻感较轻,见图2C;中剂量组小鼠肝脏暗红色,油腻感较轻,见图2D;低剂量组肝脏体积增大,呈现黄色油腻感,见图2E;阿托伐他汀组小鼠组肝脏体积增大,呈现黄色油腻感,见图2F。

Figure 2.The visual changes of hepatic tissues in mice of different groups.A:control group;B:model group;C:high-dose Anhua dark tea group;D:mediumdose Anhua dark tea group;E:low-dose Anhua dark tea group;F:atorvastatin group.图2 各组小鼠肝组织肉眼观变化
3 肝脏转氨酶水平
与空白组相比,模型组小鼠肝脏ALT 和AST 水平升高(P<0.05);与模型组相比,安化黑茶高、中、低剂量组和阿托伐他汀组ALT 和AST 水平降低(P<0.05),其中中剂量组ALT 水平最低(P<0.05);阿托伐他汀组AST水平低于中剂量组(P<0.05),中、低剂量组AST 水平无显著差异(P>0.05),高剂量组AST水平低于中剂量组(P<0.05),见表3。
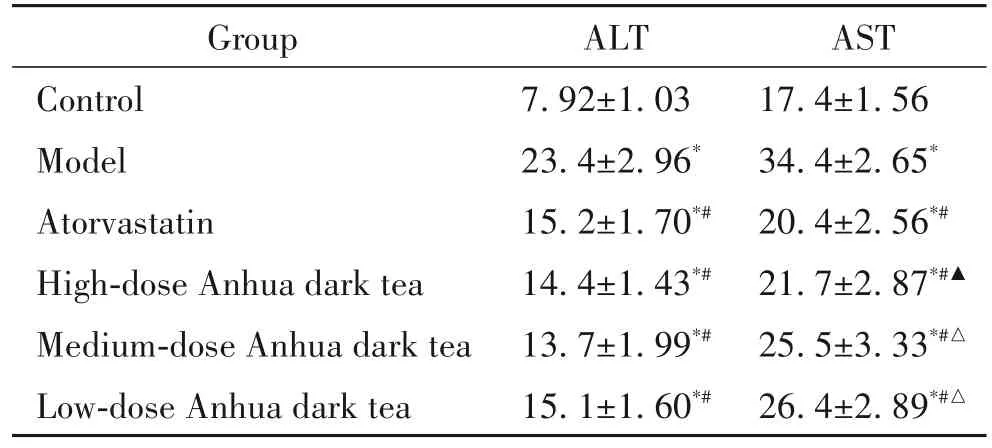
表3 小鼠肝组织中ALT和AST水平Table 3.The levels of hepatic ALT and AST in mice[U/(g protein).Mean±SD. n=10]
4 氧化应激水平
与空白组相比,模型组小鼠肝脏SOD 和GSH-Px活性下降,MDA 含量升高(P<0.05);与模型组相比,安化黑茶高、中、低剂量组SOD 和GSH-Px活性升高,MDA 含量下降(P<0.05);与阿托伐他汀组相比,高剂量组SOD活性升高(P<0.05),低剂量组GSH-Px活性稍低(P<0.05),各剂量组其余指标与他汀组相比无显著差异(P>0.05);与中剂量组相比,低剂量组SOD 和GSH-Px 活性稍低,MDA 含量稍高(P<0.05),高剂量组 SOD 活性升高(P<0.05),GSH-Px 活性和MDA含量无显著差异(P>0.05),见表4。

表4 小鼠肝脏氧化应激相关指标Table 4.The levels of hepatic oxidative stress indicators in mice(Mean±SD. n=10)
5 脂类物质合成相关指标
5.1 HMGCR mRNA 表达 与模型组相比,安化黑茶不同剂量组和阿托伐他汀组小鼠肝脏HMGCR 的mRNA 表达都显著降低(P<0.05),其中他汀组和中剂量组最低(P<0.05);中剂量组与他汀组相比无显著差异(P>0.05),高、低剂量组高于中剂量组(P<0.05),见表5。
5.2 SCD-1 mRNA 表达 与模型组相比,安化黑茶不同剂量组小鼠肝脏SCD-1 的mRNA 表达都显著降低(P<0.05),其中高、中剂量组最低(P<0.05);阿托伐他汀组表达高于中剂量组(P<0.05),低剂量组高于中剂量组(P<0.05),高剂量组与中剂量组相比无显著差异(P>0.05),见表5。
5.3 PPAR-γ 的 mRNA 表达 与模型组相比,安化黑茶不同剂量组和阿托伐他汀组小鼠肝脏PPAR-γ mRNA 表达降低(P<0.05);高、中剂量组低于他汀组(P<0.05),各剂量组之间无显著差异(P>0.05),见表5。

表5 各组小鼠肝脏HMGCR、SCD-1和PPAR-γ的mRNA表达Table 5.The mRNA levels of hepatic HMGCR,SCD-1 and PPAR-γ in mice(Mean±SD. n=10)
讨 论
减少外源性脂类物质的摄入、抑制内源性脂类物质的过度合成、促进脂类物质的转运和分解对于防止脂类物质在肝脏的沉积起着重要作用。从病理形态学来看,ApoE-/-小鼠预防性灌胃给药可很好地减轻肝脏脂变程度,我们前期研究已证实安化黑茶灌胃组小鼠血清中TG 含量低于模型组。肝脏中沉积的脂质主要是TG,内源性酯类物质合成的增加是诱发NAFLD 的关键因素。SCD-1是脂肪酸代谢过程中的关键限速酶,广泛存在于各种组织中,其中以脂肪组织和肝组织中居多,在脂肪酸的合成代谢过程中发挥着重要的作用[15-16]。本研究发现安化黑茶组小鼠肝脏SCD-1 的mRNA 表达显著低于模型组,有可能是由于NAFLD 形成过程中伴随着胰岛素抵抗的现象[17-18],减弱了胰岛素对脂蛋白脂酶(lipoprotein lipase,LPL)的激活作用,而LPL的减少导致TG无法被水解,引起高脂血症的发生,而过多脂类物质的产生促使肝脏SCD-1 表达增加,加速了脂肪酸的合成,从而导致NAFLD 的发生。而安化黑茶可能通过减轻胰岛素抵抗而增强了胰岛素对于LPL 的激活作用,使TG 被水解,血脂含量有所降低,而脂类物质的减少也抑制了SCD-1表达,使肝脏脂变程度减轻。
HMGCR 作为与胆固醇代谢密切相关的转录因子及其代谢酶,可促进胆固醇的合成,从而诱发脂肪肝的形成。本研究显示,各用药组小鼠肝脏HMGCR的mRNA 表达显著低于模型组,其中他汀组和黑茶中剂量组最低。他汀类药物为HMGCR抑制剂,因此这一结果说明安化黑茶中可能有类他汀的成分,安化黑茶可以通过下调HMGCR 表达而起到抑制胆固醇合成的效果。
PPAR-γ 与肥胖、糖尿病、胰岛素抵抗及其代谢综合症等疾病的发生和转归密切相关[19]。PPAR-γ在动物的脂肪组织中表达最为丰富[20-21],可以促使游离脂肪酸在脂肪细胞的沉积,因此PPAR-γ是生脂过程的标志性因子。当肝细胞由于脂类沉积诱发脂肪变性后,肝脏中的PPAR-γ 表达便会显著升高,大量PPAR-γ 表达促使脂质合成基因的激活,导致肝脏更多脂质的沉积[22-23]。若能够去除肝细胞内或者巨噬细胞内的PPAR-γ,则可以有效避免小鼠肝脏脂肪变性[24]。本研究的结果和上述文献一致,由此我们推测可能是由于高脂饮食促使肝脏PPAR-γ 出现高表达,过多脂类物质的摄入导致外周游离脂肪酸含量的增加,从而激活PPAR-γ信号并诱导其下游脂肪酸转位酶(fatty acid translocase,FAT)的表达,FAT促使肝细胞摄取更多的脂肪酸,过多脂肪酸摄入超过了肝脏自身氧化的能力,最终诱导了肝细胞脂肪变性的发生。安化黑茶预防性给药可以通过下调肝脏PPAR-γ 的mRNA 表达而减少脂类物质在肝脏沉积,从而达到很好的预防非酒精性脂肪肝的效果。
肝细胞的氧化损伤是诱发NAFLD 的重要因素之一。SOD 活性的高低间接反映了机体清除氧自由基的能力,过量的MDA 具有潜在的细胞毒性,是评价细胞损伤程度的重要指标,GSH-Px 可维持细胞膜结构的完整,因此可通过检测SOD、MDA 和GSH-Px这3 个指标来推测机体抗氧化的情况[25]。本研究结果显示,模型组小鼠肝脏中SOD 和GSH-Px 活性降低,MDA 含量升高,反映了在NAFLD 模型小鼠确实存在氧化损伤状况;安化黑茶不同剂量组预防性给药均可以提高肝脏SOD 和GSH-Px 活性,降低MDA含量及ALT 和AST 活性,说明安化黑茶预防性给药可以起到抗氧化作用,从而减少对肝细胞的氧化损伤。
综上所述,安化黑茶可能通过抑制脂类物质的合成、减少肝脏的氧化损伤来达到防治NAFLD 的效果。但是脂质转运和分解异常也与NAFLD 的发生密切相关,我们在后续实验过程中将检测影响脂类物质转运和分解的相关指标并进行深入分析。
