再生障碍性贫血患者CD4+T细胞中共刺激分子和免疫抑制受体的表达特点和意义*
2020-08-04黄桂璇张玉平陈小惠陈存特谭广销曹长姝李扬秋
郁 志 , 黄桂璇, 张玉平, 陈小惠, 沈 琦, 陈存特,谭广销, 曹长姝, 李扬秋, 李 萡△
(1暨南大学附属第一医院血液内科,2暨南大学基础医学院血液学研究所,广东广州510632;3广州市第一人民医院,华南理工大学附属第二医院血液内科,广东广州510180;4深圳市人民医院,暨南大学第二临床医学院血液内科,广东深圳518020;5暨南大学基础医学院解剖学系,广东广州510632)
再生障碍性贫血(aplastic anemia,AA)是一种主要以T细免疫介导造血干/祖细胞破坏引起骨髓造血功能衰竭的血液系统疾病。AA 在我国发病率为7.4/106人,远远高于欧美国家[1]。
T 细胞活化需要双信号(第一信号和第二信号)共同作用。第二信号主要包括共刺激分子和免疫抑制受体,其中共刺激分子包括CD28、CD27、OX40、4-1BB、糖皮质激素诱导的肿瘤坏死因子受体(glucocorticoid-induced tumor necrosis factor receptor,GITR)、可诱导T细胞共刺激分子(inducible T cell costimulator,ICOS)、疱疹病毒侵入介质(herpesvirus entry mediator,HVEM)等,免疫抑制受体包括程序性死亡蛋白1(programmed cell death protein-1,PD-1)、细胞毒性T 淋巴细胞相关抗原4(cytotoxic T-lymphocyte-associated antigen-4,CTLA-4)、淋巴细胞活化基因3(lymphocyte activation gene-3,LAG-3)、含T 细胞免疫球蛋白和黏蛋白结构域蛋白3(T-cell immunoglobulin and mucin domain-containing protein-3,TIM-3)等[2-4]。这些正性或负性调控T 细胞活化的第二信号分子是保证恰当、有效T 细胞免疫应答的必要因素。
CD4+T细胞与AA 的发病有一定关系,目前有关AA 患者CD4+T细胞中第二信号分子的研究并不多,因此通过系统分析AA 患者CD4+T 细胞参与T 细胞活化调控第二信号分子的特点将为全面了解AA 的T细胞免疫发病机制提供基础研究数据。
材 料 和 方 法
1 样本资料
共收集12 例健康成人(healthy individuals,HI)外周血(其中男性8 例,女性4 例,中位年龄38 岁)作为对照组,16 例AA 患者[包括5 例非重型再生障碍性贫血(non-severe aplastic anemia,NSAA)、5 例重型再生障碍性贫血(severe aplastic anemia,SAA)和6例极重型再生障碍性贫血(very severe aplastic anemia,VSAA),其中男性9 例,女性7 例,中位年龄30 岁]外周血作为实验组。收集这些外周血样本时已告知本人,并通过暨南大学附属第一医院伦理委员会批准。
2 主要试剂与仪器
CD3-FITC(HIT3a)、CTLA-4-BV421(BNI3)、GITR-PerCP/Cy5.5(108-17)和HVEM-APC(TR2)抗体购自 BioLegend;CD4-APC-H7(RPA-T4)、OX40-PE(ACT35)、4-1BB-BV421(4B4-1)、ICOS-PE(DX-29)、TIM-3-Alexa Fluor(7D3)和 LAG-3-PE(T47-530)抗体购自BD Biosciences;红细胞裂解液购自BD Biosciences;细胞染色缓冲液购自BioLegend。FACSVerse流式细胞仪为BD Biosciences产品.
3 流式细胞术检测
3.1 CD4+T 细胞中共刺激分子检测 根据本实验室流式细胞术检测常规方法,配制预混液等试剂后[5],分别取2个流式管(A:对照管;B:全染管),每管加入 200 μL 的健康人或 400 μL 的 AA 患者外周血,各管中加入相当于10 倍外周血体积的红细胞裂解液,混匀,室温避光放置10 min,随后使用350×g离心 5 min。弃上清,加入 2 mL 的 1× PBS 洗涤,350×g离心5 min,弃上清,重复一次。弃上清,加入50 μL的细胞染色液缓冲液重悬细胞,形成单细胞悬液,在A 管中加入配好的抗体预混液(包含有流式抗体CD3 1 μL,CD4 1 μL,OX40-ISO 20 μL,GITR-ISO 5 μL,4-1BB-ISO 5 μL,ICOS-ISO 20 μL,HVEM-ISO 20 μL);同样,在B 管中加入抗体预混液(包含流式抗体 CD3 1 μL,CD4 1 μL,OX40 20 μL,GITR 5 μL,4-1BB 5 μL,ICOS 20 μL,HVEM 20 μL);轻轻混匀,室温下避光孵育20 min。上述流式管中加入2 mL 的 1× PBS,350×g离心 5 min,弃上清,再重复一次。弃上清,据细胞数情况在管中加入300~500 μL的细胞染色缓冲液重悬细胞,使用流式细胞仪检测细胞。
3.2 CD4+T 细胞中免疫抑制受体检测 该检测中外周血红细胞裂解及单细胞悬液制备方法同上。在A 管中加入抗体预混液(包含流式抗体CD3 1 μL 和CD4 1 μL);同样,在B 管中加入抗体预混液(包含流式抗体CD3 1 μL,CD4 1 μL,TIM-3 5 μL,CTLA-4 5 μL,LAG-3 5 μL);轻轻混匀,室温下避光孵育20 min(TIM-3、LAG-3 和 CTLA-4 的流式圈门选用 FMO对照)。之后洗涤及重悬细胞流式细胞仪检测细胞步骤同上。收集CD4+T细胞中共刺激分子和免疫抑制受体流式细胞术检测原始数据后,采用FlowJo 软件(Becton,Dickinson and Company)进行分析。
4 统计学处理
使用SPSS 25.0 进行统计学分析。各组数据均用箱图(box plot)表示:箱(box)中的横线表示中位数(median);箱的上、下边(ends)分别表示上、下四分位数(quartiles);上、下误差线(whiskers)分别表示最大值(maximum)和最小值(minimum)。组间差异采用非参数秩和检验(Mann-Whitney 检验)。以P<0.05为差异有统计学意义。
结 果
1 AA患者外周血CD4+T细胞中共刺激分子比例
12 例健康人外周血中CD4+T 细胞中OX40、ICOS、4-1BB、GITR 和 HVEM 的比例依次为 3.26%、2.40%、1.39%、25.95%和49.60%;16 例AA 患者(5例 NSAA、5 例 SAA 和 6 例 VSAA)外周血 CD4+T 细胞上述信号分子的比例依次为8.01%、2.44%、1.16%、11.55%和82.20%。AA患者外周血中CD4+OX40+T细胞比例显著高于健康人,而CD4+GITR+T 细胞的比例显著低于健康人(P<0.01);不同病情程度AA 患者CD4+GITR+T 细胞比例均显著低于健康人(P<0.05);SAA 和 VSAA 患者 CD4+OX40+T 细胞比例均显著高于健康人(P<0.05);VSAA 患者CD4+HVEM+T细胞显著高于健康人(P<0.05),见图1。
2 AA患者外周血CD4+ T细胞免疫抑制受体比例
健康人外周血 CD4+T 细胞中 TIM-3、LAG-3 和CTLA-4 的比例依次为4.47%、1.37%和4.27%;而AA 患者外周血CD4+T 细胞的比例依次为7.85%、1.72%和5.38%。AA 患者外周血CD4+T 细胞中TIM-3、LAG-3 和CTLA-4 的比例与健康人相比均无显著差异,不同病情程度AA 患者与健康人,以及不同病情程度AA 患者之间上述分子的表达亦无显著差异,见图2。
讨 论
目前普遍认为AA 是异常T 细免疫介导的自身免疫性疾病,多项研究表明AA 中存在异常T 细胞活化[6]。T 细胞活化需要双信号,其中第二信号又包括共刺激分子和免疫抑制受体,这是两类执行不同调控功能的信号分子。共刺激分子促进T 细胞活化,而免疫抑制受体起到“刹车”的作用,控制T 细胞不发生过度活化。因此,二者之间的平衡可保证机体的正常T 细胞免疫功能,这个平衡一旦打破,将会引起T 细胞免疫缺陷或T 细胞免疫亢进[7]。我们前期研究也发现AA 患者外周血中与T 细胞活化的TCR/CD3复合物各组成基因(CD3γ、CD3δ、CD3ε和CD3ζ)和第二信号分子CD28 的mRNA 表达升高并参与调控转录后调控机制对CD3ζ表达影响[8-10]。
CD4+T 细胞又称辅助性T 细胞,其主要功能是促进B 细胞、T 细胞和其它免疫细胞增殖和分化,协调不同类型免疫细胞之间的相互作用。根据所分泌细胞因子的不同特点,CD4+T 细胞大致可以分为Th1、Th2、调节性 T 细胞和Th17 细胞亚群,最近还检测到 Th9、Th22 和 Tfh 等细胞亚群[11]。AA 中异常CD4+T 细胞研究发现Th1 免疫格局偏移,调节性T 细胞数量和功能异常以及Th17 细胞数量异常等[12-14]。有关AA 中CD4+T 细胞异常T 细胞活化第二信号分子的研究不多,我们前期研究也提示不同病情程度AA 患者 CD4+CD27+T 细胞比例均显著升高[15]。有报道显示 AA 患者 CD4+PD-1+T 细胞的比例升高[16]。因此,本研究全面分析了AA患者中CD4+T细胞多种第二信号分子的变化。
OX40 属于肿瘤坏死因子受体超家族成员,主要在活化的T 细胞上表达,在CD4+T 细胞上表达更高。OX40 与其配体OX40L 识别后,促进T 细胞增殖和存活[17]。本研究结果表明 AA 患者 CD4+OX40+T 细胞比例显著高于健康人,而且在SAA 和VSAA 患者中更高,结果说明AA 患者CD4+T 细胞中OX40 可能与T细胞过度活化有关。

Figure 1.The expression features of co-stimulatory molecules in peripheral blood CD4+ T cells of AA patients.A:the logic diagram of flow cytometry for detecting CD4+ OX40+,CD4+ ICOS+,CD4+ 4-1BB+,CD4+ GITR+ and CD4+ HVEM+ T cells;B:the proportion of CD4+ OX40+,CD4+ ICOS+,CD4+ 4-1BB+,CD4+ GITR+ and CD4+ HVEM+ T cells in peripheral blood of healthy individuals(HI)and AA patients;C:the proportion of CD4+OX40+,CD4+ICOS+,CD4+4-1BB+,CD4+GITR+and CD4+HVEM+T cells in peripheral blood of HI and different degree of AA patients.The data were expressed as box plot,including median,first quartile,third quartile,minimum and maximum. n=12 in HI group;n=16 in AA group(n=5 in NSAA and SAA,n=6 in VSAA).*P<0.05,**P<0.01 vs HI group.图1 AA患者外周血CD4+T细胞共刺激分子的表达
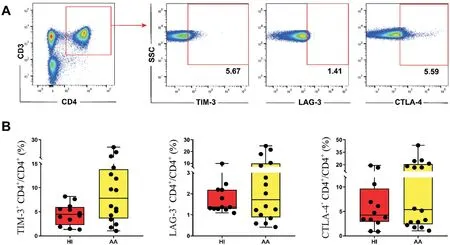
Figure 2.The expression features of immune inhibitory receptors in peripheral blood CD4+ T cells of AA patients.A:the logic diagram of flow cytometry for detecting CD4+ TIM-3+,CD4+ LAG-3+ and CD4+ CTLA-4+ T cells;B:the proportion of CD4+TIM-3+,CD4+LAG-3+and CD4+CTLA-4+T cells in peripheral blood of healthy individuals(HI)and AA patients.The data were expressed as box plot,including median,first quartile,third quartile,minimum and maximum. n=12 in HI group;n=16 in AA group.图2 AA患者外周血CD4+T细胞中免疫抑制受体的表达
HVEM 也属于肿瘤坏死因子受体超家族成员,HVEM 高水平表达于初始和活化的T 细胞。根据所结合的配体不同,HVEM 对T 细胞活化的调控起到“双面”调节作用,既可以发挥正性调控,也可以发挥负性调控。HVEM 在T 细胞上与LIGHT 结合是促进T 细胞活化,而与 CD160 和 BTLA 的结合则抑制 T 细胞活化[18]。本研究仅在VSAA 患者中观察到CD4+HVEM+T 细胞比例显著高于健康人,至于HVEM 在VSAA 患者中异常T 细胞活化中的具体作用,需要今后从其所结合的配体去探讨。
GITR 同样属于肿瘤坏死因子受体超家族成员。初始T 细胞上GITR 表达水平不高,T 细胞活化24 h后GITR 表达迅速增加。GITR 与其配体GITRL 促进T 细胞活化/分化及存活,而且还可参与介导白细胞黏附和迁移[19]。此外,GITR 在调节性T 细胞中组成性表达,调节T 细胞中GITR 与一些自身免疫性疾病有关[20]。本研究检测显示不同病情程度AA 患者CD4+GITR+T 细胞比例均显著降低,这首先说明CD4+GITR+T 细胞比例下降是所有AA 患者的一个共性变化特点。另外,结合有关AA 患者调节性T 细胞中 GITR 未见明显改变的报道[21],也说明 AA 患者CD4+GITR+T 细胞比例降低可能主要发生在其他CD4+T 细胞亚群,比如 Th1、Th2 或者 Th17 细胞亚群。鉴于这些T 细胞亚群在AA 中特点,我们下一步将主要分析Th1 细胞亚群中GITR 的特点,以期最终明确AA 患者CD4+T 细胞中GITR 在异常T 细胞活化中的作用。
AA 患者中其他共刺激信号分子,如4-1BB 和ICOS,以及免疫抑制受体CTLA4、LAG-3、TIM-3 并未发生显著变化。但是我们观察到所分析的3 个免疫抑制受体呈现升高的趋势。本研究所分析的共刺激分子和免疫抑制受体的结果间接提示AA 患者异常CD4+T 细胞活化可能与某些共刺激信号分子,如OX40、HVEM和GITR等密切相关。由于本研究所涉及样本例数不多,今后需要进一步加大样本量观察上述参与T 细胞活化调控分子在AA 患者CD4+T 细胞中的特点。同时SAA 和VSAA 患者中CD4+OX40+T 细胞比例升高,以及HVEM 在VSAA 患者中的特点也说明不同病情程度AA 患者中共刺激分子存在差异变化特点,通过对T 细胞活化第二信号分子的分析,明晰不同病情程度AA 患者的特征性改变,为今后临床AA 免疫抑制治疗疗效评估也提供了一些参考资料。另外,我们将跟踪分析经免疫抑制治疗后AA 患者共刺激分子和免疫抑制受体的变化,也为免疫抑制治疗后AA 患者上述信号分子的变化特点积累基础资料。总之,本研究首次报道了AA 患者CD4+T 细胞中参与调控T 细胞活化的多个第二信号分子的情况(总结示意图见图3),为今后更为全面了解AA 中CD4+T 细胞异常免疫状态提供了新的基础研究资料。

Figure 3.The schematic diagram of expression of co-stimulatory molecules and immune inhibitory receptors in CD4+ T cells from AA patients.图3 AA患者CD4+T细胞共刺激分子和免疫抑制受体表达情况示意图
