鲜牛乳生产中耐甲氧西林金黄色葡萄球菌的耐药性与散播
2020-08-03段晋伟白燕雨刘家祺高晓莎张慧琴韩郭皓霍乃蕊古少鹏
段晋伟 , 白燕雨 , 刘家祺 , 高晓莎 , 张慧琴 , 韩郭皓 , 霍乃蕊 , 古少鹏
(山西农业大学动物科技学院 , 山西 太谷 030801)
金黄色葡萄球菌(Staphylococcusaureus,S.aureus)是威胁人和动物健康的主要病原菌之一,可通过多种媒介进行传播,极易感染,致病性极强,也是引起奶牛等反刍动物乳腺炎的主要病原[1-2]。随着养殖业趋于规模化发展和抗菌药物的过度使用,使牛场中S.aureus的耐药菌数不断增加,尤其是耐甲氧西林金黄色葡萄球菌(MRSA)的大量出现,给奶牛疾病的防治带来极大困难[3]。研究表明,S.aureus可形成微生物气溶胶广泛散布于奶牛养殖场内外环境中,进而污染鲜乳及乳制品[4-5];蒋奇君等[6]研究显示,牛乳和环境中S.aureus的耐药性严重;王登峰等[7]测定结果显示,牛乳中MRSA分离率较高且多重耐药性较严重,且牛乳中MRSA的一部分源于环境,很难从牛群中根除。有关MRSA的报道很多,但在鲜乳生产各环节的分布、耐药情况和它们的亲缘关系尚未见报道。本试验从山西部分奶牛养殖场的内外环境、挤奶间环境及乳等各个生产环节中分离鉴定S.aureus,与MRSA及耐药性分析,通过mecA基因的高通量测序和ERIC-PCR分析技术,研究鲜牛乳生产中MRSA的亲缘关系,以期为预防和控制MRSA的散播和该菌引起的食源性疾病提供科学依据。
1 材料与方法
1.1 奶牛场基本情况 采集地为山西晋中某奶牛养殖合作社,其中有8个奶牛场,每场约100头奶牛,共用1个挤奶间。
1.2 质控菌株 金黄色葡萄球菌(ATCC25923),购自南京便诊公司;白色葡萄球菌(26101-19),山西省职工医学院惠赠;耐甲氧西林金黄色葡萄球菌(ATCC43300),购自上海沪峥生物科技公司。
1.3 主要试剂与仪器 头孢西丁、苯唑西林、青霉素G、庆大霉素、链霉素、头孢噻肟、红霉素、四环素、多西环素、环丙沙星、万古霉素、氯霉素、甲氧吡啶/磺胺甲恶唑、呋喃妥因、克林霉素、利福平共16种药敏纸片,均购自杭州微生物试剂有限公司;所有引物由北京擎科生物公司合成;PCR扩增仪(Bio-RAD)。
1.3 方法
1.3.1 样本采集及培养 棉拭子样本:用PBS浸润的无菌棉棒采集牛鼻腔、牛肛门、牛乳头、围栏、挤奶器,在无菌操作下将棉拭子样本直接涂布于5%绵羊血琼脂平板,37 ℃恒温培养18~24 h。
空气样本:使用自然沉降法采集牛舍、牛运动场、挤奶间、居民区,采样基质为5%绵羊血琼脂平板,采样随机各选取3个点,采样时间为20 min。
牛乳样本:选择采集牛体样本对应奶牛,采集前3把乳,在无菌操作下将乳在7.5%氯化钠营养肉汤中选择性增菌,用无菌棉棒蘸取培养液均匀涂布于5%绵羊血琼脂平板。
粪便、饲料样本:用无菌勺随机采取奶牛运动场混合粪便和饲料槽中饲料,在无菌操作下将饲料和粪便碾碎后置于生理盐水中震荡摇匀,用无菌棉棒蘸取震荡液均匀涂布于5%绵羊血琼脂平板。
1.3.2S.aureus的分离纯化 挑取血平板上与S.aureus菌落形态相符的疑似菌株进行革兰染色,将革兰阳性球菌接种于BP培养基进行选择纯化培养,挑取黑色周围有灰白色圈的单菌落于营养肉汤中增菌培养[8]。
1.3.3 DNA的提取和PCR鉴定 采用SDS法提取细菌组DNA,测定DNA浓度,根据S.aureus16S rRNA基因设计特异性引物。引物序列[9]为:P1:5′-GCGGTCGCCTCCTAAAAG-3′;P2:5′-TCCCGGTCCTCTCGTACTA-3′,经PCR扩增、电泳拍照并分析结果。
1.3.4 MRSA的鉴定 参照美国临床与实验室标准化研究所(CLSI)标准,用苯唑西林和头孢西丁药敏纸片对S.aureus进行MRSA表型鉴定,金黄色葡萄球菌(ATCC25923)为质控菌。
按文献[10]设计检测耐药菌株mecA基因的引物,耐甲氧西林金黄色葡萄球菌(ATCC43300)作为阳性对照菌株,金黄色葡萄球菌(ATCC25923)作为阴性对照。引物序列为:M1:5′-GTAGAAATGACTGAACGTCCGATAA-3′;M2:5′-CCAATTCCACATTGTT TCGGTCTAA-3′,进行PCR扩增、电泳及拍照分析。
1.3.5 MRSA药物敏感性检测 按照国标SN/T1944-2016进行。
1.3.6mecA基因亲缘性分析 将MRSA按不同来源进行分组,通过SPSS 19.0软件随机抽取20个样本,其中包括牛乳5株、居民区空气1株、挤奶间2株(挤奶间空气1株、挤奶器1株)、牛场12株(牛体8株:牛鼻腔3株、牛乳头3株、牛肛门2株;牛场环境4株:围栏1株、牛运动场1株、饲料1株、粪便1株)。将抽取样本的mecA基因扩增产物进行高通量测序。将测序结果与GenBank中mecA基因序列进行比对,用DNAMAN软件对测序序列进行同源性比对。
1.3.7 ERIC-PCR指纹图谱分析 按文献[11]设计引物,对MRSA进行ERIC-PCR同源性分析。引物序列为:ERIC-1:5′-ATGTAAGCTCCTGGGGATTCAC-3′;ERIC-2:5′-AAGTAAGTGACTGGGGTGAGCG-3′,经PCR扩增、电泳拍照,使用UPGAMA和NTSYS-pc2.10软件对分离株的指纹图谱进行聚类分析,建立遗传进化树。
2 结果
2.1S.aureus的分离鉴定 各环节样本经分离、鉴定、染色镜检及16S rRNA 序列扩增,721份样本中有184份检测出S.aureu,共得到184株S.aureu。其中,检出牛乳73株(123份)、牛乳头17株(68份)、牛鼻腔9株(75份)、牛肛门21株(100份)、围栏19株(107份)、挤奶器8株(41份)、牛运动场6株(46份)、牛舍6株(35份)、挤奶间空气5株(17份)、居民区空气7株(22份)、粪便3株(30份)、饲料10株(30份)。
2.2 MRSA的鉴定 参照美国CLSI标准[10]进行MRSA表型鉴定,共鉴定出94株表型耐药,通过对mecA基因检测,检测出90株MRSA,见表1。
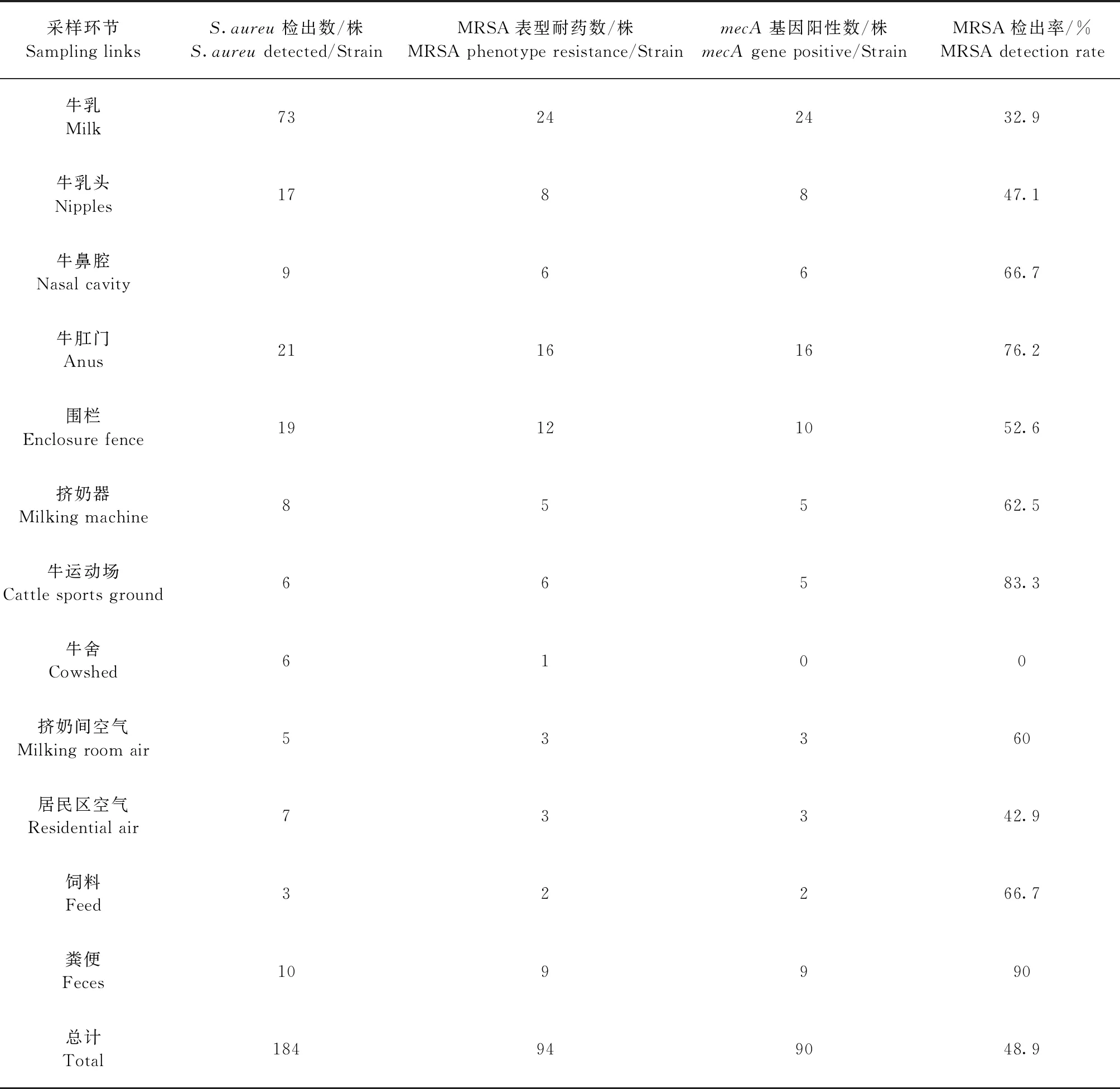
表1 MRSA表型鉴定和mecA基因检测结果
2.3 MRSA药敏试验 MRSA分离株对青霉素G、利福平、克林霉素、呋喃妥因、红霉素的耐药率较高,耐药率分别为95.6%、89%、86.8%、84.6%、80.2%,其次是四环素72.5%、多西环素67%、复合磺胺44%、链霉素17.6%、头孢噻肟6.6%、庆大霉素4.4%、氯霉素4.4%、环丙沙星2.2%,未检出万古霉素耐药菌株,见表2。对90株MRSA进行多重耐药性分析,多重耐药率为98.9%(89/90),多重耐药数主要集中在6~8耐,见图1。
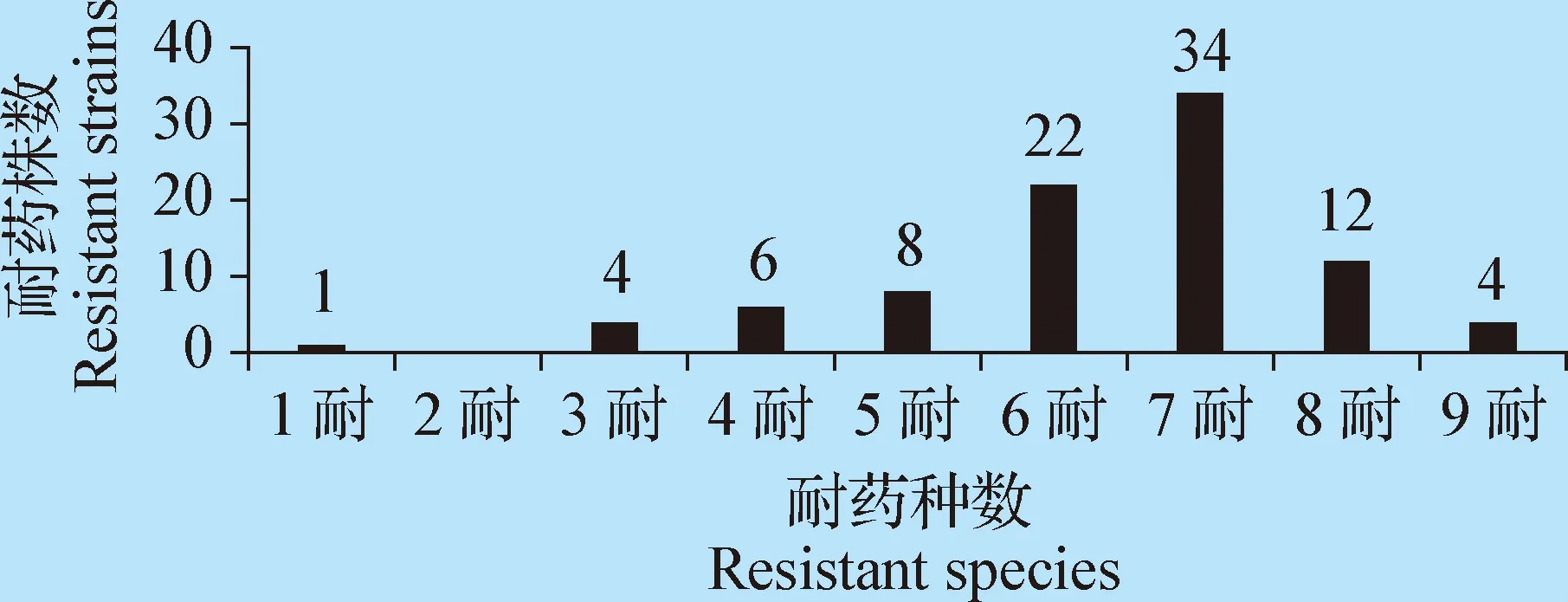
图1 MRSA多重耐药结果

表2 MRSA药敏结果
2.4mecA基因序列分析 测序结果与GenBank中mecA基因进行比对,序列相似性为96.44%~99.64%,表明检测基因均为mecA基因。测序序列同源性比对结果显示,检测mecA基因序列相似性在95.22%以上。同源进化树显示,mecA基因按同源性在99%以上可分为5大分支,其中牛体MRSA的mecA基因与牛场空气、围栏、饲料、粪便的同源性在99%以上;居民区空气中MRSA的mecA基因与围栏、乳头同源性为99%;R1与RT4、R20与NB7、R5与JNQ3mecA基因同源性在99%以上,见图2。
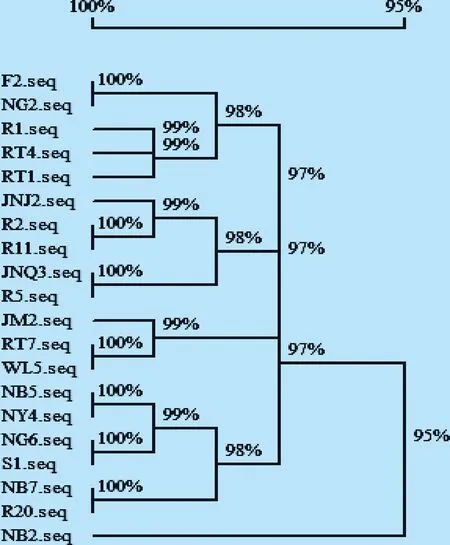
图2 mecA基因序列分析
2.5 ERIC-PCR指纹图谱分析 ERIC-PCR扩增获得指纹图谱建立遗传进化树,以相似性65%为界,可分为4大分支,相似性≥90%可认为来源相同,其中乳分离株与牛场(15株)、挤奶间(3株)、居民区(1株)的同源性在90%以上;粪便分离株与牛鼻腔(2株)同源性在90%以上;饲料分离株与牛体(4株)、牛运动场空气(1株)、乳及挤奶间(4株)的同源性在90%以上;挤奶间空气6株分离株与牛鼻腔、肛门的同源性在90%以上,见图3。

图3 亲缘关系树状图
3 讨论
本试验样本中S.aureus的检出率为25.5%(184/721),其中乳样本中S.aureus的检出率为42.9%(73/170),检出率较高,但低于王登峰[7]在山西部分地区乳中S.aureus的检出率,这与养殖场S.aureus的污染程度有关,本试验在生鲜乳生产各环节中和临近居民区空气均检出大量S.aureus,因此要加强鲜乳生产中各环节的检测和消毒。
表型耐药的S.aureus,mecA基因检出率为96.8%,与王登峰[7]结果相似。Nadarajah J等[12]研究指出,表型耐药但未携带mecA基因的原因可能是条件诱导、质粒介导或转氨肽结构域改变等因素造成S.aureus菌株β-内酰胺酶表达过量。
鲜乳生产各环节中MRSA对青霉素G、利福平、克林霉素、呋喃妥因、红霉素的耐药率较高,这与牛场的临床用药基本相符,MRSA多重耐药性严重且耐药谱与王登峰[7]对山西地区MRSA的耐药监测一致,表明MRSA分离株可能为山西地区牛源流行株。挤奶间MRSA的耐药谱与牛场MRSA基本一致,表明牛场MRSA可能通过牛体、牛场空气向挤奶环境散播。
mecA基因同源性比对显示序列相似性在95.22%以上,但不同序列产生不同程度的碱基位点缺失和突变,这可能与抗生素的过度使用有关。同源进化树结果分析显示,牛体MRSA的mecA基因与牛场环境的同源性在99%以上,表明牛体MRSA与牛场环境存在相互散播的可能;居民区空气中MRSA的mecA基因与围栏、乳头同源性为99%,提示牛场中的MRSA可能向外周环境中散播;乳中MRSA的mecA基因与乳头、鼻腔和挤奶器同源性在99%以上,表明乳中MRSA可能来源于乳头、鼻腔和挤奶器。
ERIC-PCR同源性结果分析显示,乳中MRSA与牛场、挤奶间及居民区的同源性在90%以上,表明鲜乳生产各环节中MRSA均可相互散播污染生鲜乳;粪便中MRSA与牛鼻腔的同源性在90%以上,提示MRSA可能形成微生物气溶胶经呼吸道感染牛;饲料中MRSA与牛体、牛运动场空气、乳及挤奶间的同源性在90%以上,表明在采食过程中牛可通过与饲料接触,污染饲料,饲料中MRSA形成微生物气溶胶散播于牛场空气,污染牛体进而污染挤奶间;挤奶间空气中MRSA与牛鼻腔、肛门的同源性在90%以上,提示牛可能通过呼吸和排泄形成微生物气溶胶污染挤奶间。
