A群牛轮状病毒胶体金免疫层析快速诊断方法的建立与初步应用
2020-08-03崔晓辰于志海胡士林
曹 雷 , 崔晓辰 , 于志海 , 胡士林
(1.山东畜牧兽医职业学院 , 山东 潍坊 261061 ; 2.潍坊科瑞斯生物科技有限公司 , 山东 潍坊 261061)
A群牛轮状病毒腹泻是由A群牛轮状病毒(BRV)引起的,主要以仔牛厌食、呕吐、腹泻、脱水和酸碱平衡紊乱为特征症状的疾病,给畜牧业带来严重危害,消灭和控制该病已成为世界各国共同关注的课题。
胶体金免疫层析技术(GICA)是一种将胶体金标记技术、免疫检测技术和层析分析技术等多种方法有机结合在一起的固相标记免疫检测技术,目前用于检测BRV抗原的研究在国内尚未见报道。本试验在制备轮状病毒单克隆抗体的基础上,用胶体金标记单克隆抗体,制备了A群牛轮状病毒免疫胶体金抗原检测试纸条,并初步进行应用。现将结果报告如下。
1 材料与方法
1.1 病毒、细胞及实验动物 A群牛轮状病毒、SP2/0骨髓瘤细胞均为本实验室保存。
1.2 主要试剂 氯金酸;HT、HAT、PEG-1 500及羊抗鼠IgG二抗;硝酸纤维素膜、吸水纸和玻璃纤维。A群牛轮状病毒(BRV)标准阳性血清为本实验室保存。
1.3 免疫用抗原制备 将BRV病毒OSU接种的MA-104细胞培养物反复冻融3次后,以8 000 r/min(4 ℃)离心30 min,而后取上清32 000 r/min超速离心2.5 h,弃上清,用PBS缓冲液浸泡沉淀,4 ℃过夜,期间反复吹打使其完全溶解。次日经不连续蔗糖密度梯度离心(32 000 r/min离心2.5 h)弃上清,吸取各层悬液以PBS缓冲液悬浮,32 000 r/min超速离心3 h脱糖,弃上清,用PBS缓冲液溶解沉淀。电镜观察鉴定,紫外分光光度计测定蛋白含量,作为免疫原,分装,-20 ℃保存备用。
1.4 小鼠免疫 将纯化的BRV抗原加入等量的弗氏完全佐剂,用注射器充分乳化,腹腔注射6~8周龄的BALB/c 小鼠,每次免疫剂量约0.1 mL/只,第14、28天用弗氏不完全佐剂充分乳化的抗原进行第2次、第3次免疫,剂量同第1次。10 d后断尾采血,间接ELISA法测其抗体效价并建立检测方法。取抗体水平达到1 ∶10 000以上的小鼠用BRV抗原进行腹腔及尾静脉加强免疫,3 d后取其脾细胞进行融合。
1.5 单克隆抗体的制备 采用常规方法进行细胞融合,有限稀释法克隆3次,间接ELISA法筛选阳性克隆,参照文献[1-2]进行。
1.6 标准阳性血清的纯化 由本实验室保存的BRV标准阳性血清采用饱和硫酸铵沉淀-透析法纯化,间接ELISA法检测抗体效价。
1.7 胶体金的制备 参照文献[3-4],氯金酸1 g装,加三蒸水(电导率0.3 US/cm)定容至100 mL,室温下溶解0.22 μm膜过滤,置4 ℃备用。取1% 氯金酸溶液1 mL,三蒸水稀释至100 mL煮沸2 min后,在剧烈搅拌下,快速加入2 mL新配的1%柠檬酸钠溶液(37 ℃ 预温),溶液由无色-蓝色-浅蓝色-紫色,当氯金酸变为深红色后继续煮沸6~8 min,至适宜浓度(OD525 nm值0.9312)或用蒸馏水调节OD值,冷却后加入三蒸水恢复到原体积,用0.2 mol/L碳酸钾调pH值至7.2~7.5(中性)。用0.22 μm 滤膜无菌注射器压滤后置4 ℃保存。
1.8 金标单抗的制备 将待标记BRV单抗倍比稀释,分别取100 μL加入到1 mL胶体金中,10 min后加入10%NaCl 100 μL,4 ℃静止1 h。对照管(未加蛋白质)和加入蛋白质的量不足以稳定胶体金的各管,均呈现出由红变蓝的聚沉现象;而加入蛋白量达到或超过最低稳定量的各管仍保持红色不变。以稳定1 mL胶体金溶液红色不变的最低蛋白质用量,即为该标记蛋白质的最低用量,在实际工作中,可适当增加10%~30%即为稳定1 mL胶体金所需蛋白质实际用量。同法对金标单抗最适pH值进行测定。取一定量胶体金溶液用0.2 mol/L K2CO3调最佳pH值,按最佳标记量加入BRV单抗,室温作用30 min,加入Tris-Cl(pH值8.0,20 mmol/L)配制的BSA使终浓度为1%,4 ℃静止2 h后使用[5]。
1.9 金标单抗的纯化 将金标抗体复合物以1 200 r/min离心30 min,弃沉淀将上清转移到另一离心管中(切忌倾倒),12 000 r/min离心30 min弃上清,沉淀用1%BSA(Tris-HCI pH值8.0, 20 mmol/L配制)洗2遍,用1%BSA溶解沉淀并浓缩为原体积1/10(即5 mL),0.5 mg/mL叠氮钠防腐,用0.45 nm滤膜过滤,4 ℃冰箱保存。
1.10 胶体金试纸条的制备 金标单抗做一定倍数稀释后,应用XYZ-3000三维喷点仪中的Airjet喷制金标垫。纯化的标准阳性血清用于检测线(T)的显示,羊抗鼠IgG二抗用于质控线(C)的显示。NC膜放于XYZ-3000三维喷点仪平台上,标准阳性血清稀释后放于样品池B,羊抗鼠IgG二抗稀释后放于样品池C。开机后用Biojet1和B、C样品池中的样品分别点射于膜上形成2条线,置室温自然干燥。将金标垫、NC膜、样品垫及吸水滤纸按照图1平贴于PVC支持板上,切成0.4 cm×10 cm的试纸条,加干燥剂密封保存。
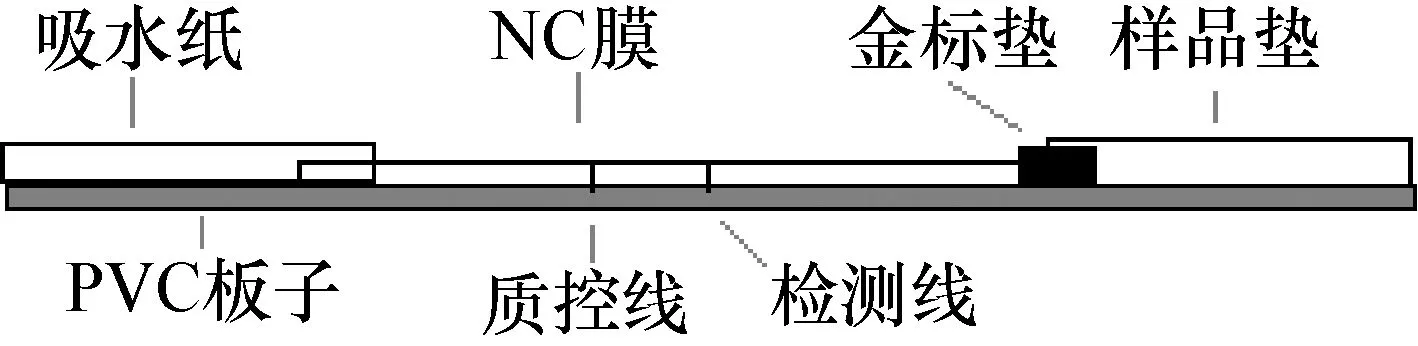
图1 胶体金免疫层析示意图
1.11 判定标准 取待检样品100 μL滴加在样品垫上,10 min内观察结果。如果在检测线(T)和质控线(C)上出现2条红线,表示为阳性结果;如果只在对照线(C)上出现1条红线,表示阴性结果;若没有红线出现表示该试验失败,需重新检测。
1.12 敏感性检验 将纯化的牛轮状病毒10倍梯度稀释到最低浓度为每毫升几十纳克,以此为样品各取100 μL检测,得出所能检出的最低病毒量。同时用韩国进口的BRV抗原快速检测试剂盒对样品进行同步检测,与本试验制备的试纸条敏感性进行比较。
1.13 特异性检验 分别取牛轮状病毒、冠状病毒等抗原进行检测,观察结果。
1.14 现地试验 对上海、广州、内蒙古、辽宁、河南等地牛场送检的37份粪便病料进行处理,用试纸条检测。同时用常规RT-PCR方法和BRV抗原快速检测试剂盒检测,比较三者检测结果。
2 结果
2.1 细胞融合与克隆 用50%PEG-1 500做融合剂,采用传统方法将免疫BRV小鼠脾细胞和处于对数生长期的SP/0骨髓瘤细胞进行融合。融合后第3天,可见单个杂交瘤细胞分裂5~7个不等的细胞集落;第10天杂交瘤细胞集落占培养孔的50%。细胞融合率可达100%,用建立的间接ELISA法共检出阳性克隆20株,阳性率为20%。对阳性孔进行扩大培养和亚克隆,最终获得5株能够稳定分泌抗BRV单克隆抗体的杂交瘤细胞系,分别命名为1D5,1B5,1G9,1C7和3C10。
2.2 BRV单克隆抗体的鉴定 间接ELISA检测其细胞培养上清效价分别为1 ∶40,1 ∶40,1 ∶320,1 ∶160和1 ∶160,腹水效价分别为1 ∶800,1 ∶3 200,1 ∶12 800,1 ∶6 400和1 ∶3 200。亚型鉴定结果显示,1D5,1B5和1C7为IgM型,1G9和3C10为IgG2b型,其轻链均为κ链(见封二彩版图3)。Western Blot试验表明,1D5,1G9和1C7能够与BRV VP6蛋白发生特异性反应,1B5和3C10能够特异的与BRV VP7发生反应(见封二彩版图2)。我们选择效价较高的1G9单克隆细胞株大量制备腹水,并用饱和硫酸铵沉淀-透析法进行纯化,最终获得单抗蛋白量为6.345 mg/mL。
2.3 胶体金标记抗体最适稳定量的测定 根据待标记抗体蛋白的要求,将胶体金调pH值9.0左右,分装11管,每管1 mL。将抗体以0.005 mol/L NaCl做系列稀释,另设2管对照(表1)。试验观察结果:待标抗体96倍稀释时达到最低稳定量,此时抗体蛋白浓度为66.1 μg/mL,即金标抗体最适稳定量为8.57 μg/mL胶体金。将未标记的胶体金颗粒与标记后的金颗粒进行光度扫描,未标记的胶体金颗粒最大吸光值在525 nm,而标记后的最大吸光值在530 nm,最大吸光值增大了5 nm,说明胶体金颗粒表面成功附着了蛋白,成功标记。
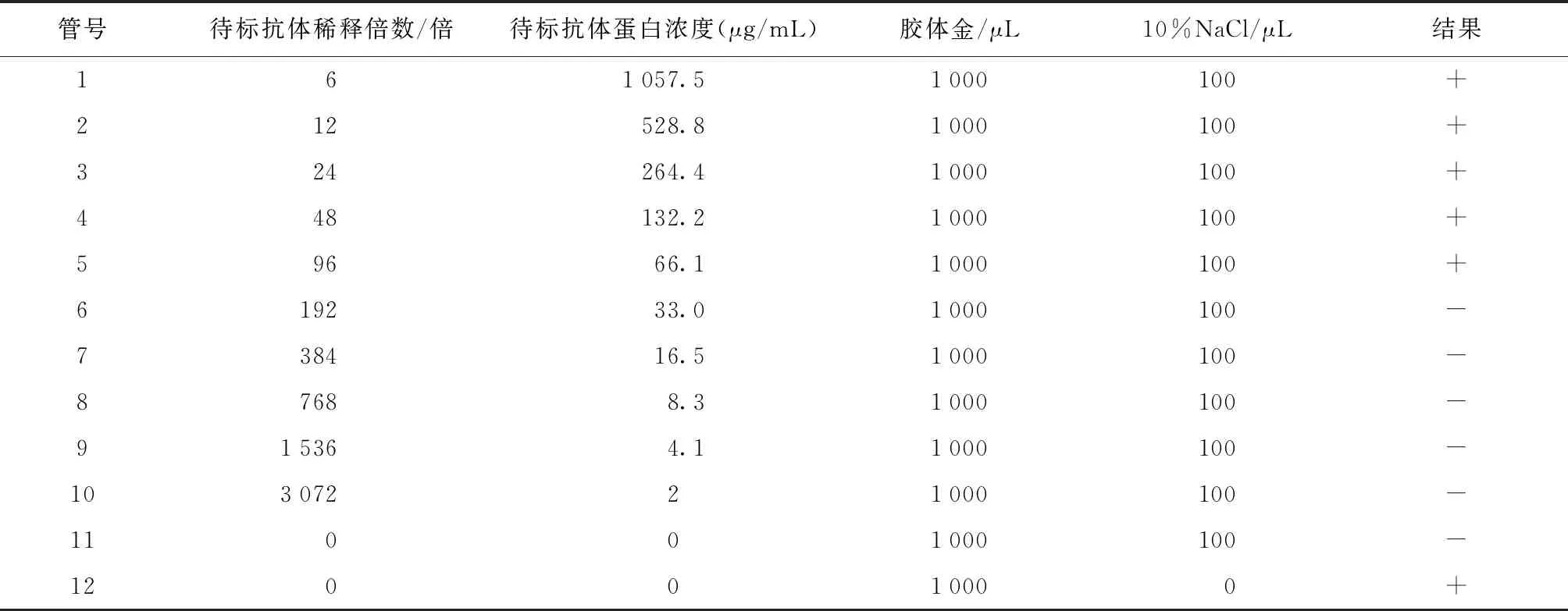
表1 胶体金标记抗体最适稳定量的测定
2.4 胶体金标记抗体最适pH值的测定 取胶体金溶液100 μL,以0.2 mol/L K2CO3将pH值调为10、9.6、9.3、9.0、8.6、8.3、8.0,另设一管对照(表2)。根据已测定金标抗体最适稳定量调节待标抗体浓度,各取10 μL加到上述胶体金溶液中混匀。5 min后,在上述各管中除对照管各加入10 μL 10%NaCl溶液,混匀后静置2 h,观察结果,保持红色的最低pH值为9.0。
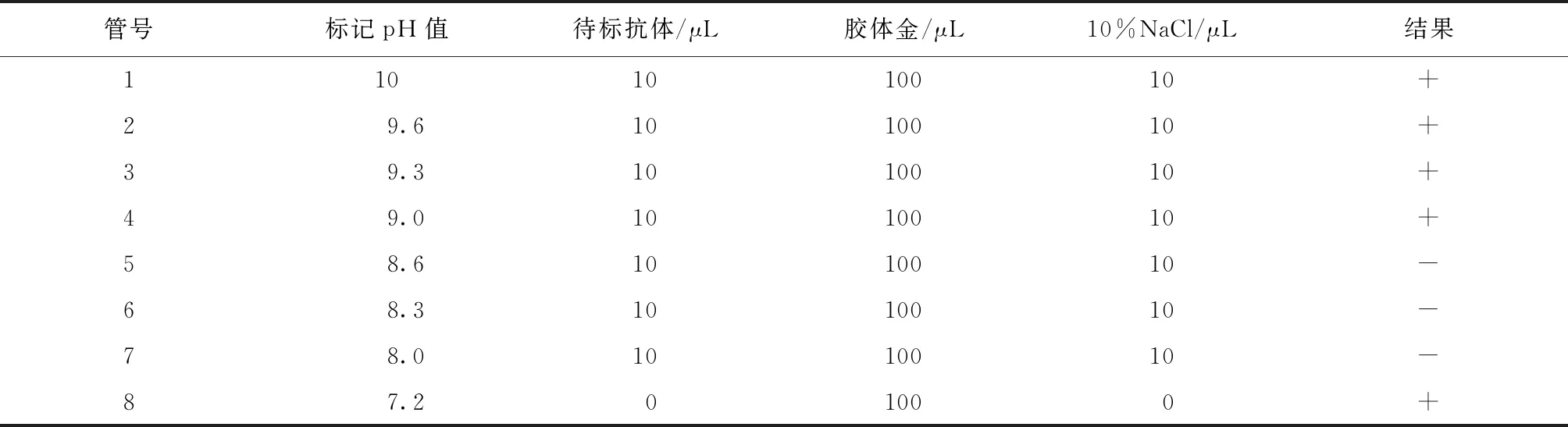
表2 胶体金标记抗体最适pH值的测定
2.5 硝酸纤维膜封闭液的选择及浓度确定 以BSA、脱脂乳2种溶液为备选材料,依据金标复合物通过硝酸纤维膜时间和反应后背景颜色为标准,时间短且背景浅为最佳(表3)。本试验选择3% BSA为封闭液。

表3 硝酸纤维素膜封闭液的选择及浓度确定
2.6 高免阳性血清及羊抗鼠IgG二抗包被浓度确定 用pH值8.0, 20 mmol/L的Tris -HCl缓冲液稀释A群牛轮状病毒标准阳性血清,以10 μg/mL的间隔,50 μg/mL到100 μg/mL,印迹于硝酸纤维素膜上(检测点),以0.8 mg/mL的羊抗鼠IgG抗体印迹于硝酸纤维素膜上(质控点),制作成试纸条,对不同稀释浓度的A群牛轮状病毒做方阵试验,确定A群牛轮状病毒标准阳性血清的最适印迹量为62.5 μg/mL(表2)。同时,用最适浓度的A群牛轮状病毒标准阳性血清印迹于硝酸纤维素膜上作为检测点,以同样方法确定羊抗兔IgG抗体的最适印迹量,结果同表4相近,约为80 μg/mL。
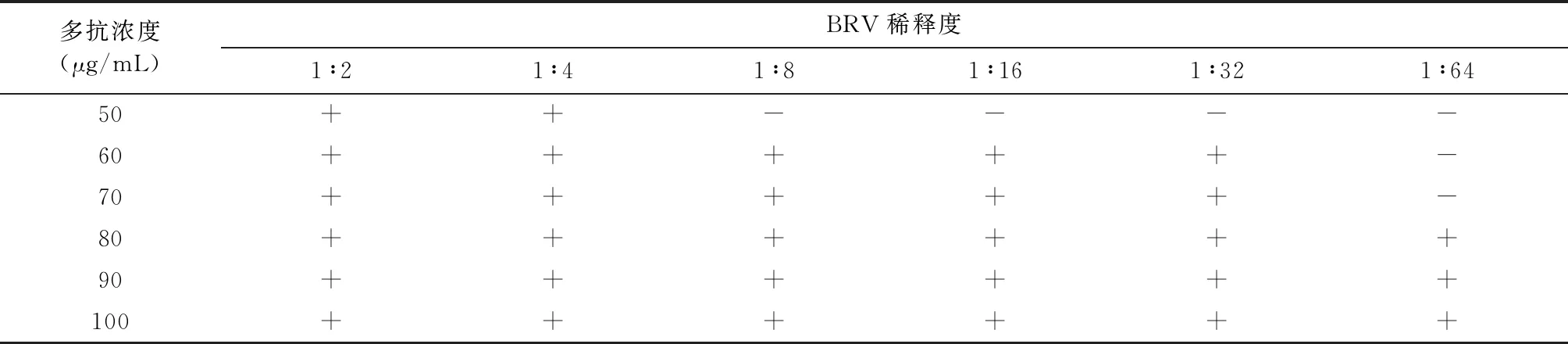
表4 多抗最适印记量选择
2.7 金标单抗包被浓度确定 将金标单抗溶液用Tris-Cl缓冲液按1、2、4、8倍梯度稀释,分别包被玻璃纤维膜。对不同稀释浓度的同一批A群牛轮状病毒做方阵试验,根据反应结果,确定金标单抗2倍稀释为最佳(表5)。
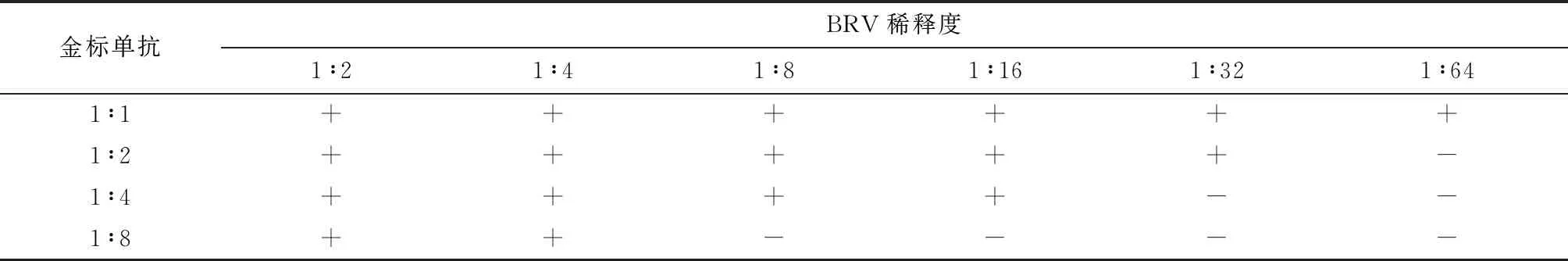
表5 不同稀释度的金标单抗与不同稀释度BRV的方阵试验
2.8 试纸条的组装及检测结果 用纯化的1G9小鼠腹水单抗制备金标单抗,组装试纸条。在样品垫上滴加约100 μL样品,10 min后观察,结果如中插彩版图4。由封二彩版图4可见,含有BRV抗原的阳性样品在试纸条检测线(T)和质控线(C)处分别出现1条红色线;未接BRV抗原的阴性样品只在试纸条质控线(C)处出现1条红线。
2.9 试纸条的敏感性及特异性试验 如表6所示,该试纸条的最低检出量约为5.341 μg/mL。与韩国进口BRV抗原快速检测试剂盒相比:抗原浓度为5.341 μg/mL样品的试剂盒检测结果比试纸条要明显些,但在抗原浓度为5.341×10-1μg/mL时检测结果均为阴性。这说明该试纸条敏感性稍差于国外进口试剂盒。用牛冠状病毒及Tris-Cl缓冲液等进行特异性试验,只有BRV样品呈现阳性,即该试纸条具有良好的特异性。

表6 试纸条敏感性试验结果
2.10 试纸条稳定性试验 该试纸条至于室温下、60 ℃温箱及4 ℃冰箱各保存20 d,再用含有BRV抗原的样品进行检测,结果无明显差异。
2.11 现地试验 对地方牛场送检的37份粪便病料进行了试纸条检测,同时与常规RT-PCR方法和BRV抗原快速检测试剂盒相比较,结果如表7,在37份待检病料中,试纸条方法检出11份为阳性,常规RT-PCR方法检出17份阳性,BRV抗原快速检测试剂盒检出12份阳性。其中,内蒙古、辽宁和河南等地牛场的7份病料病毒含量比较高,3种方法均检为阳性;而广州某牛场的13份病料中,常规RT-PCR方法检出2份为阳性,且病毒含量很低,其他二种方法未检出。这说明本试验制备的胶体金免疫层析试纸条比较可靠。
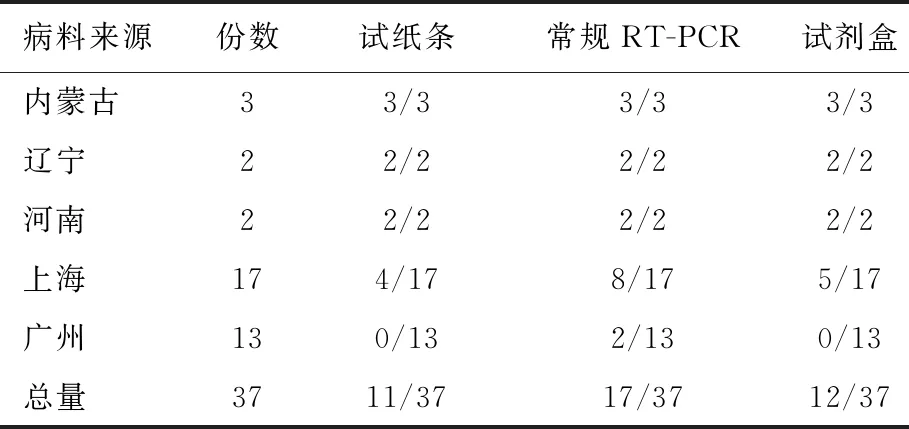
表7 现地试验结果
3 讨论
国外Engler及Putalun分别研究了检测白喉毒素等成分的免疫层析试纸条[8-9];宠物疾病免疫层析试纸条诊断方法已经得到推广[10],国内黄印尧、于相龙等人分别研制了检测牛瘟和鹅细小病毒的胶体金试纸条[11-12]。这为胶体金技术成功应用于动物疾病诊断提供了坚实基础。本试验结合单克隆抗体技术和胶体金免疫层析技术,于国内首次研制出A群牛轮状病毒胶体金免疫层析快速诊断试纸条,为提前预防和控制A群牛轮状病毒腹泻暴发提供强有力手段。该试纸条具有微量、敏感、特异、快速、简便等特点,全过程只需10 min左右,无需任何辅助设备,非常适合现地检测,为广大畜主提供了一种前所未有的诊断方法,方便了疫病检测,提高了养殖的技术水平,促进了养殖经济的发展。
目前,国内外关于轮状病毒单克隆抗体的研究已有相关报道。有报道指出,针对于G3血清型轮状病毒株VP7蛋白不同抗原决定簇的两株单克隆抗体只能对G3血清型的轮状病毒起到保护作用[6],即轮状病毒单克隆抗体不同血清型之间交叉保护性较弱;而针对于群抗原VP6蛋白的单克隆抗体对群内其他毒株的同样起到保护作用[7],即轮状病毒单克隆抗体具有群特异性。A群牛轮状病毒属于A群、G5血清型轮状病毒,是典型的轮状病毒,各牛场感染率几乎最高。本试验利用实验室现有的BRV,建立能够稳定分泌单克隆抗体的杂交瘤细胞系,为BRV胶体金快速诊断试剂盒的研制提供特异、敏感、稳定的诊断试剂。
