联合益生菌根除幽门螺杆菌对IL-8、IL-10、IL-17的调节效应
2020-08-03彭卫斌杨元生容海鹰沙卫红聂玉强黄毓舒何宏珍
彭卫斌 ,杨元生,容海鹰,沙卫红,聂玉强,黄毓舒,何宏珍
1.广州新海医院消化内科,广东 广州 510300; 2.广东省人民医院消化内科; 3.广州市第一人民医院消化内科
幽门螺杆菌(Helicobacter pylori,H.pylori)全球感染率约50%,仍有上升的趋势,被世界卫生组织列为I类致癌物,是慢性胃炎、消化性溃疡、胃癌等疾病的主要病因[1]。随着全球抗生素耐药率的上升,H.pylori的根除率持续下降,标准三联方案的根除率已低于80%[2-4],各种不同新的根除H.pylori方案也在临床中不断地被尝试。益生菌有益于人类健康,是提高H.pylori根除率的辅助疗法,具有较低的治疗相关副作用[5-6],但这种“以菌抑菌”疗法的作用机制仍未完全明确,尤其是其免疫相关机制,是目前国内外研究的重点和难点。本研究在标准三联疗法的基础上联合益生菌根除H.pylori的治疗,并观察治疗前后IL-8、IL-10、IL-17的变化,初步探讨益生菌治疗H.pylori的免疫机制。
1 资料与方法
1.1 研究对象选取2017年10月至2019年9月广州新海医院门诊或住院收治的患者116例。另选取30名健康体检者作为健康对照组。告知患者及健康体检者治疗及检测方法和目的,本研究经医院伦理委员会审核批准,所有入选者均签订知情同意书。
1.1.1 治疗组入选标准:(1)胃镜检查胃黏膜组织快速尿素酶试验(RUT)和14C尿素呼气试验(14C-UBT)均为阳性;(2)经胃镜确诊为慢性胃炎;(3)具有上腹痛、腹胀、反酸、嗳气等临床表现;(4)年龄≥18岁及≤70岁。
1.1.2 健康体检者入选标准:(1)14C尿素呼气试验(14C-UBT)为阴性;(2)来自体检中心的健康志愿者,无任何消化系症状;(3)年龄≥18岁及≤70岁。
1.1.3 排除标准:入组前4周服用过铋剂、抗生素、PPI或H2受体拮抗剂等可能影响疗效的药物;使用非甾体抗炎药和皮质类固醇;遗传性免疫缺陷患者;对本研究中使用的任何药物有禁忌证/过敏;肿瘤、消化性溃疡出血;上消化道手术;严重系统性疾病;妊娠或哺乳;不能遵守治疗方案的个体。
1.2 分组及给药方法治疗组116例入选者随机数字表编序号,按就诊顺序获得编号纳入不同治疗方案组,随机分为标准三联疗法、联合益生菌疗法,每组58例。标准三联疗法组:雷贝拉唑胶囊(珠海润都制药股份有限公司产品)10 mg,克拉霉素片(上海雅培制药有限公司产品)500 mg,阿莫西林胶囊(珠海联邦制药有限公司产品)1 000 mg,2次/d;联合益生菌疗法组:在标准三联治疗基础上加用双歧杆菌乳杆菌三联活菌片(Bifidobacterium>107 cfu/g,内蒙古双奇药业股份有限公司产品)2 000 mg,3次/d;两组患者均用药14 d。雷贝拉唑胶囊、双歧杆菌乳杆菌三联活菌片用药为餐前(与抗菌药物服用间隔时间至少2 h),阿莫西林胶囊及克拉霉素片用药为餐后。治疗组所有患者使用阿莫西林胶囊前均做青霉素皮试,青霉素皮试均阴性。另选取30名健康体检者为健康对照组。
1.3 观察指标及疗效判断标准
1.3.1H.pylori根治率:治疗结束4周后采用14C尿素呼气试验复查H.pylori,阴性认为H.pylori被根除。为了防止在参与者选择和随访中出现偏倚,H.pylori根除率计算采用意愿分析(intention-to-treat,ITT)和按方案分析(per-protocol,PP)相结合的方法进行评估。ITT分析,包括所有入选患者,随访失败患者被认为是治疗失败。PP分析,随访失败或服药依从性低的患者被剔除。
1.3.2 胃黏膜炎症评估:两治疗组胃镜下分别于胃窦、胃体取病理活检,胃黏膜慢性炎症的评分:胃黏膜病变组织用4%中性甲醛固定,常规HE染色,胃黏膜慢性炎性按慢性胃炎的诊断标准评分[7]。
1.3.3 血清IL-8、IL-10、IL-17检测:健康对照组及两治疗组均于治疗前空腹采集前臂静脉血,治疗14 d后治疗组再次空腹采集前臂静脉血,采血量均为3 ml,离心后分离出血清,然后放置在-80 ℃冰箱保存备用。采用双抗体夹心酶联免疫吸附法对患者血清IL-8、IL-10、IL-17水平进行检测。

2 结果
2.1 患者一般资料比较符合条件入选患者116例,健康对照者30名。标准三联疗法组58例,男36例,女22例,年龄(47.5±15.8)岁;联合益生菌疗法组58例,男38例,女20例,年龄(43.7±16.2)岁;健康对照组30名,男18名,女12名,年龄(41.1±16.3)岁,三组患者年龄、性别之间的差异均无统计学意义(P均>0.05)。
2.2H.pylori根除率比较116例慢性胃炎患者中有100例按方案完成治疗,完成率86.21%。14C尿素呼气试验复查,按ITT及PP分析,联合益生菌疗法组H.pylori根除率分别为84.48%(49/58)、90.74%(49/54),均大于标准三联疗法组的60.34%(35/58)、76.09%(35/46),差异有统计学意义(χ2=8.458,P=0.004;χ2=3.969,P=0.046)。
2.3 治疗前各组血清IL-8、IL-10、IL-17水平的比较两治疗组与健康对照组比较,IL-8、IL-17水平明显升高,IL-10水平下降,差异有统计学意义(P均<0.05,见表1)。
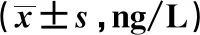
表1 治疗前各组血清IL-8、IL-10、IL-17水平的比较
2.4 两组患者治疗前后血清IL-8、IL-10、IL-17水平的比较与治疗前比较,两组患者治疗后血清IL-8、IL-17水平明显下降,IL-10水平明显升高,差异均有统计学意义(P<0.05);与标准三联疗法组比较,联合益生菌疗法组治疗后IL-8、IL-10、IL-17水平变化更明显,差异有统计学意义(P<0.05)(见表2)。
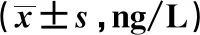
表2 两组患者治疗前后血清IL-8、IL-10、IL-17水平的比较
2.5 治疗前感染H.pylori组血浆IL-8、IL-10、IL-17的相关性分析结果显示,IL-17与IL-8呈正相关(r=0.934);IL-17与IL-10呈负相关(r=-0.864);IL-10与IL-8呈负相关(r=-0.933)(P均<0.05)(见图1~3)。

图1 IL-17与IL-8的相关性;图2 IL-17与IL-10的相关性;图3 IL-8与IL-10的相关性
2.6H.pylori感染慢性胃炎不同炎症程度血清IL-8、IL-10、IL-17的水平变化随着慢性胃炎炎症程度的逐渐加重,血清IL-8、IL-17的水平也逐渐升高,IL-10水平逐渐下降,各组间比较,差异均有统计学意义(P均<0.05)(见图4)。
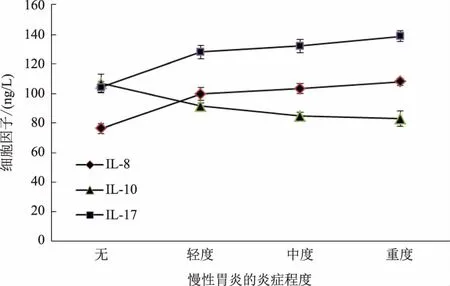
图4 慢性胃炎不同炎症程度IL-8、IL-10、IL-17的水平变化
2.7 治疗组患者H.pylori根除对血清IL-8、IL-10、IL-17水平的影响治疗后,与H.pylori阳性患者比较,两治疗组H.pylori阴性患者IL-8、IL-17水平下降明显,IL-10水平升高明显,差异有统计学意义(P均<0.05),且联合益生菌疗法组IL-8、IL-10、IL-17水平的变化更明显,差异有统计学意义(P均<0.05)(见表3)。
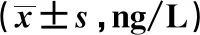
表3 两组患者H.pylori根除对血清IL-8、IL-10、IL-17水平的影响
3 讨论
近年因细菌耐药性的出现导致H.pylori根除率逐渐降低,且长期不合理应用抗生素可引起胃肠道菌群失调及胃肠功能紊乱等不良反应,益生菌恰好从这个角度解决了传统疗法存在的问题。尽管观察到了益生菌在根除H.pylori过程中的积极作用,但我们对益生菌的作用机制了解甚少,为更好及合理地运用益生菌,仍需进一步阐明益生菌在治疗H.pylori中的作用机制。目前发现益生菌治疗H.pylori的可能机制包括:加强黏膜屏障、影响H.pylori的定植、分泌抗菌及杀菌药物、调整宿主免疫反应来减少炎症因子的释放等[8],其中关于调整宿主免疫反应机制尤其复杂,在根除H.pylori治疗中起到关键作用,益生菌如何调节宿主免疫反应,从而减轻胃黏膜组织的炎症反应及促进溃疡的愈合仍未明确。
以往关于H.pylori感染后的免疫应答主要集中在经典的Th1、Th2细胞应答上。人体和动物实验均证实H.pylori感染后胃黏膜出现的免疫反应以Th1型为主,发现Th1细胞分泌的促炎细胞因子IFN-γ、IL-8、IL-12分泌增多,而Th2细胞分泌的抗炎细胞因子IL-4、IL-10很少或缺乏[9]。有研究[10]发现,益生菌能降低炎症因子IL-8水平,并促进抗炎因子IL-10的生成。H.pylori致病的免疫作用机制十分复杂,仅Th1及Th2型免疫应答并不能完全解释H.pylori感染后胃炎、溃疡及胃癌的发生。近年来研究发现,H.pylori感染时胃黏膜组织IL-17表达升高,下调Th17细胞的表达能减少胃炎、胃癌的发生[11-12],这提示Th17/IL-17免疫调节促进炎症反应以及细菌的定植可能在H.pylori感染中起到致病的作用,同时也提示H.pylori致病可能是多种免疫调节途径共同作用。Th17细胞是一种新型CD4+T细胞亚群,它不同于经典的Th1和Th2细胞,通常说IL-17是指IL-17A,IL-17是Th17细胞产生的最重要效应因子[13]。IL-17作为一种前炎性细胞因子,通过不同的作用机制,发挥不同的生物学效应。益生菌治疗H.pylori是否与Th17/IL-17介导的免疫调节有关?Th1、Th2及Th17诱导的细胞因子之间的变化是否存有一定的相关性呢?目前仍需进一步的研究。本研究在标准三联疗法的基础上联合益生菌根除H.pylori的治疗,并观察治疗前后IL-8、IL-10、IL-17的变化,尝试从新的视角来揭示益生菌治疗H.pylori的机制,为防治H.pylori寻找新靶点。
本研究发现,标准三联及联合益生菌四联疗法组IL-8、IL-17含量明显高于健康对照组,而IL-10含量低于健康对照组,即H.pylori感染后,致炎因子IL-8、IL-17明显增加,抗炎因子IL-10减少,提示H.pylori感染后,Th17与Th1细胞促炎作用被强化,而Th2细胞发挥的抗炎作用被抑制,促炎因素强于抗炎因素。其中IL-10减少无IL-8、IL-17升高明显,这可能是在感染H.pylori后机体的自我保护机制调节,在炎性因子IL-8、IL-17分泌增多的同时,抗炎因子IL-10分泌也随之适量增多,从而避免造成机体过度损伤。在治疗前感染H.pylori组血浆IL-8、IL-10、IL-17的相关性分析研究中还发现,IL-8与IL-17呈正相关,IL-10与IL-17呈负相关,说明H.pylori慢性胃炎患者IL-8、IL-10与IL-17的水平密切相关。提示Th17、Th1与Th2作用失衡,可能是引起H.pylori感染致病的重要因素。
胃黏膜的慢性炎症程度与H.pylori感染相关,一般认为H.pylori与机体免疫功能紊乱所引起的免疫损伤密切相关[14]。本研究发现,与健康对照组比较,治疗组中无论炎症轻重,均有IL-8、IL-17水平升高,IL-10水平下降,且随着炎症程度的增加,血清中细胞因子IL-8、IL-17的水平也逐渐增加,而IL-10的水平逐渐下降,这与赵东、李琳等[10,15]研究结果相似,也说明H.pylori感染后慢性胃炎的严重程度与Th17、Th1及Th2的免疫调节密切相关,根除H.pylori治疗后,慢性胃炎的恢复是否与IL-8、IL-10、IL-17水平有关仍需进一步的研究证实。
本课题小组进一步研究发现,根除H.pylori治疗后,标准三联疗法组及联合益生菌疗法组血清中IL-8、IL-17的含量减少,而IL-10的含量明显升高,且联合益生菌疗法组的IL-8、IL-17及IL-10的变化更显著,提示益生菌在促进T细胞向Th2 细胞分化方面起重要作用,能抑制IL-8、IL-17水平并下调Th1、Th17型免疫反应。此外,治疗后H.pylori根除患者IL-8、IL-17水平下降及IL-10水平升高更加明显,联合益生菌疗法组与标准三联疗法组比较,差异有统计学意义,这也反映了Th17、Th1与Th2免疫调节在H.pylori感染致病中的重要作用。在H.pylori根除率比较中,联合益生菌疗法组明显高于标准三联疗法组,结果与Wang等[16]相似,提示H.pylori根除率与IL-8、IL-10、IL-17水平变化可能存在一定的相关性,这仍需后期的大样本研究证实。
综上所述,本研究发现联合益生菌治疗H.pylori,不仅能提高H.pylori的根除率,同时还明显影响血清中细胞因子IL-8、IL-10、IL-17的变化,其机制可能是通过减少Th1/Th17细胞应答产生的IL-8、IL-17等致炎因子,并诱导Th2细胞应答产生IL-10等抗炎因子,从而减轻黏膜炎症,增强抗H.pylori的效果,但在治疗过程中Th17、Th1与Th2细胞间如何发挥协调作用,其分泌的细胞因子与H.pylori的根除率是否有关,益生菌的种类如何选择及益生菌根除H.pylori的临床疗效能否用相关细胞因子的变化来衡量等问题尚有待研究。
