lncRNA LOXL1-AS1通过靶向miR-142-5p/PIK3CA调控胃癌细胞侵袭、迁移能力
2020-08-03谭诗云
李 明, 谭诗云, 柴 红
武汉大学人民医院消化内科 消化系统疾病湖北省重点实验室,湖北 武汉 430060
胃癌是消化系统常见的恶性肿瘤,其死亡率高居肿瘤相关死亡的第三位。特别是在发展中国家,胃癌患者的数量占全球胃癌患者的70%以上[1]。早发现、早治疗是提高胃癌患者疗效及改善预后的关键。然而,由于胃癌患者可能早期无明显症状,即使有上腹胀或不适等非特异性症状,因未予重视或惧怕胃镜检查等原因,导致很大一部分胃癌患者在临床诊断时已属中晚期。尽管近年来在肿瘤诊治方面取得了巨大进步,但胃癌患者预后仍然很差,5年生存率低于20%[2]。肿瘤复发和侵袭转移是导致胃癌患者临床治疗失败和死亡的主要原因。随着生物学的迅速发展,阐明胃癌发生和发展的分子机制是实现胃癌靶向治疗的关键。
长链非编码RNA(long non-coding RNA,lncRNA)是长度超过200个核苷酸的RNA分子。其本身不具备编码蛋白的能力,但可在转录水平、转录后水平调控基因的表达和调节真核细胞的各种生理过程[3]。大量研究发现,lncRNA在肿瘤中异常表达,在肿瘤的发生和发展过程中起关键作用[4-8]。lncRNA HEIH在大肠癌组织和细胞中均表达上调,且与肿瘤大小、浸润深度、不良预后呈正相关[9]。lncRNA LUCAT1与卵巢癌转移及临床分期呈正相关,且可通过调控miR-612/HOXA13通路促进卵巢癌细胞增殖、侵袭和转移[10]。因此,进一步了解肿瘤相关lncRNA的机制,将有助于开发预后评估标志物,并为肿瘤靶向治疗提供新的思路。我们前期研究发现,lncRNA LOXL1-AS1在胃癌中的表达水平显著高于癌旁组织,且与肿瘤直径、局部淋巴结转移、远处转移、TNM分期和患者预后密切相关;胃癌细胞株(AGS、BGC823、NCI-N87、MGC803和SGC7901)中LOXL1-AS1表达均显著高于正常胃黏膜细胞株GES1。利用BGC823细胞转染LOXL1-AS1靶向 shRNA构建LOXL1-AS1敲低模型,可显著抑制胃癌细胞增殖并促进细胞凋亡。在本实验中,我们发现LOXL1-AS1靶向miR-142-5p/PIK3CA调控胃癌细胞侵袭和迁移能力。
1 材料与方法
1.1 材料胃癌细胞株(AGS、BGC823)、HEK293T细胞购自上海君瑞生物技术有限公司;胎牛血清、DMEM培养基购自美国Gibco公司;Matrigel胶购自Invitrogen公司;细胞培养瓶、Transwell小室、细胞培养皿及6孔培养板购自Corning公司;转染试剂Lipofectamine 2000购自Sigma公司;RNAiso Plus试剂盒、cDNA合成试剂盒及PCR试剂盒购自Takara(大连)有限公司;LOXL1-AS1表达载体pcDNA-LOXL1-AS1、pcDNA空载体、lncRNA LOXL1-AS1 mRNA靶向shRNA(序列5′-GTGGACAAATCATAACTGAAT-3′)和scramble shRNA(即对照组)(序列5′-GCGTGAAAGTCAACTAATTAA-3′)由上海吉凯基因化学技术有限公司设计并构建。PIK3CA、E-cadherin、N-cadherin、Vimentin、ZO-1及GAPDH抗体购自英国Abcam公司。双荧光素酶报告基因检测试剂盒、蛋白浓度测定试剂盒、HRP-羊抗兔、HRP-羊抗鼠购自湖北百奥斯生物公司。
1.2 方法
1.2.1 细胞培养:AGS、BGC823和HEK293T细胞复苏后用含质量浓度为100 g/L胎牛血清的DMEM培养液,置于37 ℃、体积分数为5% CO2饱和湿度条件的恒温箱中培养。实验均选用处于对数生长期的细胞进行。
1.2.2 LOXL1-AS1表达载体的构建:通过TRIzol法从GES-1细胞中提取总RNA,使用随机引物通过逆转录得到cDNA。根据GeneBank数据库中LOXL1-AS1的标准序列设计引物,以cDNA为模板,扩增得到LOXL1-AS1序列。通过质量浓度为10 g/L琼脂糖凝胶电泳分离扩增产物,纯化回收后,将LOXL1-AS1产物连入pGEM-T easy载体中。将上述载体引入DH5α超级感受态细胞中,通过蓝白斑筛选后,挑取白色克隆,通过通用引物T7和SP6对载体进行PCR和测序鉴定,获得LOXL1-AS1的阳性质粒。将该阳性质粒与pcDNATM3.1(-)Mammalian Expression Vector使用限制性核酸内切酶系统消化,获得目的片段。分别纯化回收后,连接线性化载体和LOXL1-AS1片段获得LOXL1-AS1过表达载体。将阳性质粒转化入DH5α超级感受态细胞中,通过通用引物T7和BGH对菌液进行PCR鉴定。之后挑克隆,双酶切鉴定,用无内毒素试剂盒大量制备质粒,提取备用。
1.2.3 细胞构建及转染:通过转染LOXL1-AS1 mRNA靶向shRNA来构建LOXL1-AS1敲低的胃癌细胞模型。通过转染LOXL1-AS1 mRNA表达载体pcDNA-LOXL1-AS1构建LOXL1-AS1上调胃癌细胞模型。前期实验发现BGC823和AGS细胞系在5种胃癌细胞系(AGS、BGC823、NCI-N87、MGC803和SGC7901)中LOXL1-AS1的表达量分别最高和最低,因此,选取BGC823细胞构建敲低细胞模型,选取AGS细胞构建过表达细胞模型。取对数生长期的细胞,接种于6孔培养板内,倒置显微镜下观察,当细胞融合度为50%左右时转染。根据制造商的说明书,使用Lipofectamine 2000将pcDNA空载体或pcDNA-LOXL1-AS1表达载体或scramble shRNA的载体或LOXL1-AS1靶向shRNA的载体转染到在6孔板中培养的胃癌细胞中,转染24 h后,收集细胞并加工用于后续实验,实验分组:pcDNA空载体转染组即Empty Vector组,pcDNA-LOXL1-AS1载体转染组即pcDNA-LOXL1-AS1组,转染scramble shRNA组即sh-NC组,转染LOXL1-AS1靶向shRNA组即sh-LOXL1-AS1组。
1.2.4 qRT-PCR实验:使用RNAiso Plus试剂提取胃癌细胞株总RNA。根据试剂盒使用说明书,使用cDNA合成试剂盒合成第一链cDNA,采用ABI Prism 7500实时荧光定量PCR仪进行实时PCR检测LOXL1-AS1表达水平,以GAPDH为内参。每20 μl反应体系内加入400 ng cDNA、10 μl TB Green series、正反链引物各0.6 μl及6.88 μl RNase-free ddH2O。qRT-PCR实验条件为95 ℃ 15 min预变性,95 ℃ 10 s、56 ℃ 20 s、72 ℃ 30 s重复40个循环。引物及探针序列如下:LOXL1-AS1引物:Forward:5′-GATATGTTGGATGATGGA-3′,Reverse:5′-GATATGTTGGATGGATGA-3′;miR-142-5p引物:Forward:5′-CAUAAAGUAGAAAGCACUACU-3′,Reverse:5′-CAUAAAGUAGAAAGCACUACU-3′;GAPDH引物Forward:5′-GAAGGTGAAGGTCGGAGTC-3′,Reverse:5′-GAAGATGGTGATGGGATTTC-3′。使用比较循环阈值(Ct)计算基因的相对表达(2-△△Ct),实验重复3次。
1.2.5 细胞侵袭、迁移实验:将胃癌细胞接种在装有Transwell小室(8 μm孔径)的24孔板中,每组设置2个复孔。胃癌细胞悬浮在无血清培养基的上室(约2×105个/孔),下室为500 μl质量浓度为100 g/L胎牛血清的DMEM培养液。培养24 h后,用棉签轻轻拭去上室表面的细胞(即未侵入下室的细胞),侵入下室的细胞采用甲醇固定,然后用结晶紫染色。在倒置显微镜下随机选取5个视野,计数侵入下室的细胞数目。侵袭实验的Transwell小室底部覆有Matrigel胶,其他步骤同迁移实验。
1.2.6 双荧光素酶报告基因实验:使用DNA寡核苷酸和pMiR-Reporter载体构建荧光素酶报告载体(pMiR-LOXL1-AS1-WT/pMiR-LOXL1-AS1-Mut)。用pMiR-LOXL1-AS1-WT或pMiR-LOXL1-AS1-Mut和miR-142-5p模拟物或阴性对照(NC miR)共转染HEK293T细胞。在转染后24 h使用双荧光素酶报告基因检测试剂盒测定荧光素酶活性。
1.2.7 Western blotting实验:收集细胞,加入200 μl预冷的含PMSF的蛋白裂解液,用移液器反复抽吸后震荡1 min,4 ℃条件下裂解30 min,4 ℃条件下12 000 r/min离心10 min,将上清液小心移至经高压消毒的EP管内,根据蛋白测定试剂盒说明书检测蛋白质浓度计算蛋白质含量;采用免疫印迹法检测蛋白质表达情况,取40 μg各组样品行SDS-PAGE电泳,再转膜至PVDF膜,5% BSA封闭1 h,根据蛋白分子量切割条带,分别加入一抗及内参β-actin抗体,室温下孵育2 h,再次TBST洗膜,ECL显色及曝光,显影、定影、拍照并分析数据。

2 结果
2.1 敲低LOXL1-AS1表达可抑制胃癌细胞侵袭、迁移能力前期我们发现,利用BGC823细胞转染LOXL1-AS1靶向shRNA构建LOXL1-AS1敲低模型,可显著抑制胃癌细胞增殖并促进细胞凋亡[11]。本实验进一步探讨敲低LOXL1-AS1对胃癌侵袭、迁移的影响,结果如图1所示,与sh-NC组细胞比较,sh-LOXL1-AS1组的BGC823细胞迁移和侵袭数目显著减少,提示敲低LOXL1-AS1表达可抑制胃癌细胞侵袭、迁移能力。
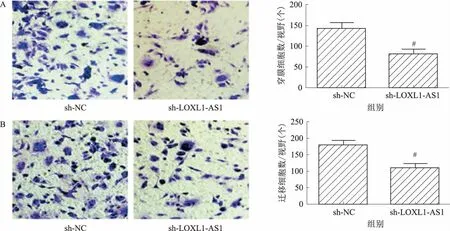
注:A:敲低LOXL1-AS1表达后BGC823细胞侵袭能力显著降低(放大200倍);B:敲低LOXL1-AS1表达后BGC823细胞迁移能力显著降低(放大200倍)。与sh-NC组比较,#P<0.05。
2.2 敲低LOXL1-AS1表达可抑制胃癌细胞上皮间质转化(EMT)Western blotting检测LOXL1-AS1 shRNA转染后对BGC823细胞EMT的重要标志物Vimentin、N-cadherin、ZO-1和E-cadherin的表达。结果显示,敲低LOXL1-AS1后,BGC823细胞ZO-1和E-cadherin表达上调,Vimentin和N-cadherin表达下调,提示敲低LOXL1-AS1表达可抑制胃癌细胞EMT(见图2)。
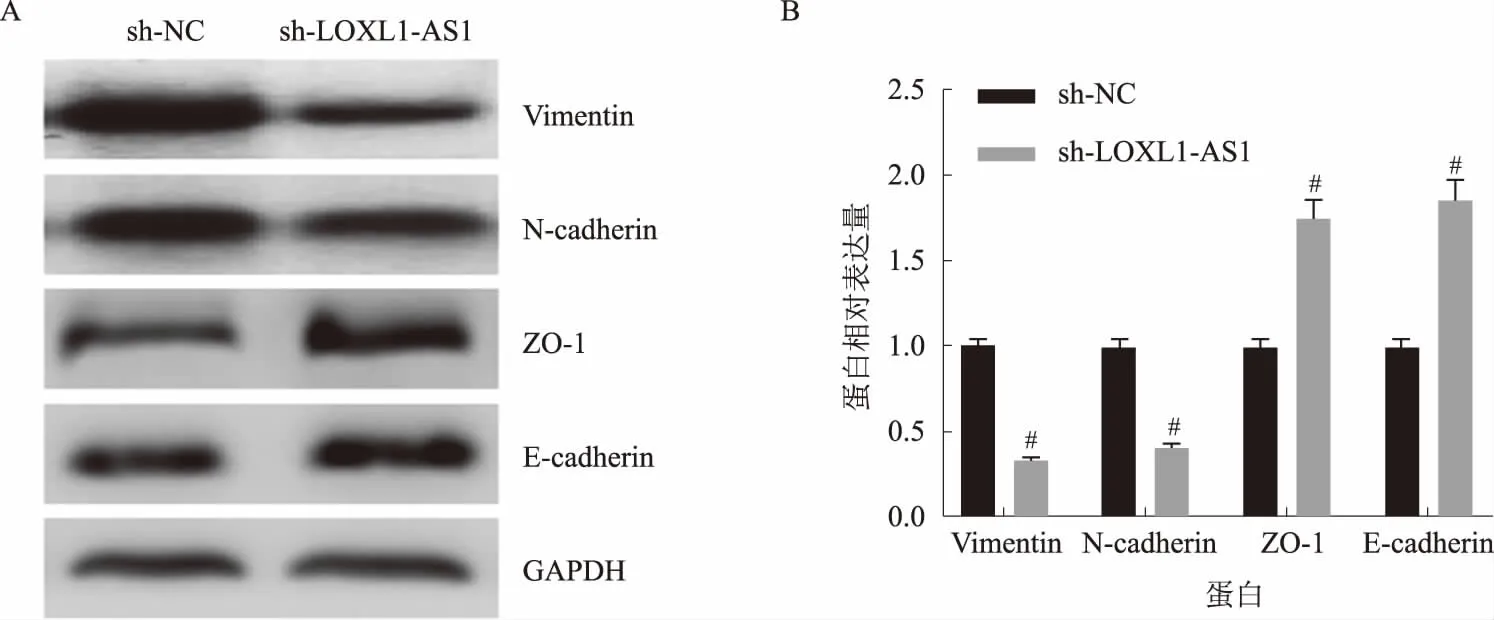
注:A:免疫印迹图;B:灰度值分析。与sh-NC组比较,#P<0.05。
2.3 LOXL1-AS1直接靶向作用于miR-142-5p为了进一步阐明LOXL1-AS1作用机制,我们通过StarBase数据库(http://www.starbase.sysu.edu.cn/)进行了生物信息学分析,数据显示miR-142-5p可能是LOXL1-AS1的作用靶点(见图3A)。为了进一步验证,我们通过qRT-PCR检测了在LOXL1-AS1过表达和低表达的胃癌细胞系中miR-142-5p的表达,结果显示,在LOXL1-AS1敲低的胃癌BGC823细胞中miR-142-5p的表达水平升高(见图3B),而在LOXL1-AS1过表达胃癌AGS细胞中miR-142-5p的表达水平降低(见图3C)。此外,双荧光素酶报告基因结果显示,miR-142-5p降低了LOXL1-AS1野生型的荧光素酶活性,但对LOXL1-AS1突变型影响不显著(见图3D)。上述结果表明LOXL1-AS1直接靶向作用于miR-142-5p。
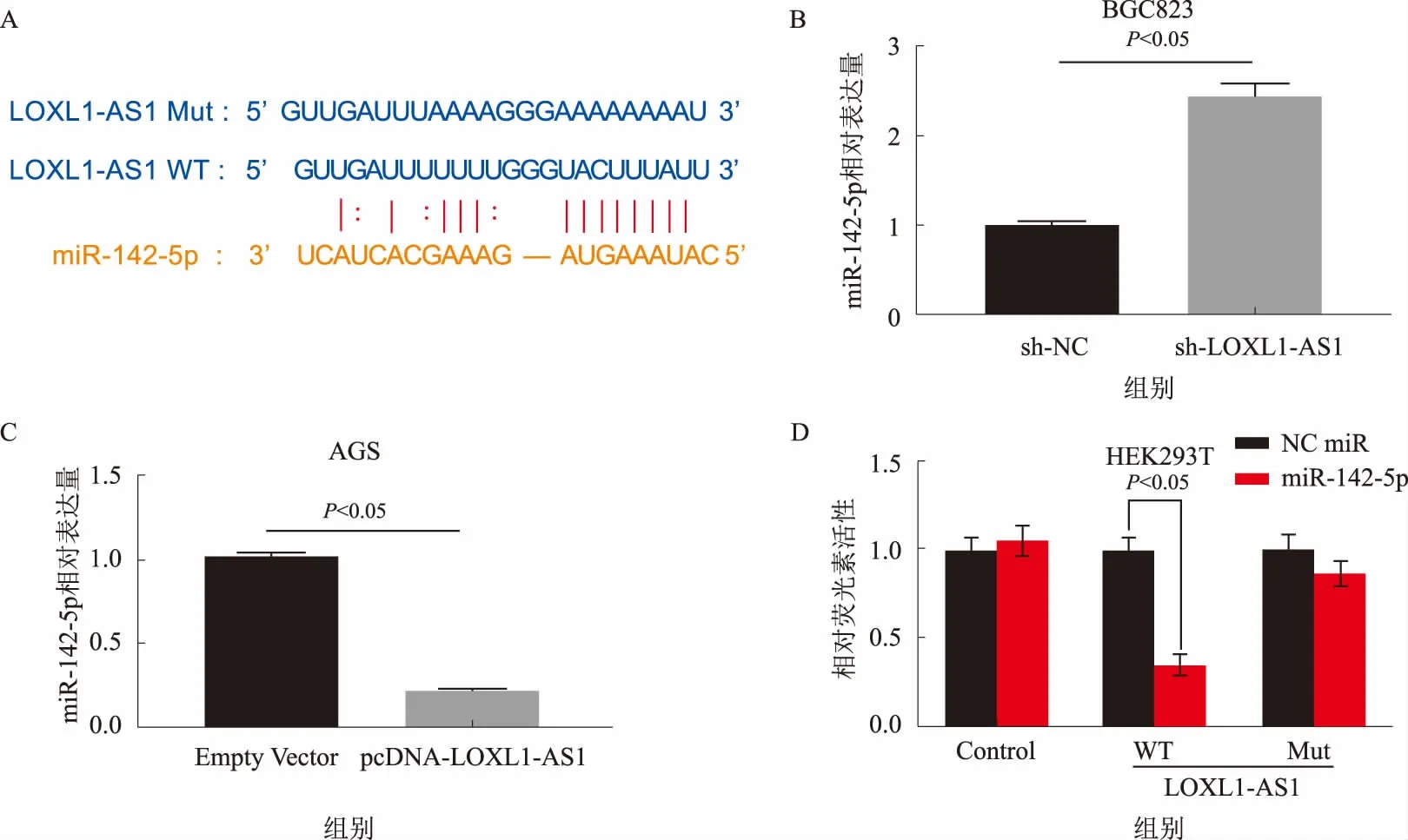
注:A:LOXL1-AS1和miR-142-5p之间潜在结合位点;B:沉默LOXL1-AS1表达促进BGC823细胞miR-142-5p表达;C:上调LOXL1-AS1表达抑制AGS细胞miR-142-5p表达;D:荧光素酶报告结果显示LOXL1-AS1与miR-142-5p存在直接靶向作用。
2.4 miR-142-5p逆转LOXL1-AS1过表达对胃癌细胞侵袭、迁移的促进作用为了探讨miR-142-5p在LOXL1-AS1促进胃癌进展中结合的重要性,我们在稳定过表达LOXL1-AS1的胃癌细胞中同时过表达miR-142-5p(见图4A~4B)。发现miR-142-5p可逆转LOXL1-AS1过表达对胃癌细胞侵袭和迁移的促进作用(见图4C~4D)。上述结果表明,LOXL1-AS1通过与miR-142-5p的竞争性结合促进胃癌细胞侵袭、迁移。
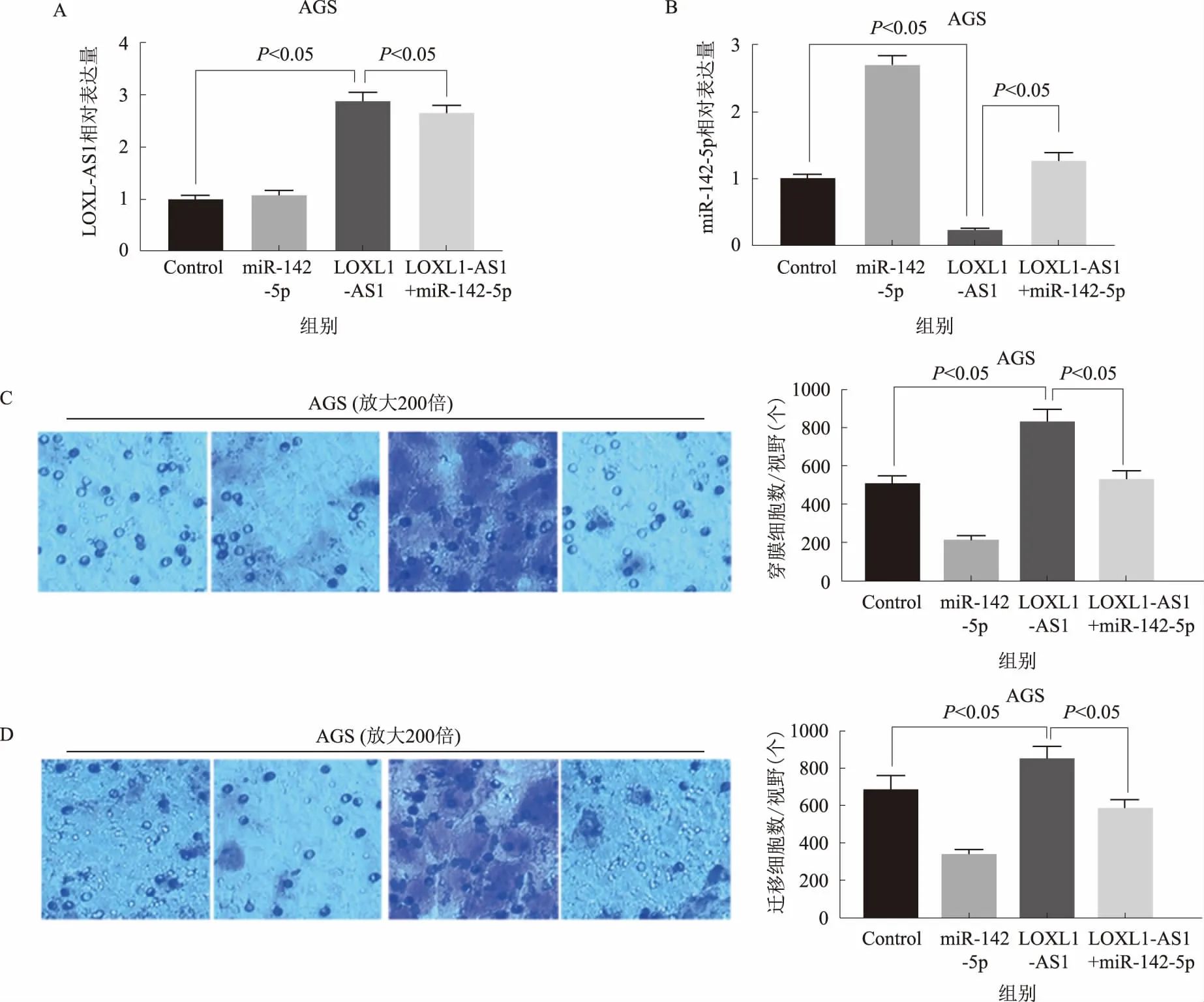
注:A:qRT-PCR检测过表达LOXL1-AS1和(或)miR-142-5p胃癌细胞LOXL1-AS1相对表达量;B:qRT-PCR检测过表达LOXL1-AS1和(或)miR-142-5p胃癌细胞miR-142-5p相对表达量;C:过表达LOXL1-AS1和(或)miR-142-5p对胃癌细胞侵袭能力的影响;D:过表达LOXL1-AS1和(或)miR-142-5p对胃癌细胞迁移能力的影响。
2.5 LOXL1-AS1对胃癌细胞PIK3CA表达的影响
既往研究[12]证实,miR-142-5p可以通过靶向下游基因PIK3CA而发挥作用,我们探究LOXL1-AS1是否可以调节PIK3CA的表达,发现过表达LOXL1-AS1可上调PIK3CA蛋白表达,过表达miR-142-5p可降低PIK3CA蛋白表达,且miR-142-5p可减弱LOXL1-AS1诱导PIK3CA上调的作用(见图5)。这些结果表明,LOXL1-AS1通过调节miR-142-5p进而调节下游PIK3CA表达。
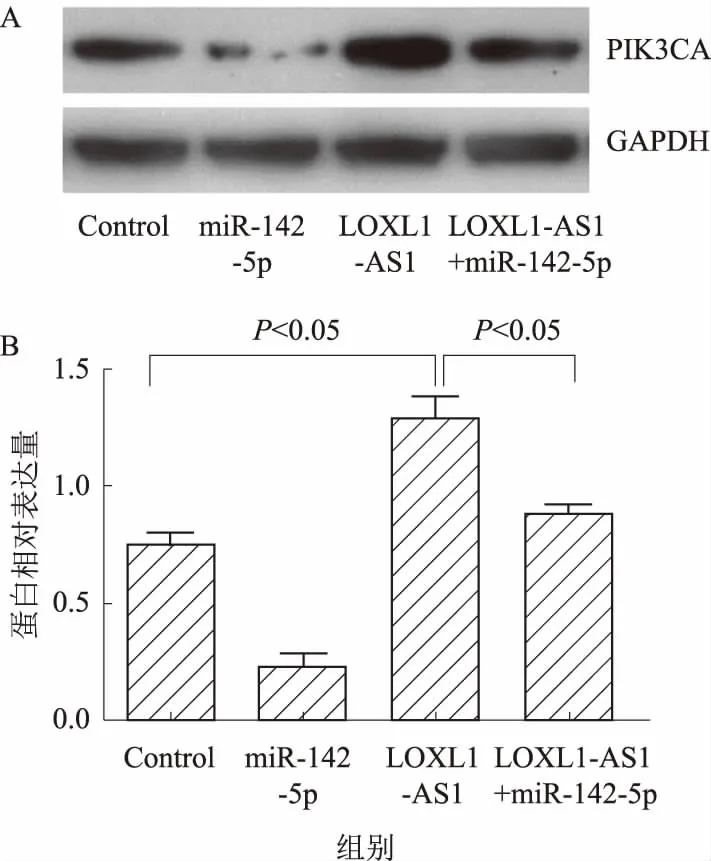
注:A:免疫印迹图;B:灰度值分析。
3 讨论
lncRNA研究已经成为肿瘤基因领域研究的热点,大量研究证实,lncRNA 的异常表达与肿瘤的发病机制、复发、侵袭、转移、耐药及预后等密切相关[13-16]。我们前期研究发现,LOXL1-AS1在胃癌中的表达水平显著高于癌旁组织,且与肿瘤直径、局部淋巴结转移、远处转移、TNM分期和患者预后密切相关;敲低LOXL1-AS1表达可显著抑制胃癌细胞增殖并促进细胞凋亡。本实验中进一步探讨了LOXL1-AS1对胃癌细胞侵袭、迁移的影响,结果显示,敲低LOXL1-AS1抑制了胃癌细胞侵袭和迁移能力,并抑制胃癌细胞EMT。
miRNA在肿瘤进展中扮演重要角色,它在肿瘤中的作用已被广泛研究。lncRNA可以直接与miRNA相互作用,并作为竞争性内源RNA(competing endogenous RNAs,ceRNA)调节miRNA的表达和活性,进而参与机体病理生理学进程。在本实验中,我们假设LOXL1-AS1可以靶向miRNA在胃癌中发挥作用,为证实这一假设,我们进行了生物信息学分析,数据显示miR-142-5p含有LOXL1-AS1的结合位点。进一步实验结果提示LOXL1-AS1负调控胃癌细胞中miR-142-5p的表达。此外,我们进行了双荧光素酶报告基因检测,以确认LOXL1-AS1可以直接与miR-142-5p结合,结果提示LOXL1-AS1可直接靶向胃癌细胞中的miR-142-5p。
磷脂酰肌醇3-激酶(phosphoinositide 3-kinases,PI3Ks)蛋白家族参与细胞增殖、凋亡、分化、侵袭、转移和葡萄糖转运等多种细胞功能的调节[17-19]。PIK3CA是编码磷脂酰肌醇-3激酶(PI3K)p110α催化亚单位的基因,PIK3CA的表达异常上调会增强PI3K的催化活性,继而激活PI3K-Akt信号通路,使细胞过度增殖,并增加细胞的迁移和侵袭能力[20]。根据生物信息学数据库,我们发现PIK3CA可能是miR-142-5p的候选靶标之一,既往研究证实PIK3CA是非小细胞肺癌(NSCLC)细胞中miR-142-5p的靶标[12]。本实验结果显示,过表达LOXL1-AS1可上调PIK3CA蛋白表达,过表达miR-142-5p可降低PIK3CA蛋白表达,且miR-142-5p可减弱LOXL1-AS1诱导的PIK3CA上调的作用,提示LOXL1-AS1通过调节miR-142-5p,进而调节下游PIK3CA表达。
综上所述,本实验中LOXL1-AS1可充当ceRNA的作用,靶向作用miR-142-5p,继而调控PIK3CA表达,调控胃癌细胞侵袭、迁移能力。在未来的研究中,我们将探讨LOXL1-AS1是否可以与细胞蛋白质相互作用以发挥其功能。
