TETs在结直肠癌中的表达及TET2抑制结直肠癌细胞增殖和侵袭
2020-08-03王凤,张竞,谢扬,齐健
王 凤, 张 竞, 谢 扬, 齐 健
武汉大学中南医院消化内科 肠病湖北省重点实验室 湖北省肠病医学临床研究中心,湖北 武汉 430071
在世界范围内结直肠癌是发病率和死亡率很高的癌症之一,据美国癌症协会研究显示,其死亡率居第三[1-2]。目前各种治疗方法已经得到快速发展,但在治疗过程中依然有耐药和远处转移以及早期诊断困难等问题,这些成为非常重要的挑战[3]。因此,迫切需要开发新型有效的治疗方法,探索生物标志物和治疗靶点就成为了关键,近年来也有显著发展[1,3]。
基因启动子区CpG岛的甲基化会导致基因沉默,在肿瘤中可影响抑癌基因表达,进而影响肿瘤发生、发展[4]。既往有研究表明,基因异常甲基化与肿瘤的分型[5]、预后不良和肿瘤复发[6]有关。DNA去甲基化主要有两种机制。一种是被动去甲基化,另一种是10-11-易位-甲基胞嘧啶双加氧酶(ten-eleven translocation methylcytosine dioxygenases,TETs)和胸腺嘧啶-DNA糖化酶(TDG)介导的主动去甲基化[7]。由TET1、TET2、TET3组成的TETs为主动去甲基化机制提供了新的视角和方向[8]。TETs催化5-甲基胞嘧啶(5mC)依次氧化为5-羟甲基胞嘧啶(5hmC)、5-甲酰基胞嘧啶(5fC)、5-羧胞嘧啶(5caC),然后通过TDG介导修复机制完成去甲基化过程[9]。TET2的突变在各种癌症中很常见,尤其是白血病中,包括急性髓细胞白血病、骨髓增生异常综合征、慢性髓细胞白血病[10-12],主要导致造血功能异常[13]。也有报道称,TET2与淋巴细胞的浸润、肿瘤免疫[14]及胰岛素敏感性有关[15]。然而,TETs在结肠癌中的表达和作用尚不明确。
本研究采用数据库分析TETs在结直肠癌组织中基因表达情况,然后通过qRT-PCR和免疫组织化学检测等方法验证TETs在结直肠癌中的表达,并探讨TET2对结直肠癌细胞增殖和侵袭的影响。
1 材料与方法
1.1 GEPIA和UALCAN数据库GEPIA分析(Gene Expression Profiling Interactive Analysis)是一款可用于分析基因在肿瘤和正常组织差异表达的在线应用数据库,由北京大学研制开发。UALCAN(http://ualcan.path.uab.edu/in.dex.html)也是一个TCGA数据挖掘网站,可分析多个基因在肿瘤的表达及与预后的关系。本研究利用这两个数据库在线分析TETs在结直肠癌中的表达水平。
1.2 细胞培养本研究所用人结直肠癌细胞系SW480、HT-29和正常结肠上皮细胞NCM460购自中国科学院细胞库(中国上海)。用10%(v/v)胎牛血清(四季青,中国)和100 U/ml青霉素/链霉素(Life Technologies,美国)和高糖培养基(DMEM)(Gibco,中国)培养,在标准培养条件(体积分数为5%的CO2,37 ℃)的培养箱中培养。
1.3 组织标本本研究收集了33例武汉大学中南医院结直肠外科的原发性结直肠癌组织。所有病例均有明确的病理诊断。术前化疗、放疗的病例均予剔除。在病灶处和距离病灶2 cm处各取大小为1 cm×1 cm×1 cm组织样本,即为癌组织和癌旁组织。所得组织在使用前保存于液氮中。所有纳入研究患者均已获得知情同意。该研究已得到武汉大学中南医院伦理委员会机构的批准,并按照1964年《赫尔辛基宣言》及其后来的修正案所规定的伦理标准进行研究。
1.4 质粒与转染过表达TET2的质粒(Ubiquitin 3FLAG GFP,GOSE0173237)购自上海吉凯基因。转染前,将结直肠癌细胞置于6孔细胞培养板中,密度为1.8×105个/孔。按照说明,利用Lipofectamine 2000(Invitrogen公司,美国卡尔斯巴德)将质粒转染进这些细胞。随后,将细胞放在37 ℃培养箱中培养6~8 h,为了选择稳定转染的细胞,8 h后用2 ml的DMEM完全培养基替代,48 h后进行Western blotting和qRT-PCR等其他实验,以确定过表达效率。
1.5 RNA提取与实时定量PCR(qRT-PCR)使用TRIzol试剂(Invitrogen,Carlsbad,CA,USA)按照说明书提取癌组织和细胞系总RNA。用NanoDrop 2000分光光度计(美国Thermo Fisher Scientific公司)测定RNA浓度。用逆转录酶qPCR RT试剂盒(ToYoBo,日本)逆转录合成cDNA。TET2和GAPDH的qRT-PCR引物购自武汉擎科。qRT-PCR采用SYBR-Green PCR Master Mix在Biorad 7500 Real-time PCR系统(Applied Biosystems)中进行。上述实验重复3次,基因表达的相对变化使用2-△△CT方法进行分析。本研究中所使用的特异引物序列如下:TET2:forward:5′-CAGTGCTAATGCCTAATGG-3′;reverse:5′-GTATGCGATGGG-TGAGTG-3′;GAPDH:forward:5′-AGAAGGCTGGGGCTCATTTG-3′;reverse:5′-GCAGGAGGCATTGCTGATGAT-3′。
1.6 Western blotting细胞转染后,使用含有蛋白酶抑制剂(PMSF,武汉,中国)混合物的RIPA蛋白提取试剂(碧云天,北京)从裂解细胞中分离出总蛋白。用增强型BCA蛋白检测试剂盒(碧云天,北京)检测裂解液中的蛋白浓度。用质量浓度为80 g/L的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,然后转移到PVDF膜上。用质量浓度为50 g/L牛奶在室温条件下封闭2 h,再在含有TET2抗体(1∶1 000,A5682,ABclonal Technology,武汉)的稀释液中低温(4 ℃)孵育12 h。用TBST洗涤3次后,用HRP标记的抗兔抗体(1∶3 000,AS030,Abcolonl Technology,武汉)在室温下孵育2 h,用ECL检测试剂进行可视化观察,用Image J对条带进行分析。
1.7 细胞增殖实验将SW480和HT29细胞接种于96孔板上,细胞密度为3 000个/孔,置于加湿培养箱中37 ℃培养后转染,分别培养0、24、48、72和96 h,每天取出1块,在每孔加入10 μl CCK-8溶液,37 ℃避光孵育2 h,然后测量各孔的吸光度(OD)值(450 nm),根据OD值,绘制细胞生长曲线。
1.8 细胞侵袭实验在无血清的培养基中,将2×105个细胞接种到上腔室(涂有基质凝胶),上腔室中有8.0 μm的孔径膜(BD Biosciences,Bedford,MA,USA)。将下室放入含有10%胎牛血清培养基600 μl作为化学引诱剂,37 ℃孵育24 h后,用质量浓度为1 g/L结晶紫(Bogoo,Shanghai,China)染色20 min,4%多聚甲醛固定25 min。仍在Transwell小室顶部的细胞用PBS湿润的棉签除去,对成功移位的下腔室细胞进行染色拍照。
1.9 免疫组织化学将结直肠癌组织固定于浓度为10%中性甲醛溶液中,然后用石蜡包埋,切成薄片,石蜡切片用二甲苯脱蜡,在100%、95%、75%乙醇中逐步复水。将组织放入煮沸的柠檬酸缓冲液(pH=6.0)中5 min,修复表位/抗原,PBS洗涤后放入辣根过氧化物酶中10 min。胎牛血清白蛋白阻断缓冲液培养组织40 min,再将组织切片在H2O2中孵育30 min,以抑制内源性过氧化物酶的活性。按照说明完成抗体孵育(A1506、A5682、A7612,Abcolonl Technology,武汉)。在所有的染色完成后,密封样品。应用Image-Pro Plus 6.0软件(Media Cybernetics,Inc.,Rockville,MD,USA)选取相同的棕黄色作为判断所有照片阳性的统一标准,对每张照片进行分析得出每张照片阳性的累积光密度值(IOD)。
1.10 统计学分析采用SPSS 22.0统计软件对数据进行统计学分析,两组间数据比较采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 在GEPIA和UALCAN数据库分析TETs在结直肠癌组织中的表达在GEPIA数据库中输入TET1、TET2、TET3,并选择结直肠癌,得到图1A、1C、1E,同样方法在UALCAN数据库中检索得到图1B、1D、1F。TET2在结直肠癌组织中的表达明显低于对照组织(P<0.05)。如图1A,TET1在结直肠癌组织中的表达降低(P<0.05),而在图1B中表达差异无统计学意义(P>0.05)。TET3在图1E中表达升高(P<0.05),在图1F中表达差异无统计学意义(P>0.05)。TET1和TET3在两个数据库中的表达差异趋势并不一致。

图1 TETs在结直肠癌组织中的表达情况 A:在 GEPIA 数据库中分析 TET1 的表达;B:在 UALCAN 数据库中分析 TET1 的表达;C:在GEPIA数据库中分析TET2的表达;D:在UALCAN数据库中分析TET2的表达;E:在 GEPIA 数据库中分析 TET3 的表达;F:在UALCAN 数据库中分析TET3的表达
2.2 TETs在结直肠癌组织和细胞中mRNA表达情况采用qRT-PCR方法检测了33对结直肠癌及其癌旁组织中TETs的表达(见图2A、2B、2C);以同样方法在正常结直肠上皮黏膜细胞系(NCM460)和2株结直肠癌细胞系(HT29、SW480)验证TETs的表达(见图2D、2E、2F)。TET2在结直肠癌组织和细胞中表达均低于癌旁组织和正常细胞(P<0.05),TET1和TET3组织中的表达差异无统计学意义(P>0.05),在细胞系中的表达趋势不统一。

图2 TETs在结直肠癌组织和细胞系中mRNA表达情况 A~C: 在结肠癌及其对应的癌旁组织中TET1、TET2、TET3 mRNA表达;D~F: 在结肠上皮正常黏膜细胞 NCM460 和结肠癌细胞系 SW480、 HT29 中的 TET1、TET2、TET3 mRNA 表达
2.3 TETs在结直肠癌组织中蛋白表达情况免疫组织化学染色显示,TET2蛋白在结直肠癌组织中表达低于癌旁组织(P<0.05),而TET1和TET3的表达差异无统计学意义(P>0.05,见图3)。
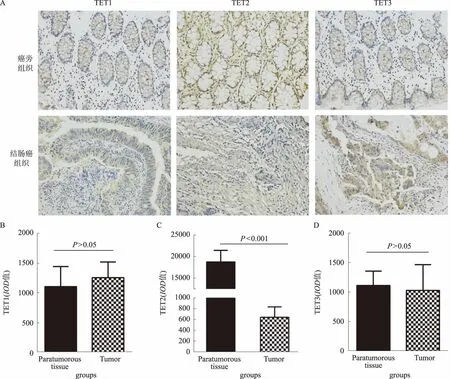
图3 TETs在结直肠癌组织中蛋白表达情况 A:TET1、TET2、TET3 在结肠癌组织中免疫组化结果(放大200倍);B:TET1 的免疫组化结果统计图;C:TET2 的免疫组化结果统计图;D:TET3 的免疫组化结果统计图
2.4 检测TET2的过表达效率用质粒转染SW480和HT29细胞后,用qRT-PCR检测过表达后TET2 mRNA水平的变化(见图4A、4B),接着用Western blotting方法验证了其在蛋白水平的过表达效果(见图4C、4D),与空载体组相比,质粒转染后TET2 mRNA和蛋白表达均明显升高(P<0.05)。

图4 TET2的过表达效率的检测 A:在 SW480 细胞中转染质粒后 TET2 mRNA 表达;B:在 HT29 细胞中转染质粒后TET2 mRNA表达;C:Western blotting 实验检测 TET2 的蛋白表达;D:Western blotting 实验结果的统计图
2.5 TET2基因对结直肠癌细胞增殖的影响CCK-8法测定TET2对结直肠癌细胞活力的影响。用质粒分别转染SW480和HT29细胞系,以空载体组作为对照。在两种细胞系中可见过表达TET2基因后,抑制了结直肠癌细胞的增殖(见图5)。
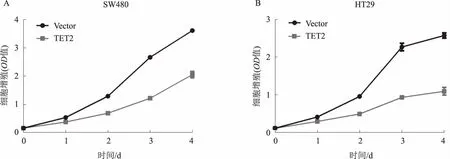
图5 过表达TET2对结直肠癌细胞增殖的影响 A:在 SW480 细胞中TET2对结肠癌细胞增殖的影响;B:在 HT29 细胞中TET2对结肠癌细胞增殖的影响
2.6 TET2基因对结直肠肿瘤细胞侵袭的影响Transwell实验检测TET2对结直肠癌细胞SW480和HT29侵袭能力的影响,与空载体组相比,SW480和HT29细胞中在过表达TET2基因后明显抑制了侵袭细胞的数量(见图6)。

图6 过表达TET2对结直肠癌细胞侵袭的影响(放大200倍)
3 讨论
在表观遗传修饰方面,目前结直肠癌基因表达的调控模式主要有组蛋白的翻译后修饰和DNA甲基化等[16],这些在结直肠癌的诊断和治疗中均具有良好的应用前景[17]。TETs蛋白家族催化5-甲基胞嘧啶氧化为5-羟甲基胞嘧啶,是甲基胞嘧啶向未甲基化的胞嘧啶进行脱甲基逆转的潜在关键中间体[18]。据报道,TET1和TET2去甲基化酶可通过直接与启动子区结合来调控胰岛素样生长因子-2 mRNA结合蛋白1(IGF2BP1)的羟甲基化状态,进而影响其在人骨髓间充质干细胞中的表达[19]。此外,在髓系恶性肿瘤中,TET2有较频繁的突变,并且通过与CCAAT/增强子结合蛋白(C/EBPa)相互作用,TET2影响早期和晚期的髓系分化[20]。TET2的丢失或突变也会影响CD4+T细胞[21-23]、CD8+T细胞[24]和自然杀伤T细胞(iNKT)的分化和命运[25]。这些发现揭示了TETs可能介导基因的羟甲基化状态或影响细胞分化,从而调控细胞生物学功能的潜在机制。
本研究中,我们检测了TETs在人类结直肠癌组织、癌旁组织和细胞系中的表达。qRT-PCR分析显示,TET2在结直肠癌组织和细胞中的表达低于邻近非癌组织和NCM460细胞,而TET1和TET3的表达差异无统计学意义。免疫组织化学检测TET2在蛋白水平上的表达趋势与之相同。有报道检测了134例初发急性髓细胞白血病患者和35名健康供体中TET2表达水平,结果表明,TET2在急性髓细胞白血病患者中较对照组有明显下调[26]。而有另外的报道称TET2在造血细胞中高表达[27]。由此可见,TET2在不同组织中的表达水平存在明显差异,TET2在结直肠癌中的表达发生变化是否有意义有待进一步探讨。因此,我们在SW480和HT29细胞系中过表达TET2,发现过表达TET2可以明显抑制结肠癌细胞的增殖,减少其侵袭。本研究证实了TET2在结直肠癌发展中的重要作用,TET2可作为探索结直肠癌诊断和治疗的潜在分子标志物,为今后的研究提供参考和思路。
