KLF7对骨髓间充质干细胞增殖和施万样细胞分化的影响
2020-07-30孙广大李文媛
孙广大 李文媛 马 多 王 莹△
1)牡丹江医学院,黑龙江 牡丹江 157011 2)牡丹江医学院神经组织工程研究所,黑龙江 牡丹江 157011
周围神经损伤(peripheral nerve injury,PNI)在发达国家发病率为每年(13~23)/100 000人,尽管PNI损伤不会危及患者生命,但其可能导致患者完全功能丧失或永久性损害,严重影响生活质量,并给患者和社会带来巨大经济压力[1]。PNI损伤分为神经营养不良、轴突断裂和神经切断。细胞治疗作为一种神经修复策略,由于具有自我更新、高增殖率和多能等特性,因此能够在周围神经系统中创造良好的神经再生微环境[2]。施万细胞(Schwann cells,SCs)是周围神经胶质细胞,在周围神经系统形成髓磷脂,可以支持周围神经系统和中枢神经系统神经再生,SCs移植促进神经损伤再生。有研究证实转录因子KLF7(Krüppel-like factor 7,KLF7)对轴突再生、神经元形态和存活具有重要调控作用[3-4],课题组前期研究发现KLF7能够显著促进SCs增殖和迁移[5]。尽管KLF7转染SCs能够有效促进周围神经损伤后功能重建,但如果供体SCs不是来自宿主动物,则可能导致免疫排斥。此外,SCs的分离、增殖、纯化时间较长,在可能发生神经恢复的时间窗内难以获取和扩增足以进行基于细胞治疗的SCs数量[6]。另外,供体部位并发症等困难也严重限制SCs的临床应用[7]。骨髓间充质干细胞(bone marrow stromal stem cells,BMSCs)作为组织工程移植的种子细胞已得到广泛研究,用于移植修复脊髓损伤、创伤性脑损伤和周围神经损伤等疾病[8-9]。BMSCs作为神经再生的重要种子细胞,具有体外分离培养方便、自我增殖、增殖速度快特点,而且BMSCs是具有相对较低免疫原性的多潜能干细胞。其能够分化为多种类型的细胞,如成骨细胞、脂肪细胞和内皮细胞。BMSCs在体内和体外也可分化为神经谱系,如神经元和星形胶质细胞,通过诱导剂可向施万样细胞分化[9]。尽管BMSCs移植能够促进周围神经的再生并减轻坐骨神经损伤,但BMSCs移植细胞仍存在问题,如BMSCs低活力、低分化率、归巢和低存活率[8]。鉴于前期研究推测移植BMSCs结合转录因子KLF7可能为坐骨神经损伤的恢复提供一种新的治疗选择[3]。但目前关于KLF7对BMSCs的作用尚未见报道。最近研究表明,BMSCs分泌细胞外囊泡含有KLF7 mRNA及其他多种转录因子,BMSCs能够通过分泌转录因子影响自身增殖和分化过程[10]。基于上述原因,本研究拟通过AAV-KLF7腺病毒转染BMSCs,探讨KLF7对BMSCs增殖和施万样细胞分化的作用及其机制,为临床周围神经损伤修复提供新的实验依据。
1 材料与方法
1.1实验动物和试剂Sprague Dawley(S-D)大鼠6只[哈尔滨医科大学实验动物中心,许可证号:SCXK(黑)203-001]。AAV2-KLF7病毒、AAV2-NC病毒(美国abm公司);兔抗大鼠KLF7抗体、兔抗大鼠S100抗体、CD29、CD90、CD34、CD45单克隆抗体(均购自美国Sigma公司);KLF7、NGF和GAPDH引物(宝泰克生物科技公司合成);胎牛血清(美国Hyclone公司);DMEM/F12培养基、胰蛋白酶、DAPI、β-巯基乙醇、全反式维甲酸、毛喉素、重组人heregulin-β1、碱性成纤维细胞生长因子、大鼠血小板衍生生长因子AB(均购自美国Sigma公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)试剂盒(德国宝灵曼公司);qRT-PCR试剂盒(购自武汉博士德公司)。
1.2BMSCs培养在无菌条件下分离成年大鼠双侧股骨、胫骨,剪断两端,用DMEM/F12培养基冲洗骨髓腔3~5次,将冲洗出骨髓细胞悬液离心,去除上清液。选用10%胎牛血清的DMEM/F12培养基混匀细胞,在培养皿中培养48 h去除非贴壁细胞,贴壁细胞标记为第0代(P0)。每3 d更换一次培养基,贴壁细胞生长密度达到85%后用胰蛋白酶消化传代,第4代细胞铺板并用于所有实验[11]。细胞免疫荧光染色检测CD29、CD90、CD34、CD45表面抗原,鉴定BMSCs。
1.3病毒转染和细胞分组BMSCs接种于6孔板(2×107细胞/孔)中,当细胞培养至90%融合进行转染。将AAV-NC和AAV-KLF7(6.5×109病毒颗粒/mL,150 μL/孔)转染12 h。3 d后替换为新鲜培养基。稳定转染BMSCs细胞分为正常组(未加入病毒)、AAV-NC组和AAV-KLF7组。
1.4Western bolt转染培养3 d后将每组BMSCs样品匀浆。SDS-PAGE电泳,上样量为20 μg蛋白/孔。电泳结束后转到PVDF膜上。在4 ℃下用一抗KLF7(1∶500)孵育过夜。次日洗膜后与HRP标记二抗在室温下孵育1 h(1∶5 000)。GAPDH设定为内参。PBST洗膜后用ECL试剂盒显色。
1.5实时荧光定量PCR(qRT-PCR)将每组BMSCs样品在病毒转染后3 d进行匀浆。按照Trizol试剂盒说明书提取总RNA,并将提纯的RNA稀释至500 ng/μL。qRT-PCR按照 PrimeScript®RT试剂盒说明操作。β-actin设为内参,用于实时荧光定量PCR(RT-PCR)的引物序列:KLF7上游5'-TTTCCTGGCAGTCATCTGCAC-3',下游5'-GGGTCTGTTTGTTTGTCAGTCTGTC-3';NGF上游5'-ACCTCTTCGGACACTCTGGA-3',下游5'-GTCCGTGGCTGTGGTCTTAT-3';β-actin上游5'-CCCATCTATGAGGGTTACGC-3',下游5'-TTTAATGTCACGCACGATTTC-3'。使用2-△△CT法计算基因表达水平。
1.6MTT法各组细胞以每孔1.25×103细胞的密度接种在96孔板中,在完全培养基中培养1、2、4、6和8 d。每24 h更换一次新鲜培养基。在各时间点使用MTT评估细胞增殖情况。
1.7EdU细胞免疫染色转染8 d将细胞与EdU培养4 h标记增殖细胞。根据说明书用Cell-LightTMEdU DNA细胞增殖试剂盒对行EdU免疫染色。从5个区域中计数EdU阳性率=EdU阳性核数/DAPI阳性核数。
1.8BMSCs分化为施万细胞样细胞将3组细胞放入有1 mmol/L β-巯基乙醇无血清DMEM中培养24 h。然后用10%胎牛血清和35 ng/mL全反式维甲酸替换培养基培养3 d。应用诱导培养基培养培养10 d。诱导培养基包括DMEM、10% FBS、5 μmol/L毛喉素、200 ng/mL重组人heregulin-β1、10 ng/mL性成纤维细胞生长因子和大鼠血小板衍生生长因子AB[12]。用0.25%的胰蛋白酶消化收集各组分化细胞。将细胞以105个细胞/mL密度接种到盖玻片上进行细胞免疫荧光染色,4 ℃下应用一抗S-100(1∶200)和DAPI(1∶200)孵育过夜。洗涤后荧光山羊抗兔IgG(FITC)(1∶200)孵育1 h,使用Olympus BX41荧光显微镜观察,计数S100阳性细胞比率。
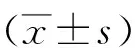
2 结果
2.1BMSCs形态和表型在倒置显微镜下观察到第1、2和4代培养细胞形态与同代BMSCs细胞形态一致(图1A)。BMSCs中CD29和CD90阳性表达(图1B、C),而CD34和CD45阴性表达(图1D、E)。
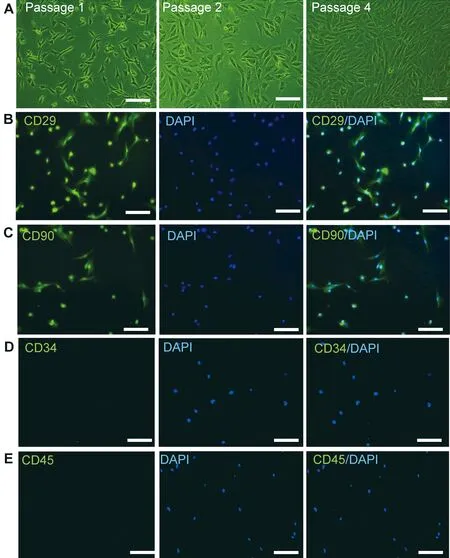
图1 BMSCs形态和表型特征 A:第1、2和4代的BMSCs;B~E:CD29、CD90、CD34或CD45(绿色)进行BMSCs免疫荧光染色,并进行细胞核染色(DAPI;蓝色);标尺=100 μmFigure 1 Morphology and phenotype characterization of BMSCs.A:BMSCs at passage 1,2,and 4.B-E:Immunohistochemical labeling of BMSCs by CD29,CD90,CD34,or CD45 (green) with nuclear staining (DAPI;blue).Scale bars:100 μm
2.2KLF7促进BMSCs中KLF7和NGF表达与正常组和AAV-NC组比较,AAV-KLF7组中KLF7蛋白和mRNA表达显著升高 (蛋白:F2,6=91.31,P<0.001;mRNA,F2,15=46.88,P<0.001)(图2A、B)。AAV-KLF7组中NGF mRNA的表达也显著增高(F2,15=16,P<0.01)(图2C),正常组与AAV-NC组细胞KLF7和NGF mRNA表达无显著差异(P>0.05)。

图2 各组细胞中KLF7和NGF表达 A:培养3 d后,Western bolt检测3组细胞中KLF7蛋白相对表达(n=3);B~C:qRT-PCR检测各组细胞中KLF7和NGF mRNA的相对表达(n=3);**P<0.01,***P<0.001;NS:无显著差异Figure 2 Efficacy of in vitro AAV-KLF7 gene transfer to BMSCs.A:Representative Western blots of KLF7 expression in the three groups of cultured BMSCs are shown at 3 days in vitro (n=3);B-C:qRT-PCR revealed the relative expression of KLF7 and NGF mRNA in the three treatment groups of BMSCs at 3 days in vitro (n=3);**P<0.01,***P<0.001;NS:not significant
2.3KLF7促进BMSCs体外增殖转染8 d,与正常组和AAV-NC组相比,AAV-KLF7组BMSCs的EdU阳性细胞比率显著增多(F2,15=40.95,P<0.001)(图3A、B),MTT结果显示,第8天与正常组和AAV-NC组相比,AAV-KLF7组BMSCs增殖活性显著增加(F2,15=40.95,P<0.001)(图3C)。

图3 KLF7促进BMSCs体外增殖 A:DAPI(蓝色) 标记细胞总数,EdU(红色)标记增殖BMSCs数量;B:检测各组细胞EDU阳性细胞比率;C:各组细胞培养1、2、4、6、8 d,MTT法检测细胞增殖情况;**P<0.01,***P<0.001;NS:无显著差异;标尺=100 μmFigure 3 KLF7 promote BMSCs proliferation in vitro A:The total number of the cells shown by DAPI (blue) staining,the number of proliferating BMSCs was determined through EdU (red) staining;B:EdU labeling index of each group;C:Each group BMSCs were incubated for days 1,2,4,6,or 8.Cell proliferation was assessed by MTT assay;**P<0.01,***P<0.001;NS:not significant;Scale bars=100 μm
2.4AAV-KLF7促进BMSCs施万样细胞分化诱导10 d后BMSCs与SCs细胞形态相似,呈狭窄梭状样形状(图4A)。AAV-KLF7组S100阳性细胞比率显著高于正常组和AAV-NC组(F2,15=16.68,P<0.05)(图4A、B)。正常组与AAV-NC组S100阳性细胞比率无显著差异(P>0.05)。

图4 KLF7促进BMSCs施万样细胞分化 A:诱导8 d各组BMSCs表现出与SCs相似的形态,呈狭窄梭状样形状,免疫荧光显示S100阳性细胞标记为绿色,细胞核标记为蓝色(DAPI);B:计数S100阳性细胞比率(n=3);***P<0.001;NS:无显著差异;标尺=100 μmFigure 4 KLF7 improves Schwann-like cell differentiation of BMSCs.A:In the photomicrographs,each group BMSCs showed similar morphology to SCs by day 8,presenting a narrow fusiform-like shape.Immunofluorescence images show S100+ cells labeled in green,and cell nuclei labeled in blue.B:Graphs represent that quantification and analysis of the ratio of S100+ cells.n=3,***P<0.001.NS:not significant.Scale bars=100 μm
3 讨论
全世界每年有100万人受到周围神经损伤(PNI)的影响。在欧洲有近30万例PNI创伤病例。美国PNI占所有创伤患者的3%,如果考虑到神经丛和根部撕脱,PNI发病率会增加到5%。神经端端缝合用于治疗简单神经横断,但在大多数情况下由于神经近端和远端残端之间距离较大,因此无法进行简单的缝合[13],自体神经移植是这类PNI的金标准治疗方法。自体神经提供一个物理和生物学支架用于诱导轴突穿过缺损区域生长,重建神经连续性,但自体神经移植存在许多技术限制,如供体来源有限、二次手术引起的并发症以及神经瘤形成疼痛的风险。组织工程技术是当前治疗PNI的新策略。组织工程化神经移植物的组成包括支架材料、种子细胞和神经营养因子,其中组织工程神经移植的种子细胞SCs能够介导轴突损伤的再生和髓鞘再生,分泌胰岛素样生长因子-1、神经营养因子和脑源性神经营养因子等多种神经营养成分,促使周围神经系统较中枢神经系统具有更好的自我恢复能力[4-5]。临床应用中SCs在分离、增殖和纯化以及供体部位并发症方面面临困难,而且残留的成纤维细胞在SCs培养过程中仍然保留,且增殖快于SCs。如果将SCs与大量成纤维细胞一起移植,则会形成瘢痕[6],而且在严重受伤的情况下,SCs数量仍无法达到完全神经再生水平,因此迫切需要具有广泛自我更新能力、分化潜力、低免疫原性和易于获得等特性的种子细胞来源。
BMSCs由于其可及性、快速增殖、弱免疫原性和神经分化可塑性而成为周围神经再生最有希望的种子细胞之一。大量实验研究表明BMSCs在周围神经损伤再生和修复中具有有益作用。尽管机制尚不清楚,但它应至少包括以下4个方面[14-16]:(1)BMSCs能够分泌营养因子和支持物质,如NGF、脑源性神经营养因子、神经胶质细胞源性神经营养因子、睫状神经营养因子、胶原蛋白、纤连蛋白和层粘连蛋白,增强体内神经营养性微环境,促进受损神经修复;(2)通过旁分泌信号调节炎症;(3)激活宿主干细胞促进组织修复;(4)BMSCs是源自中胚层中自我更新的多能成年前体细胞,具有分化为中胚层谱系细胞的能力,具有多向分化的特征,能够分化为SCs。在周围神经损伤中BMSCs能够作为SCs的替代细胞,一部分移植BMSCs分化为SCs,促进周围神经再生和功能恢复,但移植的BMSCs在神经移植物中存活率和SCs分化率非常低。大量研究证实[6],BMSCs植入神经移植物可有效促进轴突再生并改善神经功能恢复,其有效作用基于BMSCs在神经移植物中的长期存活。但由于存活率低和SCs分化效率低,移植BMSCs表现不佳。研究表明植入坐骨神经至少存活33 d,但只有5%的BMSCs分化为SCs,且大多数植入BMSCs保持未分化状态[17]。
近年来研究发现[6]转录因子能够参与调控BMSCs增殖和分化,KLF家族是一类具有锌指结构的转录因子家族,其典型结构特征是在其羧基端具有3个C2H2锌指结构。KLF7调控多种细胞的发育、增殖和分化,对中枢神经系统轴突再生、髓鞘形成和神经胶质细胞的分化发挥重要作用[18]。前期研究发现,通过修饰SCs过表达KLF7能够增强坐骨神经横断损伤后脱细胞神经移植物的移植和天然施万细胞的增殖。这种反应显著促进ANA中轴突再生和髓鞘再生增强,以及神经肌肉神经支配和功能恢复增加[5],但用于种子细胞治疗的SCs受到获取时间较长和供体部位并发症限制[6]。目前尚不清楚KLF7对BMSCs细胞表型和分化的影响。
本研究在体外培养扩增BMSCs,通过CD29、CD90、CD34和CD45验证了BMSCs纯度,将KLF7基因通过腺相关病毒转染至BMSCs中,使其有效表达目的基因,结果表明AAV-KLF7能够有效转染BMSCs,显著促进KLF7蛋白和mRNA表达。同时本研究发现AAV-KLF7亦能显著促进NGF表达,NGF是KLF7的主要靶基因之一。NGF可以保护神经元、促使SCs增殖、引导轴突生长,由此可见在NGF修复周围神经损伤中起到重要的作用[19]。因此本研究推测,NGF可能是KLF7作用BMSCs的一个重要作用机制。
前期研究[5]证明KLF7表达能够促进SCs分泌NGF,促进SCs增殖和迁移,抑制SCs凋亡,对SCs具有显著保护作用,推测本研究中KLF7过表达对BMSCs具有同样作用。为证实这一假说,通过细胞增殖和诱导分化实验发现,与正常组和AAV-NC组比较,AAV-KLF7组EdU标记细胞数量显著增多,表明KLF7过表达促进BMSCs增殖。MTT检测结果也证实这一观点。在检测KLF7对BMSCs诱导分化实验中发现AAV-KLF7组的S100阳性细胞比率高于两个对照组,表明KLF7能够显著促进BMSCs施万样细胞分化。
本研究探讨并证实体外KLF7增强BMSCs增殖和施万样细胞分化,其机制可能与上调NGF信号通路有关。以KLF7转染的BMSCs为种子细胞有望成为促进组织工程神经再生的重要方法之一。
