脓毒症相关性脑病老年小鼠的脑转录组分析
2020-07-30徐震亚李宏宾孙荣青
徐震亚 郭 铁 徐 娜 李宏宾 冯 敏 孙荣青
郑州大学第一附属医院,河南 郑州 450052
脓毒症相关性脑病(sepsis-associated encephalopathy,SAE)是伴随脓毒症发生的,在无直接的中枢神经系统感染、结构异常或其他类型脑病(如肝或肾性脑病)的情况下,出现弥漫性脑功能障碍[1]。SAE 通常表现为从嗜睡到昏迷程度不等的意识障碍,常伴有谵妄,注意力下降,思维混乱,其他症状还包括幻觉、睡眠节律异常和躁动,而且谵妄常出现于脓毒症早期,对脓毒症的早期诊断也是很有意义的线索[1]。关于SAE 的发病率,研究结果存在很大差异,为9%~71%,这与各研究采用的诊断标准不同有关[2]。研究显示重症监护病房中脓毒症相关性脑病的发生率为17.7%[3]。患有菌血症且被诊断出患有肾、肝或多器官功能障碍的患者,SAE 的发生率更高。一旦患者出现SAE,则预示着其与普通患者相比,具有更高的病死率,更多的重症监护资源占用和更长的住院时间[4]。而SAE的发生,在老年患者中更为普遍[5]。因此,对老年SAE 进行研究,对降低老年脓毒症患者的病死率,减少相关医疗费用具有重要意义。老年脓毒症患者SAE的发病机制仍不清楚,目前研究显示可能与内皮激活、血脑屏障改变、神经递质改变等有关[6]。推测老年SAE患者与成年SAE患者的病理机制存在差异,对两者进行脑组织转录组的分析,具有重要意义。但人脑组织样本的获取存在很大困难。从National Center for Biotechnology Information(NCBI)的Gene Expression Omnibus(GEO)数据库中发现,GODBOUT等[7]上传的数据集GSE3253包含了老年和成年小鼠的脑组织基因表达芯片的数据,但并未对其进行生物信息学分析。因此,对该数据集进行了进一步生物信息学分析,以期发现老年SAE小鼠与成年SAE小鼠相比,其病理过程中独特的关键基因及通路,来为进一步的研究指明方向。
1 芯片数据
数据集GSE3253来自于GEO数据库(https://www.ncbi.nlm.nih.gov/geo/geo2r/?acc=GSE3253)。由于数据来自于公共数据库,因此不需要伦理学审批。该数据集由 GODBOUT等[7]上传,他们采用腹腔注射LPS的方法制作SAE动物模型[8-9],研究包括成年组小鼠3只和老年组小鼠3只,采用[Mouse430_2]Affymetrix Mouse Genome 430 2.0 Array平台进行基因表达分析。该研究设计严谨,数据详实,但无进行充分的生物信息学分析。
2 方法
2.1差异基因的筛选使用GEO提供的GEO2R在线工具(https://www.ncbi.nlm.nih.gov/geo/geo2r/?acc=GSE3253)进行基因差异表达分析。GEO2R是GEO提供的基于R语言软件包的在线分析工具[10]。首先通过value distribution功能对芯片数据表达值的可比性进行分析;设置P<0.01,同时|Log2Fold change|>1.5为筛选差异表达基因(differentially expressed genes,DEGs)的阈值。对于无基因注释的探针位点数据,我们将其删除;对于一个位点同时对应多个注释基因的数据,我们将其删除;对于同一基因对应多个探针位点数据的,我们保留P值最小的数据,其余数据删除。
2.2基因本体论富集分析将得到的上调和下调的DEGs分别上传至DAVID网站(https://david.ncifcrf.gov/,Version 6.8)进行基因本体论(Gene ontology,GO)分析。P<0.05认为差异有统计学意义。
2.3KEGG通路富集分析将得到的上调和下调的DEGs分别上传至DAVID网站(https://david.ncifcrf.gov/,Version 6.8)进行Kyoto Encyclopedia of Genes and Genomes(KEGG)通路富集分析。P<0.05为差异有统计学意义。
2.4蛋白互作分析将得到的全部DEGs上传至STRING网站(https://string-db.org/cgi/input.pl)进行蛋白互作分析。设置confidence score=0.7,将得到的蛋白互作数据使用cytoscape(version 3.5.1)进行可视化制图。
3 结果
3.1DEGs的筛选通过差异表达基因的筛选,共筛选到305个DEGs,其中上调DEGs为157个,下调DEGs为148个。表1中分别列出了根据P值排列的前10个上调和下调的DEGs。可以发现,这些上调的基因与恶病质、脂肪代谢、肿瘤进展、细胞凋亡有关[11-12]。下调基因与基质的分解组装[13],免疫细胞的迁移,功能和存活[14]。见表1。
3.2基因本体论富集分析基因本体论包括三个分类:生物过程(Biological process,BP),细胞成分(Cellular component,CC),和分子功能(Molecular function,MF)。
3.2.1 Biological process:通过GO富集分析,在BP分类中,上调的157个DEGs富集到13个BPs,集中在细胞的分化、发生以及对应激的反应等;下调的148个DEGs富集到11个BPs,集中在离子转运、凋亡的调控、对脂多糖的反应等。图1A中列出了上调和下调的DEGs所富集到的前5项生物过程条目(根据P值排列)。
3.2.2 Cellular component:通过GO富集分析,在CC分类中,上调的157个DEGs富集到3个CCs,集中在细胞质、胞外区域;下调的148个DEGs富集到6个CCs,集中在胞核、胞膜和胞外区域。图1B中列出了上调和下调的DEGs所富集到的细胞成分条目(根据P值排列)。
3.2.3 Molecular function:通过GO富集分析,在MF分类中,上调的157个DEGs富集到3个MFs,集中在代谢相关的功能;下调的148个DEGs富集到8个MFs,集中离子通道活性、激素活性相关功能。图1C中列出了上调和下调的DEGs所富集到的分子功能条目(根据P值排列)。

注:红色代表上调DEGs所富集到的GO条目,绿色代表下调DEGs所富集到的GO条目
3.3KEGG通路富集分析通过KEGG通路富集分析,上调的157个DEGs富集到4个通路,包括mmu05218:Melanoma(P=0.02);mmu04015:Rap1 signaling pathway(P=0.03);mmu04014:Ras signaling pathway(P=0.04);mmu05200:Pathways in cancer(P=0.04)。下调的148个DEGs富集到3个通路,包括mmu05032:Morphine addiction(P=0.01);mmu04060:Cytokine-cytokine receptor interaction(P=0.03);mmu04721:Synaptic vesicle cycle(P=0.04)。图2显示了KEGG通路富集分析的结果(根据P值排列),红色代表上调通路,绿色代表下调通路。

注:红色代表上调通路,绿色代表下调通路
3.4蛋白互作网络分析通过PPI蛋白互作分析发现两个主要的蛋白互作网络,Gngt1、Sucnr1、Bdkrb2、Exo1、Cdk1是这两个互作网络中的关键基因。图3显示了主要的基因蛋白相互作用的关系。
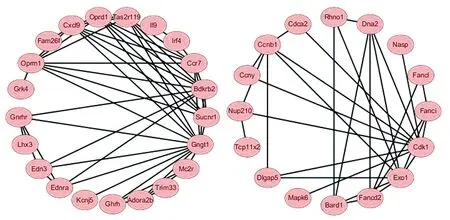
注:椭圆形标注为基因蛋白名称,黑线代表两者间存在调节作用
4 讨论
通过对SAE的老年小鼠与成年小鼠脑组织基因表达芯片数据的对比分析发现,Gngt1、Sucnr1、Bdkrb2、Exo1、Cdk1基因可能在老年SAE发病过程中具有重要作用。
Gngt1 (log2 FC=4.22)在眼睛和大脑都有表达[15],它参与了胰岛素抵抗途径[16],参与了PIK3-AKT信号通路[17],其在炎症反应过程中有重要作用。本研究中发现,相对于成年SAE小鼠,老年SAE小鼠Gngt1的表达是上调的,其会增加老年SAE患者脑损伤的发生。
SUCNR1 (log2 FC=2.86)是一种G蛋白偶联受体,在缺血、缺氧等应激反应中起重要作用。SUCNR1的激活促进了巨噬细胞的抗炎表型,并增强了这些细胞对白介素4等的反应,在巨噬细胞的抗炎反应中具有关键作用[18]。巨噬细胞中SUCNR1的激活对于肥胖者脂肪组织的浸润和炎症均很重要,并且表明SUCNR1是肥胖诱导2型糖尿病有希望的治疗靶标[19]。另外,SUCNR1在肾素诱导的高血压,局部缺血/再灌注损伤,炎症和免疫反应,血小板聚集和视网膜血管生成中也具有重要作用[20]。LUKYANOVA等[21]研究发现,SUCNR1相关的信号通路对大脑缺氧耐受形成有重要作用。一次低氧暴露,会在15~60 min内诱导SUCNR1在大脑皮层中表达,这与对机体缺氧的紧急耐受性形成有关。缺氧期间,脑皮质特异性SUCNR1的即时表达与GABA旁路的活性有关。Sucnr1具有抗炎和促进大脑对缺氧的耐受作用,相对于成年SAE患者,老年SAE患者Sucnr1表达的升高具有保护作用。
BDKRB2(log2 FC=3.48)可以增加血脑屏障通透性[22],在中枢神经系统免疫反应中起重要作用[23]。BDKRB2对完整激肽具有高度亲和力,激肽介导广泛的生物学作用,包括疼痛、炎症、血管舒张以及平滑的核收缩和松弛[24]。缓激肽是激肽的一种,优先结合BDKRB2,可以在早期阶段通过内皮细胞中的BDKRB2受体增加血管通透性,并通过在基质细胞中BDKRB2受体在后期阶段促进血管内皮生长因子(VEGF)的上调来促进血管生成。本研究发现老年SAE小鼠Bdkrb2表达较成年SAE小鼠显著升高,说明其对血脑屏障的破坏作用在老年SAE发生中有更重要的作用。
EXO1(log2 FC=3.53)是一种5'→3'核酸外切酶,有助于调节细胞周期检查点,维持DNA修复途径,它的缺乏会导致DNA双链断裂,细胞周期停滞,细胞死亡或细胞转化。EXO1在保护基因组稳定性中起到重要作用[25]。结合本研究,老年SAE小鼠对基因组稳定性的保护优于成年SAE小鼠。
Cdk1(log2 FC=-2.64)在神经元受损后表达上调,初级皮层神经元培养物暴露于氧葡萄糖剥夺(OGD)4 h会导致神经元细胞死亡并诱导Cdk1表达。Cdk1敲除的小鼠神经元显示出对OGD诱导的神经元细胞死亡的部分抗性[26]。老年SAE小鼠Cdk1表达较成年SAE小鼠显著升高,导致老年SAE神经元细胞死亡增加。
研究发现炎症和血脑屏障的破坏在老年SAE的发病中起到了关键作用,Gngt1、Sucnr1、Bdkrb2、Exo1、Cdk1基因可能在老年SAE发病过程中具有重要作用,这为进一步对老年SAE发病机制的研究指明了方向。本研究的缺点在于芯片数据的样本量较小,而结果是基于对既往研究数据的分析得到的,由于临床中脑组织样本获得存在极大困难,而血脑屏障的存在,脑组织中蛋白水平的变化与血液中蛋白水平的变化并不一致,会在进一步的研究中对这方面的缺陷进行改进。
