壳聚糖/功能性自组装多肽复合支架的制备及神经再生研究
2020-07-29张双英雷琪琪张文柠敖宁建
胡 萍,张双英,李 洁,雷琪琪,张文柠,敖宁建,*
(1.暨南大学生命科学技术学院,广东 广州 510632;2.广东省教育厅生物材料重点实验室,广东 广州 510632)
壳聚糖(CS)因其良好的生物相容性,成为了神经组织工程中重要的生物高分子材料[1-3]。研究表明,以壳聚糖为基底物质构建组织工程支架对神经修复具有独特的优势[4-13],但是单纯的壳聚糖支架在水化状态下不能为细胞提供良好的生长环境,所以常用化学交联剂对壳聚糖进行改性[9]。京尼平作为一种性能优良的天然生物交联剂,在交联过程中产生的毒性远小于戊二醛,还能减少炎症的发生[14]。然而,仅用京尼平交联的壳聚糖支架并不能很好地促进细胞定向生长和分化。赵玉园[15]利用静电纺丝技术制备的PLLA/ SAP生物支架能为神经干细胞提供更加稳定的生长环境,并且能够诱导神经轴突的伸长。鉴于此,作者利用天然生物交联剂京尼平交联CS和功能性自组装多肽(F-SAP),经冷冻干燥制备不同配比的CS/F-SAP复合支架;通过比较复合支架的微观形貌、孔隙率、力学性能和吸水率确定复合支架的最佳配比;通过研究复合支架对神经干细胞分化的影响探究其对神经再生的作用。
1 实验
1.1 试剂与仪器
京尼平、牛血清白蛋白(BSA),百灵威科技有限公司;壳聚糖、PDL、兔源-GFAP、Alexa Fluor 488-Phalloidi,Sigma-Aldrich公司;DMEM/F12、EGF、BFGF、B27(含VA)、B27(不含VA)、N2、Accutase,GIBCO公司;抗鼠源-Tubulin-β,Bio Legend公司;Alexa Fluor 546二抗,Invitrogen公司;Triton X-100,Amresco公司;含DAPI的荧光保护剂,Electron Microscopy Science公司。
EQIOMOX55型傅立叶红外光谱仪、ULTRA55型扫描电子显微镜、LSM700型激光共聚焦显微镜,Carl Zeiss公司;冷冻干燥机,五洲东方科技有限公司。
1.2 CS/F-SAP复合支架的制备
配制20 mg·mL-1的CS溶液(pH=5.5)和10 mg·mL-1的F-SAP溶液(pH=7),采用化学交联法制备CS/F-SAP复合支架。将CS溶液与F-SAP溶液分别按体积比3∶1、1∶1、1∶3混合均匀,再将各组混合液与2 mg·mL-1的京尼平溶液按体积比3∶1混合,振荡均匀,加入24孔板中,冷冻干燥,即得CS/F-SAP复合支架,分别标记为CS/F-SAP-1、CS/F-SAP-2、CS/F-SAP-3。不添加F-SAP溶液,同法制备CS支架作为对照。
1.3 CS/F-SAP复合支架的微观形貌
将CS/F-SAP复合支架冷冻干燥24 h后,粘附在导电板上并涂金,采用扫描电子显微镜观察其微观形貌。
1.4 CS/F-SAP复合支架孔隙率的测定
称量CS/F-SAP复合支架的质量(m0);将其放入盛满乙醇的比重瓶中,称量比重瓶的质量(m1);再脱气,加满乙醇,称量乙醇和比重瓶的质量(m2);最后将复合支架取出,称量剩余乙醇和比重瓶的质量(m3),按式(1)计算孔隙率:
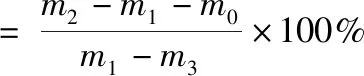
(1)
1.5 CS/F-SAP复合支架力学性能的测定
将CS/F-SAP复合支架冷冻干燥24 h,利用电子万能材料试验机对其进行压缩,绘制CS/F-SAP复合支架的压缩应力应变曲线。
1.6 CS/F-SAP复合支架吸水率的测定
称量CS/F-SAP复合支架的质量(m0);将其放入PBS缓冲液中浸泡3 min后取出,用滤纸吸去复合支架表面多余的水分后称量质量(m4),按式(2)计算吸水率:

(2)
1.7 细胞培养
采用维持培养基将怀孕14.5 d的C57胎鼠鼠脑源神经干细胞原代培养7 d;用Accutase消化神经球,使细胞呈单个状态,以合适的密度接种到支架表面;再将培养板放回培养箱,采用分化培养基培养7 d。其中培养箱的温度为37 ℃,CO2浓度为5%。
维持培养基配方:DMEM/F12培养基、1%双抗、1%谷氨酰胺、2% B27(不含VA)、1% N2、20 ng·mL-1BFGF、0.1%肝素。
分化培养基配方:DMEM/F12培养基、1%FBS、1%双抗、1% B27(含VA)。
1.8 细胞免疫荧光染色
将在支架中培养7 d后的神经干细胞用多聚甲醛(4%)固定15 min,再用Triton X-100(0.1%)和含有BSA(3%)的PBS缓冲液封闭30 min;用抗鼠源-Tubulin-β标记神经元,兔源-GFAP标记星型胶质细胞;将Alexa Fluor 546(驴抗鼠)和Alexa Fluor 488(驴抗兔)溶解在PBS缓冲液中,常温避光反应2 h;用DAPI(1∶1000)染色细胞核,避光反应10 min,置于激光共聚焦显微镜中观察。将包被了PDL的玻片作为对照组。
2 结果与讨论
2.1 CS/F-SAP复合支架的SEM分析(图1)

a.CS b.CS/F-SAP-1 c.CS/F-SAP-2 d.CS/F-SAP-3
从图1可以看出,CS支架和不同配比的CS/F-SAP复合支架均具有多孔结构,说明F-SAP的加入不影响CS支架的多孔结构。这是因为,CS和F-SAP带有相同的电荷,交联前彼此分散,无团聚现象。研究[16]表明,材料的多孔结构可以为细胞提供更大的粘附空间。
2.2 CS/F-SAP复合支架的孔隙率(图2)

图2 CS/F-SAP复合支架的孔隙率Fig.2 Porosity of CS/F-SAP composite scaffolds
从图2可以看出,复合支架的孔隙率随着F-SAP比例的增大逐渐升高,但增幅较小。其中,CS支架的孔隙率为(90±0.98)%,CS/F-SAP-1、CS/F-SAP-2、CS/F-SAP-3复合支架的孔隙率分别为(96±0.75)%、(98±0.50)%、(98±0.58)%。这是因为,随着CS/F-SAP复合支架中F-SAP比例的增大,CS所占比例减小,使得交联点的密度减小,导致孔隙率升高。
2.3 CS/F-SAP复合支架的力学性能
CS/F-SAP复合支架的压缩应力应变曲线如图3所示。

图3 CS/F-SAP复合支架的压缩应力应变曲线Fig.3 Compressive stress-strain curves of CS/F-SAP composite scaffolds
从图3可以看出,复合支架的力学强度随着F-SAP比例的增大有所减小,但减幅不大。其中,CS支架的力学强度最好,CS/F-SAP-1复合支架和CS/F-SAP-2复合支架的力学强度适中,CS/F-SAP-3复合支架的力学强度最差。这是因为,随着CS/F-SAP复合支架中F-SAP比例的增大,CS所占比例减小,使得交联点的密度减小,导致交联网络的机械强度降低。
此外,多孔支架的压缩应变由材料本身决定。这表明,可以通过改变CS与F-SAP的比例来调节复合支架的机械强度。
2.4 CS/F-SAP复合支架的吸水率(图4)

图4 CS/F-SAP复合支架的吸水率Fig.4 Water absorption of CS/F-SAP composite scaffolds
从图4可以看出,F-SAP在复合支架中的比例对复合支架的吸水率影响较大,复合支架的吸水率随着F-SAP比例的增大而升高。其中,CS支架的吸水率为(226±1.38)%,CS/F-SAP-1、CS/F-SAP-2、CS/F-SAP-3复合支架的吸水率分别为(236±1.75)%、(291±1.59)%、(305±1.73)%。表明,CS/F-SAP-2复合支架和CS/F-SAP-3复合支架的吸水率都较高。这是因为,随着CS/F-SAP复合支架中F-SAP比例的增大,CS所占比例减小,三维网络交联点的密度也随之减小,使得水分子更容易进入支架网络结构,导致吸水率升高。
综上,CS/F-SAP-2复合支架和CS/F-SAP-3复合支架的孔隙率和吸水率都较高,但是CS/F-SAP-3复合支架交联点的密度较小,机械强度较低。因此,选择CS/F-SAP-2复合支架为最佳材料,即制备CS/F-SAP复合支架最佳CS溶液与F-SAP溶液的体积比为1∶1。
2.5 CS/F-SAP复合支架对神经干细胞分化的影响
神经干细胞具有多向分化的功能,可以分化为神经元、星型胶质细胞和少突胶质细胞[17],具有可塑性强、迁移率高和免疫原性低等特点。在神经损伤修复过程中,神经元和星型胶质细胞相互调控,两者以正反馈的方式促进神经修复[18]。研究[19]表明,神经损失后7 d,星型胶质细胞数量约增加8%。在免疫荧光染色的研究中,显示了神经元和轴突的密度。神经干细胞在支架中培养7 d后的免疫荧光照片如图5所示。

a.CS/F-SAP-2 b.CS c.PDL
从图5可以看出,CS/F-SAP-2复合支架相比于其它两组支架,对神经干细胞的分化效果更好,神经元和轴突的密度更大。表明,CS/F-SAP-2复合支架可以有效改善神经的微结构修复。此外,通过计数软件Image-J计算神经元和星型胶质细胞占细胞总数的百分比,结果如图6所示。

a.神经元分化比例 b.星型胶质细胞分化比例
从图6a可以看出,相比于其它两组,CS/F-SAP-2复合支架中神经元分化比例最大,说明CS/F-SAP-2复合支架有利于神经干细胞向神经元方向分化。同时,从图6b可以看出,相比于其它两组,CS/F-SAP-2复合支架中星型胶质细胞分化比例最小,也证明了CS/F-SAP-2复合支架能够抑制星型胶质细胞的分化,促进神经干细胞更多地向神经元方向分化,有利于神经再生。
3 结论
利用天然生物交联剂京尼平交联CS和F-SAP,经冷冻干燥制备了不同配比的CS/F-SAP复合支架,通过比较复合支架的微观形貌、孔隙率、力学性能和吸水率确定制备复合支架的最佳配比:20 mg·mL-1CS溶液与10 mg·mL-1F-SAP溶液的体积比为1∶1。最佳配比下制备的CS/F-SAP复合支架能够促进神经干细胞向神经元方向分化,促进神经再生。
