秦巴山区新鲜粉葛淀粉的提取工艺优化及其性质研究
2020-07-29谢娟平
朱 盼,谢娟平,*
(1.陕西科技大学化学化工学院,陕西 西安 710021;2.安康学院医学院 秦巴中药资源研发中心,陕西 安康 725000)
粉葛为豆科植物甘葛藤的干燥根,是秦巴山区一种资源丰富、药食兼用的绿色食品,具有解肌退热、生津止渴、通经活络、解酒毒等功效,临床主要用于治疗头痛发热、项背强痛、口渴等症[1]。粉葛的主要成分是淀粉和黄酮,其与葛根的最大区别是淀粉含量高,粉葛淀粉在食品领域具有广阔的开发前景[2-3]。粉葛淀粉的提取常采用碱法和普通水提法[4-5],其中常规碱法有利于淀粉浸出,且淀粉中黄酮保留量较高,但浓度掌握不当易发生糊化,不利于后续处理;水提法提取率较低,黄酮保留量少。超声波辅助提取有助于有效成分溶出。随着退耕还林和生态保护的发展,秦巴山区粉葛种植大面积推广,其加工利用日益重要,目前未见超声波辅助提取秦巴山区粉葛淀粉的研究报道。鉴于此,作者以淀粉提取率为评价指标,在单因素实验的基础上,采用响应面法优化秦巴山区粉葛淀粉的超声波辅助碱法提取工艺,并比较超声波辅助碱法、常规碱法及超声波辅助水法提取对粉葛淀粉性质的影响,以期为秦巴山区粉葛淀粉开发利用提供参考依据。
1 实验
1.1 材料、试剂与仪器
粉葛:一年生,10月和12月采自安康平利县,含水量分别为60.33%、65.45%。
石灰水溶液(氧化钙与水反应,过滤制备)、浓盐酸、浓硫酸、高氯酸、蒽酮、碘、碘化钾等。
KYKY-EM3200型扫描电子显微镜,北京中科科仪股份有限公司;FTIR200型傅立叶红外光谱仪,美国Nicolet公司;L5S型紫外可见分光光度计,上海仪电分析仪器有限公司;料理机,中山欧美特电器有限公司;电子天平,北京赛多利斯仪器系统有限公司;DK-2000-ⅢL型电热恒温水浴锅、800型离心机,天津泰斯特仪器有限公司;KH-250DE型超声波清洗器,昆山禾创超声仪器有限公司;PHS-2F型 pH计,上海精密科学仪器有限公司。
1.2 方法
1.2.1 秦巴山区粉葛淀粉的提取工艺流程(图1)
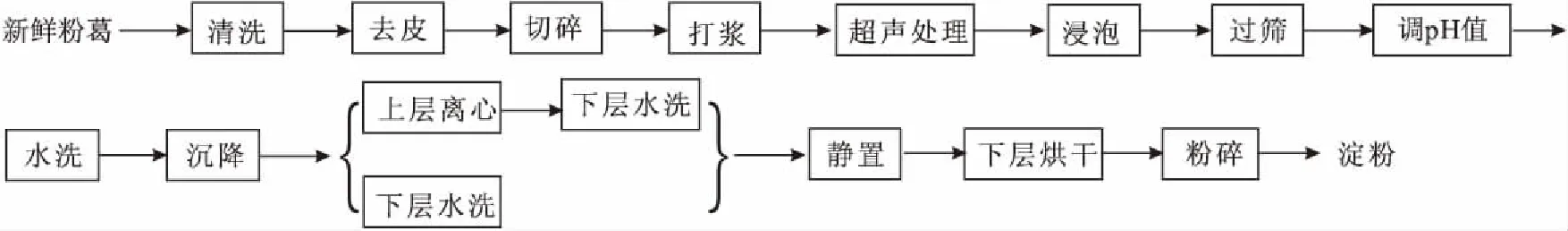
图1 粉葛淀粉的提取工艺流程Fig.1 Extraction process flow of starch from Pueraria thomsonii
1.2.2 秦巴山区粉葛淀粉含量的测定
采用蒽酮-硫酸比色法测定粉葛淀粉含量[6],采用碘显色法测定粉葛淀粉的纯度[7],按下式计算淀粉提取率:

1.2.3 单因素实验
称取秦巴山区新鲜粉葛约20 g,加入石灰水,打浆5 min,于100 W下超声提取,水浴锅中浸泡,考察石灰水pH值(7、8、9、10、11)、料液比(1∶1、1∶2、1∶3、1∶4、1∶5,g∶mL,下同)、超声温度(20 ℃、30 ℃、40 ℃、50 ℃、60 ℃)、超声时间(0 min、10 min、20 min、30 min、40 min)、浸泡时间(0 h、1 h、2 h、3 h、4 h)对粉葛淀粉提取率的影响。
1.2.4 响应面实验设计
在单因素实验的基础上,选择石灰水pH值(A)、料液比(B)、超声时间(C)、浸泡时间(D)4个因素为自变量,以粉葛淀粉提取率为评价指标,采用Design-Expert 8.0.6软件进行分析和统计,优化秦巴山区粉葛淀粉提取工艺。响应面实验的因素与水平见表1。
1.3 粉葛淀粉理化性质的测定
1.3.1 透明度、溶解度、膨胀度、凝沉性及冻融稳定性的测定
参照文献[8]采用紫外分光光度法在620 nm波长下测定粉葛淀粉糊的透光率T(%)。参照文献[9-10]测定粉葛淀粉的溶解度、膨胀度、凝沉性及冻融稳定性。
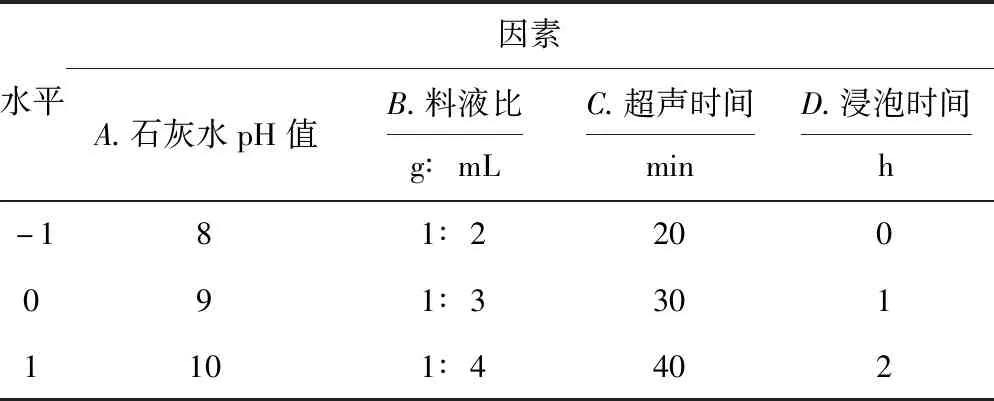
表1 响应面实验的因素与水平
1.3.2 淀粉中黄酮含量的测定
以葛根素为对照品,参照文献[11]采用紫外分光光度法测定粉葛淀粉中黄酮含量。
1.3.3 淀粉颗粒形貌观察及红外光谱分析
用无水乙醇将粉葛淀粉分散处理,用毛细管将样品涂抹于硅片上,干燥后进行镀金处理,用扫描电镜观察粉葛淀粉的颗粒形貌。电压为25 kV,放大倍数2 000倍。
取少量粉葛淀粉与溴化钾混合、研磨后压片,采用傅立叶红外光谱仪在4 000~500 cm-1范围扫描,分辨率4 cm-1,扫描32次。
2 结果与讨论
2.1 单因素实验结果
2.1.1 石灰水pH值对粉葛淀粉提取率的影响(图2)
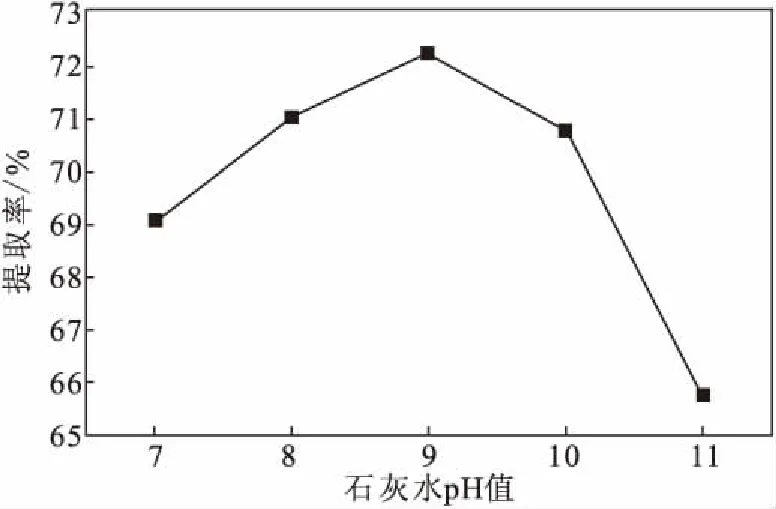
图2 石灰水pH值对粉葛淀粉提取率的影响Fig.2 Effect of whitewash pH value on extraction rate of starch from Pueraria thomsonii
由图2可知,当石灰水pH值在7~9范围内时,粉葛淀粉提取率随着石灰水pH值的增大逐渐升高;当pH>9时,继续增大石灰水pH值,粉葛淀粉提取率反而降低。这可能是由于,一方面石灰水溶液可以降低体系黏度,促进淀粉的沉淀,提高淀粉提取率;另一方面,碱液可以有效地抑制酶的活性,使淀粉的品质更优,但高pH值的碱液会破坏淀粉的结构。故最佳石灰水pH值为 9。
2.1.2 料液比对粉葛淀粉提取率的影响(图3)
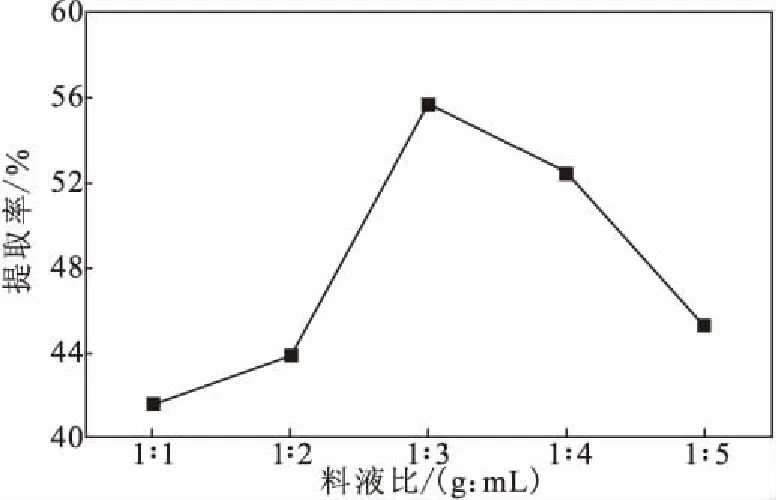
图3 料液比对粉葛淀粉提取率的影响Fig.3 Effect of solid-liquid ratio on extraction rate of starch from Pueraria thomsonii
由图3可知,随着料液比的减小,即提取溶剂用量的增加,粉葛淀粉提取率先升高后降低,当料液比为1∶3时,粉葛淀粉提取率最高;继续增加提取溶剂用量,粉葛淀粉提取率反而降低。这可能是由于,合适的料液比使粉葛完全浸泡,在超声作用下,淀粉能更好地释放;而加大提取溶剂用量,体系内分子间的碰撞减少,超声波气流削弱,淀粉与蛋白质间的氢键作用就会减弱,使得淀粉与蛋白质很难分离,淀粉提取率降低[12]。故最佳料液比为1∶3。
2.1.3 超声温度对粉葛淀粉提取率的影响(图4)

图4 超声温度对粉葛淀粉提取率的影响Fig.4 Effect of ultrasonic temperature on extraction rate of starch from Pueraria thomsonii
由图4可知,超声温度对粉葛淀粉提取率的影响不大,当超声温度为30 ℃时,粉葛淀粉提取率最高;继续升高超声温度,提取率略有降低。这可能是由于,过高的超声温度使部分淀粉糊化。故最佳超声温度为30 ℃。
2.1.4 超声时间对粉葛淀粉提取率的影响(图5)
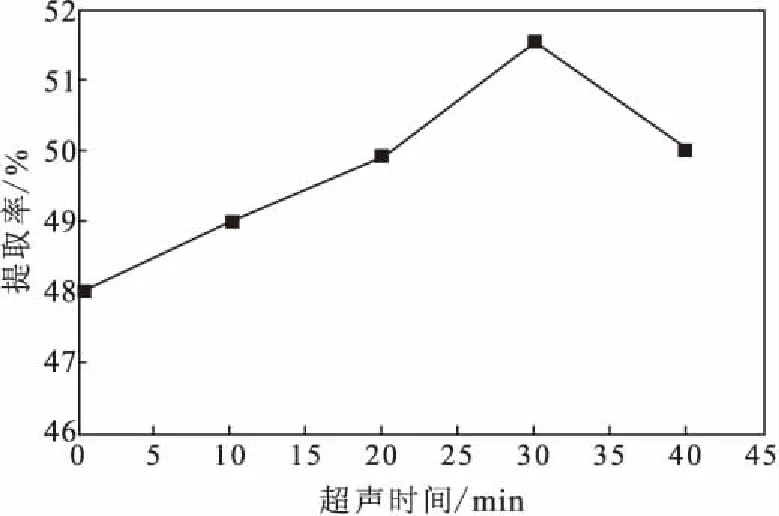
图5 超声时间对粉葛淀粉提取率的影响Fig.5 Effect of ultrasonic time on extraction rate of starch from Pueraria thomsonii
由图5可知,当超声时间为0~30 min时,粉葛淀粉提取率随超声时间的延长逐渐升高;当超声时间超过30 min时,继续延长超声时间,提取率降低。这可能是因为,超声波的振动击碎了内部细胞壁,使淀粉更多地释放;但时间过长,超声波的机械性断键作用加剧了淀粉分子之间的摩擦、碰撞,使得淀粉降解,提取率降低[13]。故最佳超声时间为30 min。
2.1.5 浸泡时间对粉葛淀粉提取率的影响(图6)

图6 浸泡时间对粉葛淀粉提取率的影响Fig.6 Effect of soaking time on extraction rate of starch from Pueraria thomsonii
由图6可知,当浸泡时间为1 h时,粉葛淀粉提取率最高;而延长浸泡时间,粉葛淀粉提取率反而降低。这可能是因为,长时间浸泡使淀粉颗粒结构变得疏松、分散,不利于沉淀;同时微生物活动加剧,淀粉褐变现象愈加严重,影响淀粉白度。故最佳浸泡时间为1 h。
2.2 响应面实验优化粉葛淀粉提取工艺
2.2.1 响应面实验结果(表 2)
2.2.2 回归模型的建立与显著性分析
采用Design-Expert 8.0.6软件对表2数据进行回归分析,得出石灰水pH值、料液比、超声时间、浸泡时间4个因素与粉葛淀粉提取率之间的二次回归方程为:Y=71.41-0.20A-3.82B-0.25C+1.04D-4.26AB-4.06AC+0.91AD+4.47BC+2.23BD+1.43CD-6.69A2-5.83B2-7.67C2-3.90D2。回归方程模型的方差分析见表3。

表2 响应面实验设计与结果
由表3可知,回归模型的F=42.93、P<0.0001,表明方程模型极显著;相关系数R2=0.9772,失拟项的F=5.10,P>0.05,表明失拟不显著,说明回归模型与实测值能较好地拟合,所以该模型可以预测和分析粉葛淀粉的提取效果。一次项因素中, 料液比(B)对淀粉提取率的影响极显著(P<0.01),浸泡时间(D)对其影响显著(P<0.05),石灰水pH值(A)和超声时间(C)对其影响不显著(P>0.05);各二次项都达到了极显著水平;交互项中AB、AC、BC、BD对其影响极显著(P<0.01),而AD、CD影响不显著。由F值的大小可以看出,各因素对粉葛淀粉提取率的影响顺序为:料液比>浸泡时间>超声时间>石灰水pH值。
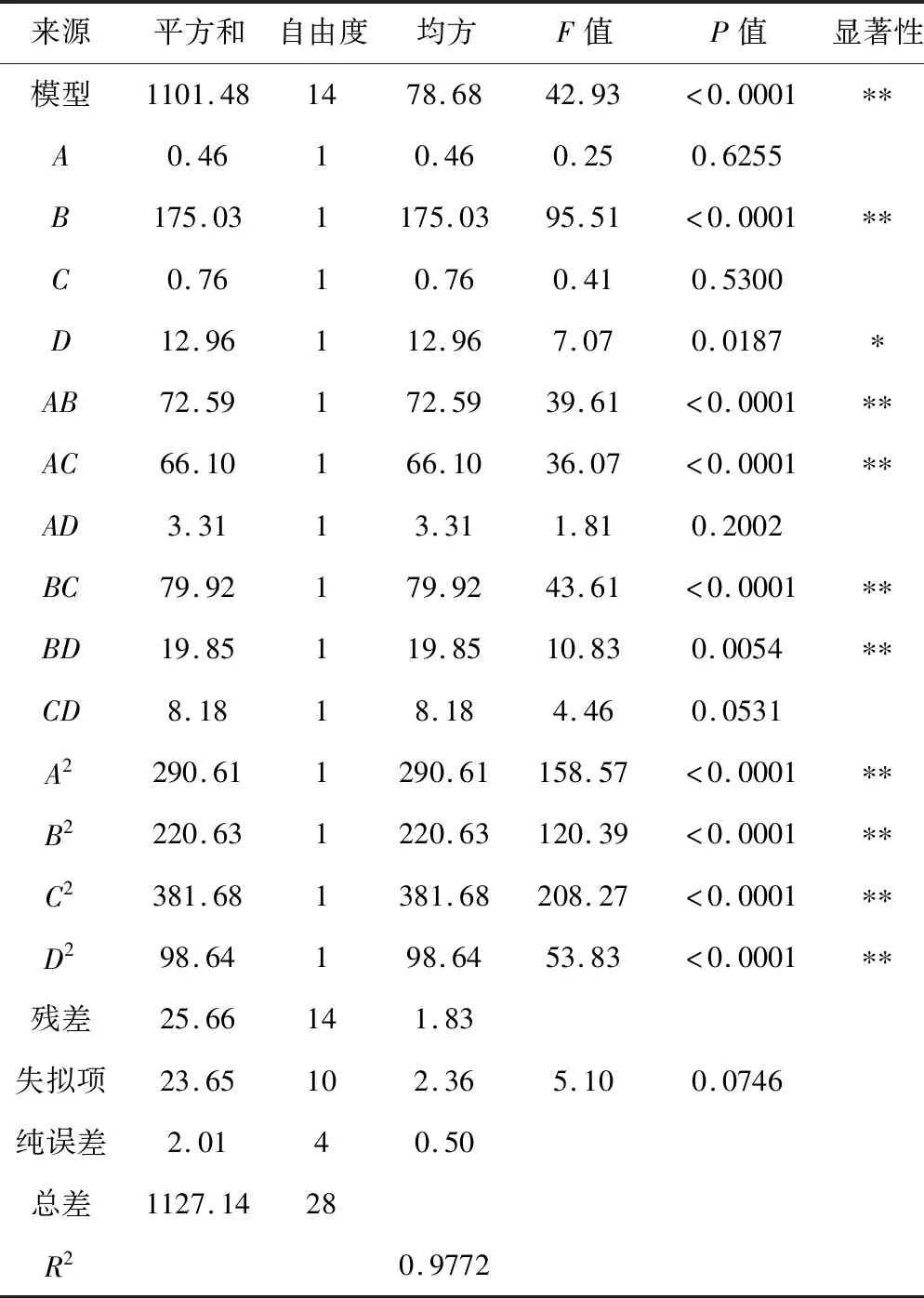
表3 回归方程模型的方差分析
2.2.3 因素交互影响显著性分析
根据实验结果绘制各因素交互作用对粉葛淀粉提取率影响的响应面三维图和等高线图,结果如图7所示。
由图7响应面陡峭程度可以看出,相对于石灰水pH值和超声时间,料液比和浸泡时间对粉葛淀粉提取率的影响更大,这与表3分析结果一致,AB、AC、BC、BD等高线图接近椭圆,说明各因素的交互作用对提取率的影响显著。响应面开口朝下,淀粉提取率随各因素的变化呈先升高后降低的趋势,说明此模型存在最大值的稳定点。对稳定点进行分析,结果如表 4所示。
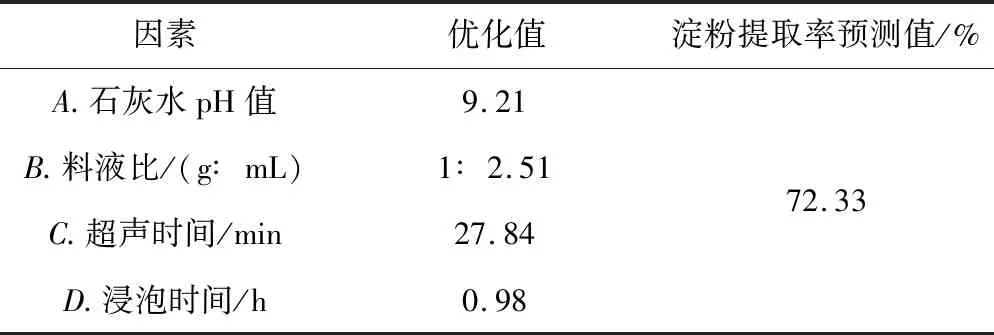
表4 稳定点的规范分析
2.2.4 回归模型的验证
为了检验响应面法所得各优化参数的准确可靠性,对各影响因素的优化值进行验证。考虑到实际操作情况,将最佳条件修正为:石灰水pH值9、料液比1∶3、超声时间28 min、浸泡时间1 h,在该条件下进行3次验证实验,得粉葛淀粉的平均提取率为71.42%,与预测值的相对误差为1.25%,表明该模型有较好的预测性能。
2.3 粉葛淀粉理化性质的测定
2.3.1 不同提取方法对粉葛淀粉透明度与冻融稳定性的影响(表5)

表5 粉葛淀粉的透明度和冻融稳定性
透光率的大小代表透明度的高低,透光率越大,透明度越高。由表5可知,超声波辅助碱法提取的淀粉透明度略高于常规碱法。这可能是因为,在超声波的空穴作用下,淀粉颗粒小部分结晶区破坏,使得直链淀粉更多地溶出,从而使透光率增大[14]。超声波辅助水法提取的淀粉的析水率较高,说明水提得到的淀粉的冻融稳定性不如碱提。

图7 各因素交互作用对粉葛淀粉提取率影响的响应面图和等高线图Fig.7 Response surface map and contour map of effect of interaction between each factor on extraction rate of starch from Pueraria thomsonii
2.3.2 不同提取方法对粉葛淀粉溶解度与膨胀度的影响(图8)

图8 粉葛淀粉的溶解度(a)和膨胀度(b)Fig.8 Solubility(a) and swelling degree(b) of starch from Pueraria thomsonii
由图8可知,随着温度的升高,不同方法提取的粉葛淀粉的溶解度与膨胀度也随之增大。这是由于,温度不断升高,使得淀粉颗粒结构变得松散,破坏程度增大,结晶区中氢键断裂数目增多,游离水更易于渗入淀粉颗粒内部使得溶解度和膨胀度增大[15-16]。
2.3.3 不同提取方法对粉葛淀粉凝沉性的影响(图9)
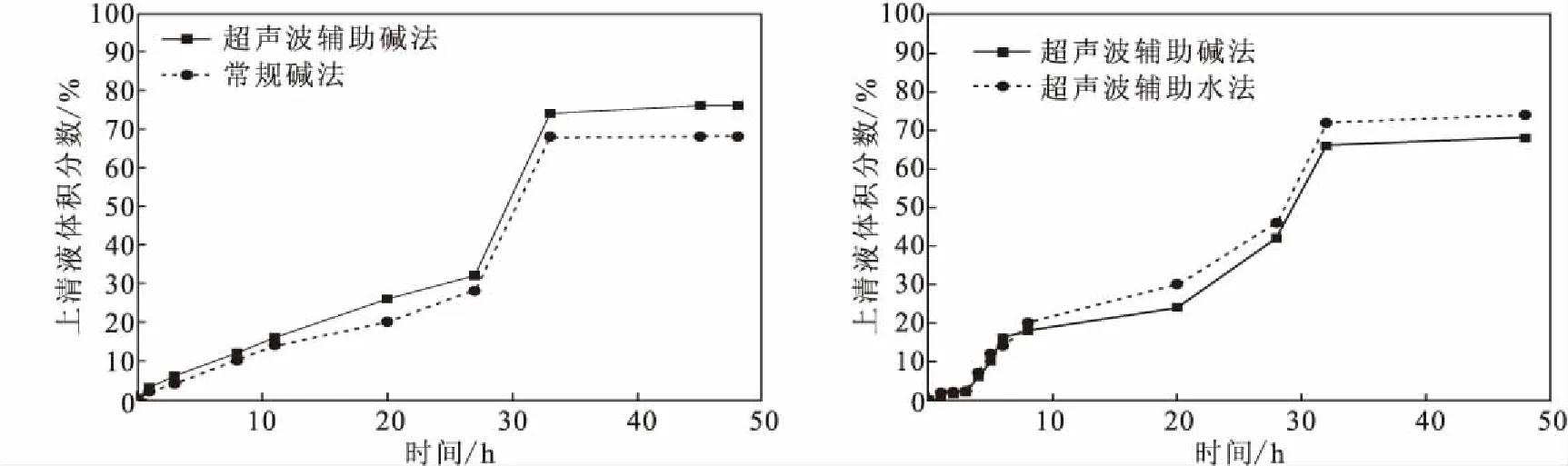
图9 粉葛淀粉的凝沉性Fig.9 Condensation of starch from Pueraria thomsonii
由图9可知,随着时间的延长,粉葛淀粉的凝沉性逐渐增强,静置33 h后,上清液体积分数基本不变,趋于稳定。这可能是因为,糊化后,长时间的静置使体系的温度下降,分子运动变缓,从无序排列向平行有序排列趋近、聚集,使得凝沉性渐渐趋于稳定。超声波辅助碱法提取的淀粉的凝沉性略强于常规碱法。
2.3.4 不同提取方法对粉葛淀粉中黄酮含量的影响(图10)
由图10可知,超声波辅助碱法提取的淀粉中黄酮含量为949.72 mg·(100 g)-1,高于常规碱法和超声波辅助水法。这可能是因为,黄酮分子具有弱酸性,可溶于碱性溶液,因此碱液浸泡过筛后调节pH值至酸性,黄酮可以沉降下来,从而提高了淀粉中黄酮的含量[17]。
2.3.5 不同提取方法对粉葛淀粉颗粒形貌及淀粉结构的影响(图11)
由图11a、11b可知,超声波辅助碱法和常规碱法提取对淀粉颗粒形貌无显著影响,粉葛淀粉大多呈不规则多边形,少数呈卵圆形,颗粒较小。由图11c可知,超声波辅助碱法与常规碱法提取的粉葛淀粉的红外特征峰基本一致,无明显区别,说明超声波作用没有破坏粉葛淀粉的结构。
2.4 讨论
张钟等[5]采用常规碱法提取葛根淀粉,在料液比为1∶4.5、浸泡时间为2.0 h、浸泡液pH值为10.2的条件下,葛根淀粉提取率为83.66%。在实际工业生产中浸泡时间长、料液比小、碱性强,后续处理难度增大及工业成本较高。本研究将超声技术与常规碱法相结合,提取率虽比文献报道的低,但超声波辅助碱法提取有效缩短了浸泡时间,料液比大及弱碱性条件有利于后续处理及降低工业成本,产品色白且纯度高,同时黄酮较大程度地与淀粉一起沉降,所得淀粉中黄酮含量高,使秦巴山区粉葛淀粉实现了日常食用和日常保健的双重利用,充分体现了粉葛食品“药食兼用”的特色和保健作用。
3 结论
以淀粉提取率为评价指标,采用超声波辅助碱法提取秦巴山区新鲜粉葛淀粉,在单因素实验的基础上,采用响应面法优化提取工艺,确定最佳提取条件为:石灰水pH值9、料液比1∶3、超声功率100 W、超声温度30 ℃、超声时间28 min、浸泡时间1 h,在该条件下,秦巴山区新鲜粉葛淀粉的提取率高达71.42%,淀粉纯度达到95%以上。比较了超声波辅助碱法、常规碱法、超声波辅助水法3种提取方法对秦巴山区粉葛淀粉的理化性质的影响。发现,超声波辅助碱法并未改变淀粉颗粒形貌和结构,反而提高了淀粉的透明度和黄酮的保留量,透光率为13.10%,黄酮含量为949.72 mg·(100 g)-1。
