响应面法优化苯酚-硫酸法测定泡桐花多糖含量
2020-07-29吕亭亭杨志华韩永红
吕亭亭,杨志华,韩永红,孟 鑫,陶 娟,刘 旭*
(1.江苏护理职业学院药学与中药学院,江苏 淮安 223005;2.天津中医药大学第一附属医院,天津 300381)
泡桐,属于玄参科泡桐属双子叶植物,其资源丰富,分布广泛,种类繁多,主要是白花泡桐、毛泡桐、光叶泡桐等,在黄河流域被用作传统医药数百年[1]。研究发现,泡桐植物的根、花、叶、皮、果均可入药,具有抗氧化[2]、抗菌[3-4]、抗病毒[5]等药理活性。泡桐花(Paulowniaeflos)即为泡桐的花,主要含有黄酮类、多糖、生物碱、有机酸、氨基酸等活性成分,具有清热解毒、疏风散热、燥湿止痢、清肝明目等功能[6-7]。
近年来研究发现,从泡桐花中提取的多糖,在增强机体免疫功能、抗肿瘤、抗炎、调血脂、降血糖和抗衰老等方面具有显著的生物活性[8-9],受到研究者的广泛关注。现阶段,测定多糖含量的方法主要有色谱法和比色法。色谱法操作繁琐、过程复杂,很少单独用于多糖含量的测定;而苯酚-硫酸法、蒽酮-硫酸法等比色法由于操作简单、实用性强,在多糖研究中应用广泛[10-13]。研究发现,苯酚-硫酸法在稳定性和准确性上均优于蒽酮-硫酸法[14-16]。鉴于此,作者选择苯酚-硫酸法测定泡桐花多糖含量,首先对苯酚-硫酸法测定泡桐花多糖含量的方法学进行验证,然后在单因素实验的基础上,选择苯酚用量、硫酸用量和显色时间为变量进行3因素3水平的Box-Behnken实验设计,通过响应面法进一步优化显色条件,在最佳条件下测定泡桐花多糖含量,以期为泡桐花多糖的开发应用提供检测依据[17-18]。
1 实验
1.1 材料、试剂与仪器
泡桐花,产自河南兰考,将干燥后的泡桐花用多功能粉碎机粉碎成300目,备用。
乙醇、苯酚、硫酸均为分析纯,无锡亚盛化工有限公司。
BF-10型多功能粉碎机,河北本辰科技有限公司;UV1800型紫外可见分光光度计,日本岛津公司;HH-2型数显恒温水浴锅,国华电器有限公司;BSA型电子天平,赛多利斯科学仪器(北京)有限公司;PS-60型超声波清洗器,苏州创惠电子有限公司。
1.2 泡桐花的预处理
称取泡桐花粉末30.0 g,石油醚脱脂[19],过滤,滤渣置于60 ℃烘箱烘干;加入600 mL 80%乙醇加热回流处理,以除去黄酮类物质,过滤,滤渣置于60 ℃烘箱烘干,称定,储存,备用。
1.3 溶液的配制
1.3.1 苯酚溶液的配制
称取苯酚2.5 g,置于50 mL棕色容量瓶中,加蒸馏水在超声辅助作用下溶解,定容,放入冰箱,避光保存,备用。
1.3.2 标准溶液的配制
精密称取适量的无水葡萄糖标准品,加蒸馏水溶解,配制成0.1 mg·mL-1的葡萄糖标准溶液[20-21]。
1.3.3 供试溶液的配制
称取预处理后的泡桐花粉末2.0 g,加入40 mL蒸馏水,称定;70 ℃回流1 h,冷却,再次称定,用蒸馏水补足失重;离心,取20 mL上清液,边搅拌边滴加无水乙醇80 mL,静置20 h;离心,弃去上清液,沉淀用蒸馏水溶解并转移至50 mL容量瓶中,用蒸馏水定容至刻度,摇匀,作为供试储备液。精密量取5 mL供试储备液,置于50 mL容量瓶中,用蒸馏水定容至刻度,摇匀,作为供试溶液。
1.4 苯酚-硫酸法单因素实验
量取2 mL供试溶液,采用苯酚-硫酸法测定多糖含量。分别考察苯酚用量(0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL)、硫酸用量(1.0 mL、3.0 mL、5.0 mL、7.0 mL、9.0 mL)、水浴温度(25 ℃、40 ℃、55 ℃、70 ℃、85 ℃、100 ℃)及显色时间(10 min、15 min、20 min、25 min、30 min)对吸光度的影响。
1.5 苯酚-硫酸法响应面实验
在单因素实验的基础上,选取苯酚用量(A)、硫酸用量(B)、显色时间(C)3个因素为自变量,运用Design-Expert 8.0.6软件进行Box-Behnken设计实验,并应用响应面法对苯酚-硫酸法测定泡桐花多糖含量的条件进行优化。Box-Behnken设计实验的因素与水平见表1。
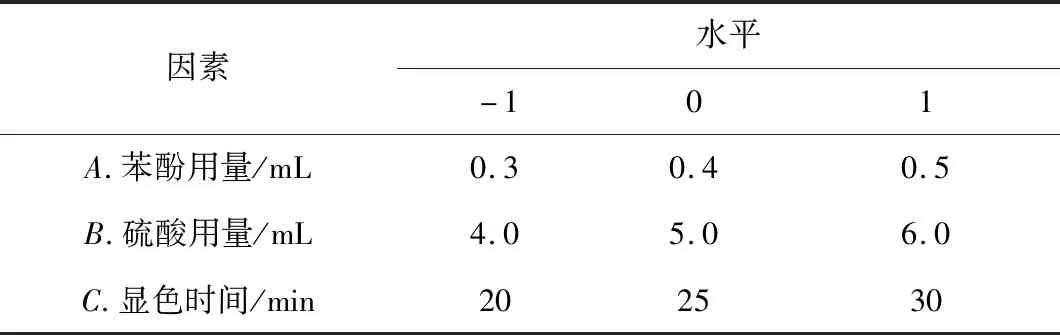
表1 Box-Behnken设计实验的因素与水平
2 结果与讨论
2.1 检测波长的确定
分别量取供试溶液、0.04 mg·mL-1葡萄糖标准溶液和蒸馏水各2.0 mL,置于具塞试管中,按照苯酚-硫酸法显色条件显色,迅速冰浴冷却,用紫外可见分光光度计在400~600 nm波长范围内扫描,测定最大吸收波长,结果如图1所示。

图1 吸光度-波长曲线Fig.1 Absorbance-wavelength curves
从图1可知,泡桐花多糖和葡萄糖标准品最大吸收波长均为490 nm。因此,选择490 nm作为检测波长。
2.2 方法学考察
2.2.1 线性方程与检测范围
精密量取1.0 mL、2.0 mL、4.0 mL、6.0 mL、8.0 mL的0.1 mg·mL-1葡萄糖标准溶液,分别加蒸馏水稀释至10 mL,摇匀。精密量取2.0 mL供试溶液置于具塞试管中,按照苯酚-硫酸法显色条件显色,取出,迅速冰浴冷却;另取2.0 mL蒸馏水同法操作,空白调零,测定溶液在490 nm处吸光度,以葡萄糖浓度(x,mg·mL-1)为横坐标、吸光度(y)为纵坐标绘制标准曲线(图2),拟合得到线性方程y=11.202x+0.0145,R=0.9993。表明,葡萄糖浓度在0.01~0.08 mg·mL-1范围内与吸光度线性关系良好。
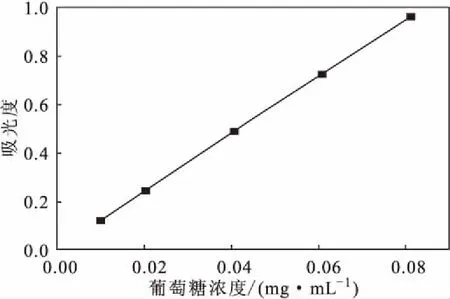
图2 葡萄糖标准曲线Fig.2 Standard curve of glucose
2.2.2 重复性
精密称取6份预处理后的泡桐花粉末2.0 g,按1.3.3方法制备供试溶液,苯酚-硫酸法显色,用紫外可见分光光度计测定490 nm处吸光度,每份样品平行测定3次,计算泡桐花多糖含量及RSD,结果见表2。
从表2可知,泡桐花多糖的平均含量为2.48%,RSD为1.2%,小于1.5%,符合药典规定,表明该方法重复性良好。

表2 重复性实验结果
2.2.3 日间精密度
精密称取预处理后的泡桐花粉末2.0 g,按1.3.3方法每天制备一份供试溶液,共6份,苯酚-硫酸法显色,用紫外可见分光光度计测定490 nm处吸光度,每份样品平行测定3次,计算泡桐花多糖含量及RSD,结果见表3。

表3 日间精密度实验结果
从表3可知,泡桐花多糖的平均含量为2.58%,RSD为1.3%,小于1.5%,符合药典规定,表明该方法日间精密度良好。
2.2.4 加标回收率
精密称取预处理后的泡桐花粉末2.0 g,按1.3.3方法制备供试溶液,再分别加入相当于2.0 g样品中所含葡萄糖50%、100%和150%的标准品,每个浓度平行制备3份样品,苯酚-硫酸法显色,用紫外可见分光光度计测定490 nm处吸光度,每份样品平行测定3次,计算泡桐花多糖的加标回收率及RSD,结果见表4。
从表4可知,泡桐花多糖的加标回收率在98.94%~101.93%之间,低、中、高浓度的RSD分别为1.0%、1.4%、1.2%,符合药典规定,表明该方法准确度良好。
2.2.5 稳定性
精密称取预处理后的泡桐花粉末2.0 g,按1.3.3方法制备供试溶液,分别在0 h、2 h、4 h、6 h、8 h、10 h、12 h取样测定490 nm处吸光度,每份样品平行测定3次,计算得到泡桐花多糖含量分别为2.62%、

表4 加标回收率实验结果
2.61%、2.66%、2.67%、2.64%、2.63%、2.65%,平均含量为2.64%,RSD为0.82%,小于1.5%,表明该供试溶液在0~12 h内稳定。
2.3 苯酚-硫酸法单因素实验结果
2.3.1 苯酚用量对吸光度的影响(图3)

图3 苯酚用量对吸光度的影响Fig.3 Effect of phenol amount on absorbance
从图3可知,苯酚用量在0.2~1.0 mL范围内时,吸光度先增大后减小,在苯酚用量为0.4 mL时,吸光度最大。故最佳苯酚用量为0.4 mL左右。
2.3.2 硫酸用量对吸光度的影响(图4)

图4 硫酸用量对吸光度的影响Fig.4 Effect of sulfuric acid amount on absorbance
从图4可知,硫酸用量在1.0~9.0 mL范围内时,吸光度先增大后减小,当硫酸用量为5.0 mL时,吸光度最大。这是因为,硫酸用量过少时,多糖水解成单糖的程度不充分,导致吸光度偏小;而硫酸用量过大时,生成的糖醛衍生物不稳定、易分解,也会导致吸光度偏小。故最佳硫酸用量为5.0 mL左右。
2.3.3 水浴温度对吸光度的影响(图5)

图5 水浴温度对吸光度的影响Fig.5 Effect of water bath temperature on absorbance
从图5可知,水浴温度在25~100 ℃范围内时,吸光度先增大后减小,当水浴温度为40 ℃时,吸光度最大。故最佳水浴温度为40 ℃。
2.3.4 显色时间对吸光度的影响(图6)
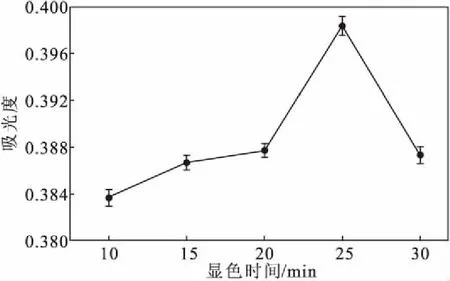
图6 显色时间对吸光度的影响Fig.6 Effect of coloration time on absorbance
从图6可知,显色时间在10~30 min范围内时,吸光度先增大后减小,当显色时间为25 min时,吸光度最大。故最佳显色时间在25 min左右。
2.4 响应面实验结果
2.4.1 Box-Behnken设计结果
采用Box-Behnken设计实验,分别以苯酚用量(A)0.4 mL、硫酸用量(B)5.0 mL和显色时间(C)25 min为中心点,进行3因素3水平优化实验,结果见表5。
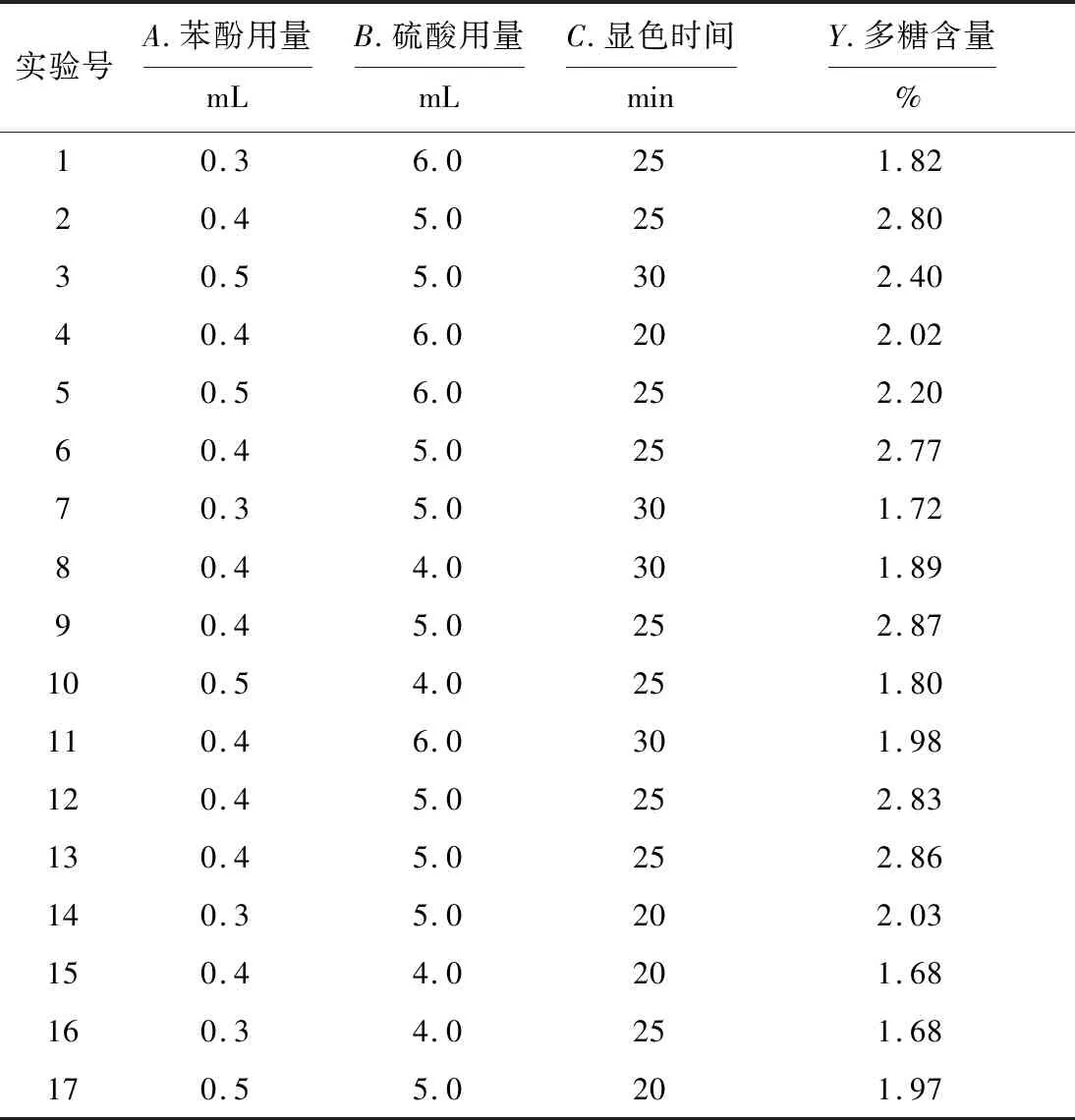
表5 Box-Behnken设计实验结果
2.4.2 响应面实验模型及方差分析
运用Design-Expert 8.0.6软件对表5数据进行拟合,得回归方程模型:Y=2.83+0.14A+0.12B+0.036C+0.065AB+0.19AC-0.063BC-0.41A2-0.54B2-0.39C2。模型方差分析见表6。

表6 响应面实验模型方差分析
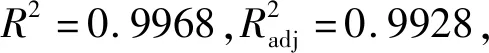
2.4.3 各因素间的交互作用
各因素间的交互作用对泡桐花多糖含量影响的响应面图和等高线图如图7所示。
响应面图中图形陡峭程度越大代表影响越大,反之越小[22]。从图7可知,苯酚用量对泡桐花多糖含量的影响最大,硫酸用量次之,显色时间的影响最小,这与表6的分析结果一致。等高线图呈椭圆形,说明各因素的交互作用显著,呈圆形则为交互作用不显著[23]。从图7还可知,苯酚用量和显色时间之间的交互作用较显著。
2.4.4 最佳条件的确定
通过Design-Expert 8.0.6软件分析,得到苯酚-硫酸法测定泡桐花多糖含量的最佳条件为:苯酚用量0.42 mL、硫酸用量5.12 mL、显色时间25.43 min,在此条件下,泡桐花多糖含量的预测值为2.85%。考虑实际操作等因素,将最佳条件调整为:苯酚用量0.4 mL、硫酸用量5.0 mL、显色时间25 min。
2.5 多糖含量测定
分别称取6份预处理后的泡桐花粉末2.0 g,按1.3.3方法制备供试溶液,在苯酚用量为0.4 mL、硫酸用量为5.0 mL、显色时间为25 min时进行显色反应,每份样品平行测定3次。计算得到泡桐花多糖的平均含量为2.65%,RSD为2.95%,表明优化后的苯酚-硫酸法测定条件稳定可行。
3 结论
对苯酚-硫酸法测定泡桐花多糖含量的方法学进行验证,在单因素实验的基础上,选择苯酚用量、硫酸用量和显色时间为变量进行3因素3水平的Box-Behnken设计实验,通过响应面法进一步优化显色条件,在最佳条件下测定泡桐花多糖含量。确定苯酚-硫酸法测定泡桐花多糖含量的最佳条件为:苯酚用量0.4 mL、硫酸用量5.0 mL、显色时间25 min,在此条件下,泡桐花多糖平均含量为2.65%,RSD为2.95%,与预测值接近,说明优化后的苯酚-硫酸法稳定可靠,更加适用于泡桐花多糖含量的测定。

(a)苯酚用量和硫酸用量的交互作用 (b)苯酚用量和显色时间的交互作用 (c)硫酸用量和显色时间的交互作用
