丹参酮ⅡA对长春新碱诱导神经病理痛大鼠痛觉过敏的影响及其机制
2020-07-28付宝军姜静静黄玉琼林宗航
付宝军,姜静静,黄玉琼,林宗航,李 恒
(广州医科大学附属第六医院/广东省清远市人民医院麻醉科,广东 清远 511518)
长春生物碱类(长春新碱)、杉类(紫杉醇)、铂类(顺铂)等是目前临床常用的抗肿瘤药物,在临床治疗中发挥重要作用。然而,这些药物在抗肿瘤的同时会产生神经损伤毒性作用,诱发痛觉过敏和超敏反应,称化疗诱导的神经病理性疼痛(Chemotherapy-Induced Neuropathic Pain, CINP)简称化疗痛。目前,该疼痛对常规的镇痛药(包括阿片类镇痛药和非甾体抗炎镇药)不敏感,给病人带来极大的痛苦,制约了肿瘤的加量化疗,降低肿瘤的治愈率。因此,开发和寻找针对机制治疗化疗诱导的神经病理性疼痛新药物具用重大意义。丹参酮ⅡA(Tanshinone ⅡA)是从传统中药丹参中提取的脂溶性成分之一,是近年来对中药单体中研究较多、且有明确分子结构的有效活性成分。我们最近研究发现Tanshinone ⅡA在长春新碱诱导的神经病理性疼痛模型中显示明显抗伤害效应[1],但其作用机制仍不清楚。c-Jun N-末端激酶(c-Jun N-terminal kinase, JNK)是丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)家族有三个主要成员之一,通过改变转录和诱导靶蛋白的翻译后修饰,将细胞外刺激转化为细胞内反应。一些证据表明,MAPK通路活化在痛觉信息调制中发挥重要作用,尤其是脊髓中JNK激活促发肿瘤坏死因子-α(tumor Necrosis Factor-α, TNF-α)、白介素-6(interleukin- 6, IL-6)和白介素-1β ( interleukin-1β IL-1β )的产生[2],使背角神经元敏感化,促进慢性疼痛的发生发展,因此提示抑制脊髓JNK激活将有助于抑制慢性疼痛敏感化。作为具有抗炎、抗氧化作用Tanshinone ⅡA是否通过作用JNK信号通路,抑制炎性因子发挥作用,目前报道甚少。本研究建立长春新碱诱导化疗痛模型,在细胞和分子水平探讨星形胶质细胞p-JNK及其炎症反应在Tanshinone ⅡA缓解长春新碱诱导NP可能作用机制,为丹参酮ⅡA用于临床治疗CINP提供理论依据。
1 材料与方法
1.1试剂和药品:Tanshinone ⅡA注射液(生产批号:20180406,江西国药有限公司,中国),兔抗大鼠JNK单克隆抗体 、GFAP单克隆抗体、兔抗大鼠离子钙结合适配器分子1(ionized calcium binding adapter molecule1,Iba1)单克隆抗体(Abcam公司,美国),聚合酶链式反应( polymerase chain reaction,PCR)试剂盒(武汉博士德生物科技有限公司),Trizol RNA 抽提试剂、BeyoR TTM cDNA逆转录试剂盒、ELASA试剂盒(生产批号:69-76215,武汉博士德生物科技有限公司), PCR引物(北京天根生化科技有限公司合成)。热痛刺激仪、von Frey细丝(Stoelting公司,美国)。
1.2实验动物:健康雄性SD大鼠(200~230g)由清远市人民医院实验动物中心提供[动物生产许SYXK(粤)2019-0206]。所有实验操作程序均经清远市人民医院实验动物福利与应用委员会批准,遵守国际卫生学会《实验动物福利和应用指南》。
1.3模型建立及分组:整个实验过程中动物自由摄食和饮水,室温(22±1)℃,光照周期12h(7∶00~19∶00光照;19∶00~7∶00黑暗)。SD大鼠40只,按随机数字表法分为4组:正常对照组、CINP组、CINP+NS组和CINP+Tan组,每组10只。CINP组:建立CINP模型,方法为隔日腹腔注射长春新碱125μg/kg,共计4次,第1次注射当天视为第1天。CINP+NS组和CINP+Tan组:建立CINP模型后于第8天开始连续7d 每天1次腹腔注射生理盐水10uL或丹参酮ⅡA(20mg/kg)。
1.4MWT的测定:用von Frey纤维丝up-down法推算机械性缩足反射阈值(mechanical withdrawal threshold, MWT):将一有机玻璃箱(22cm×22cm×22cm)置于金属筛网上,大鼠在有机玻璃箱中适应15min后,采用ⅡTC2390系列电子von Frey垂直刺激大鼠后肢足底中部,持续时间≤4s,大鼠出现抬足或舔足行为视为阳性反应,每次刺激间隔10s重复5次。给药前和给药后1、3、5、7、9、11、14d分别采用MWT评价大鼠痛觉过敏。
1.5TWL的测定:用热辐射法测定大鼠热缩足潜伏期(thermal withdrawal latency, TWL):将有机玻璃箱置于3 mm厚的玻璃板上, 用热痛刺激仪照射大鼠足底,照射开始至大鼠出现抬腿回避时间为TWL。自动切断时间为25 s,以防止组织损伤。测定5次,每次间隔3 min,取平均值为大鼠TWL值。给药前和给药后1、3、5、7、9、11、14d分别采用TWL评价大鼠痛觉过敏。
1.6Western Blot检测p-JNK、GFAP、Iba1表达: 第14天,每组各取3只大鼠大鼠腹腔注射1%戊巴比妥钠40 mg/kg麻醉后断头处死,冰上取出脊髓腰膨大部位,加入裂解液进行匀浆, 4℃下12000 rpm离心5 min,并进行BCA蛋白定量后每份样品使用20 μg蛋白质。配置12%的分离胶和5%的浓缩胶,浓缩胶电泳条件为80伏恒压,分离胶电泳条件为100伏恒压,当溴酚蓝染料前端电泳至分离胶末端处时即停止电泳,转膜后5%脱脂奶粉封闭2h,加入β-actin(兔抗小鼠,1∶2000),p-JNK,GFAP、Iba1一抗,4℃孵育过夜后TBST洗膜3次,每次10min。加入HRP标记的山羊抗兔IgG(1∶3000)室温孵育2h后TBST洗膜4次,每次10min。ECL化学发光液显色、曝光和显影,采用Image J软件检测目的蛋白条带及β-actin蛋白条带的灰度值,目的蛋白条带灰度值/β-actin蛋白条带灰度值作为目标蛋白表达量。
1.7免疫荧光化学检测脊髓p-JNK和GFAP蛋白:第14天,各组大鼠取3只经腹腔注射1%戊巴比妥钠40mg/kg麻醉后,用4%多聚甲醛灌注固定,取大鼠腰4~6脊髓节段,4%多聚甲醛后固定2h,依次于20%、30%蔗糖溶液中脱水,冰冻切片。免疫荧光染色:磷酸盐缓冲盐水(phosphate buffered saline,PBS) (0.01 moL/L,pH值7.4)洗片3次,20 min/次;加5%羊血清室温封闭2 h;加p-JNK、GFAP一抗,4℃过夜孵育;次日复温至室温后PBS洗3次,15 min/次;分别加入Cy3标记和FITC荧光二抗(1:1 000),室温孵育2 h,PSB洗3次,20 min/次,晾干,封片;切片在共聚焦激光扫描显微镜(FV-1000,Olympus,Tokyo,Japan)下观察,获得图像。
1.8RT-PCR测定脊髓TNF-α、IL-6、IL-1β mRNA:第14天,每组各取3只大鼠安乐死后进行检查。 TRIzol reagent(Invitrogen,美国)提取大鼠L4~6脊髓总RNA,反转录为cDNA。用ΔΔCT 法来测定目的基因mRNA含量。引物由上海生物工程公司合成为:TNF-α上游引物:5'-CACCACGCTCTTCTGTCT-3';下游引物5'-GGGCTTGTCACTCGAGTT-3',IL-6上游引物:5'-CTGCTCTGGTCTTCTGGAGT-3';下游引物5'-GCATTGGA AGTTGGGGTAGG-3', IL-1β 上游引物:5'-TGCACTGCAGGCTTCGAGAT-3';下游引物5'- CCAAGGCCACAGG GATTTTG-3'。β - actin上游引物:5'-CGTTGACATCCGTAAAGACCTC-3';下游引物:5'-TAGGAGCCAGGGC AGTAATCT-3'。扩增条件:94℃预变性5min,94℃ 30s,54℃30s,72℃ 20s,共45个循环,72℃延伸10min。计算目的基因与内参照β-actin的比值作为目的基因的相对表达量。
1.9ELISA检测脊髓TNF-α、IL-6、IL-1β含量变化:L4~L6脊髓节段匀浆后于4℃,3500r/min下离心10min(离心半径为5cm),提取上清液并在-80℃保存。按ELISA测定试剂盒说明书步骤进行操作。采用NK3酶标仪于波长490nm处测定光密度值,对应标准曲线得出TNF-α、IL-6、IL-1β的含量。

2 结 果
2.1各组大鼠MWT和TWL的变化 与Control组比较,CINP组大鼠在给药后3d到本实验观察结束MWT [3d:(11.8±0.8)g;5d:(9.3±0.8)g;7d:(7.7±1.0)g;9d:(8.7±0.7)g;11d:(8.3±1.0)g;14d:(7.7±0.6)g]和TWL [3d:(12.2±0.8)s;5d:(9.3±0.8)s;7d:(8.2±1.1)s;9d:(8.8±0.8)s;11d:(8.6±1.1)s;14d:(8.3±1.1)s]明显降低(P<0.01);与CINP+NS组相比,CINP+Tan组大鼠在给药后9、11、14d MWT[9d:(10.6±0.5)g;11d:(10.8±0.7)g;14d:(10.6±0.9)g]和TWL[9d:(11.0±1.0)s;11d:(11.2±1.3)s;14d:(10.8±0.8)s]明显增加(P<0.01)(见图1)。各腹腔给药组对大鼠运动功能均无影响。

图1 各组大鼠TWL和MWT变化
2.2各组大鼠脊髓p-JNK、GFAP、Iba1蛋白表达:与Control组比较,CINP组大鼠脊髓背角p-JNK(1.70±0.10)、GFAP(1.71±0.12)表达明显增加(P<0.01);与CINP+NS组相比,CINP+Tan组大鼠脊髓背角p-JNK(1.25±0.20)、GFAP(1.24±0.16)表达明显降低(P<0.05);各组大鼠脊髓小胶质细胞标志物Iba1表达差异无统计学意义,见图2。

图2 各组大鼠脊髓p-JNK、GFAP、Iba1蛋白表达
2.3各组大鼠脊髓炎性细胞因子TNF-α、IL-6、IL-1β蛋白表达:与Control组比较,CINP组大鼠脊髓背角TNF-α(250±31)pg/mg、IL-6(220±25)pg/mg、IL-1β(170±36)pg/mg蛋白表达明显增加(P<0.01);与CINP+NS组相比,CINP+Tan组大鼠脊髓背角TNF-α(150±20)pg/mg、IL-6(120±22)pg/mg、IL-1β(123±28)pg/mg蛋白表达明显降低(P<0.05),见图3。

图3 各组大鼠脊髓炎性细胞因子TNF-α、IL-6、IL-1β蛋白表达
2.4各组大鼠脊髓背角炎性细胞因子TNF-α、IL-6、IL-1β miR 表达的变化:与Control组比较,CINP组大鼠脊髓背角TNF-α(1.70±0.14)、IL-6(1.73±0.12)、IL-1β(1.72±0.15)miR 表达明显增加(P<0.01);与CINP+NS组相比,CINP+Tan组大鼠脊髓背角TNF-α(1.32±0.11)、IL-6(1.33±0.10)、IL-1β(1.68±0.13)miR表达明显降低(P<0.05),见图4。
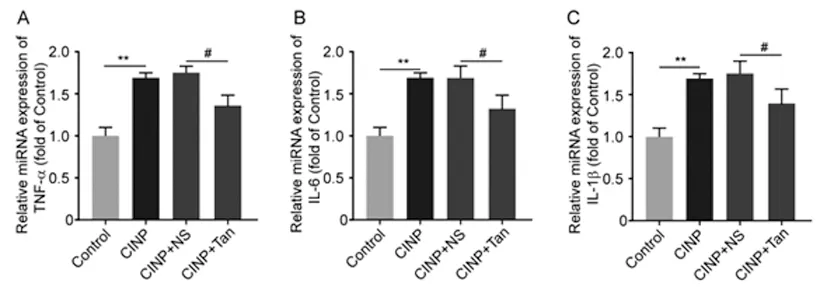
图4 各组大鼠脊髓炎性细胞因子TNF-α、IL-6、IL-1β miRNA表达
2.5CINP大鼠脊髓背角JNK与GFAP共定位表达,见图5。
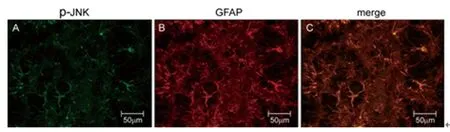
图5 CINP大鼠脊髓背角磷酸化JNK与GFAP共定位表达
3 讨 论
本研究制备的长春新碱诱导神经病理性疼痛大鼠模型,该模型的优点是操作简单,稳定性好,与临床CINP特征有相似之处。研究结果表明,CINP大鼠从长春新碱注射后3d MWT和TWL开始明显降低,7d稳定并持续维持到本实验观察结束,表明CINP模型成功建立;相反丹参酮ⅡA腹腔注射大鼠MWT和TWL明显升高。丹参酮ⅡA因其抗氧化和抗炎作用已广泛应用于心脑血管疾病、肿瘤等疾病治疗,并且最近丹参酮ⅡA的抗伤害性作用已在糖尿病致神经损伤疼痛模型中得到证实[3];更重要是我们前期实验证实,丹参酮ⅡA明显抑制化疗诱导的神经病理性疼痛大鼠痛觉过敏,并呈剂量依赖性,在前期研究使用3个不同剂量丹参酮ⅡA(10mg/kg、20mg/kg、50mg/kg)腹腔注射CINP大鼠,结果发现,20mg/kg、50mg/kg剂量丹参酮ⅡA产生明显抗伤害作用且均无毒副作用发生[4]。本实验选择20mg/kg丹参酮ⅡA腹腔注射,探讨丹参酮ⅡA在CINP模型抗痛觉过敏作用机制。
已有研究表明,胶质细胞(主要分为小胶质细胞和星型胶质细胞),尤其星形胶质细胞在化疗药物诱导神经病理痛中扮演重要角色[5]。Wahlman等[6]研究表明,增强脊髓腺苷激酶水平通过星形胶质细胞依赖机制促进化疗诱导的疼痛;相反,Hao等[7]研究发现,华蟾素抑制TRPV1上调和脊髓星形胶质细胞活化对奥沙利铂诱导的周围神经病理性疼痛大鼠的产生保护作用。以上证据提示,抑制脊髓星形胶质细胞活化可能与药物或激活内源性激酶有效缓解化疗药物诱导神经病理痛作用机制相关。我们结果表明,丹参酮ⅡA腹腔注射抑制痛觉过敏同时伴有星形胶质细胞活化明显减少,但通过检测另一类重要胶质细胞小胶质细胞标志物Iba1表达显示丹参酮ⅡA腹腔注射后小胶质细胞活化未受影响,然而最近yan等[8]研究证实,小胶质细胞释放白介素-1增强谷氨酸活性参与紫杉醇诱导痛觉过敏,与我们实验结果差异或许源于动物模型、观测时间点、动物种属不同。总之,我们实验结果提示,星形胶质细胞活化作为丹参酮ⅡA抑制化疗药物诱导痛觉过敏可能作用机制。普遍认为星形胶质细胞活化后释放炎性因子,炎性因子敏化脊髓感觉神经元,导致中枢敏化。已有研究表明,炎性细胞因子在化疗药物诱导神经病理痛发生发展中发挥重要作用;Mazidi等[9]研究表明,阻断细胞因子信号转导减轻紫杉醇诱导的神经病理痛大鼠痛行为学;另有研究发现[10],吴茱萸碱通过抑制炎症和维持线粒体抗氧化功能来改善紫杉醇诱导的神经病理性疼痛,以上提示抑制或阻断脊髓水平炎性细胞因子可能有效缓解化疗药物诱导神经病理痛,我们结果表明,丹参酮ⅡA腹腔注射抑制痛觉过敏同时伴有脊髓TNF-α、IL-6、IL-1β表达明显下调。提示丹参酮ⅡA缓解化疗药物诱导神经病理痛与脊髓炎症反应密切相关。
c-Jun N-末端激酶(JNK)是MAPK家族有三个主要成员之一,其调控作用在内脏炎性疼痛动物模型中已经证实,但其在化疗药物诱导神经病理痛中作用报道甚少。最近研究[11]表明,紫杉醇诱导脊髓星形胶质细胞活化和神经病理性疼痛,可能通过脊髓背角ERK1/2和JNK通路下调胶质细胞GLT-1的表达来实现的;与其报道相一致,我们研究表明,与CINP组比较,丹参酮ⅡA腹腔注射抑制痛觉过敏同时伴有脊髓p-JNK表达下调,同时免疫荧光共定位结果提示CINP组大鼠脊髓p-JNK与星形胶质细胞标志物GFAP蛋白共定位,我们结果提示,腹腔注射丹参酮ⅡA通过抑制星形胶质细胞JNK通路活化缓解化疗药物诱导神经病理痛。尽管我们初步证实:星形胶质细胞JNK通路活化在丹参酮ⅡA缓解化疗药物诱导神经病理痛作用机制中作用,但是本实验无法确定星形胶质细胞JNK通路活化与脊髓TNF-α、IL-6、IL-1β表达的因果关系,还有待实验进一步证实。
总之,在本实验条件下腹腔注射丹参酮ⅡA明显抑制长春新碱诱导神经病理痛大鼠痛觉过敏,其作用机制可能与星形胶质细胞JNK通路活化及其炎症反应相关。
