产脂肪酶乳酸菌对羊肉发酵香肠脂肪酸的影响
2020-07-25张开屏田建军景智波曹凯慧马牧然马俊杰
张开屏,田建军,景智波,曹凯慧,马牧然,马俊杰,靳 烨
(1. 内蒙古商贸职业学院食品工程系,呼和浩特 010070; 2. 内蒙古农业大学食品科学与工程学院,呼和浩特 010018;3. 内蒙古伊利实业集团股份有限公司 呼和浩特 010110)
0 引 言
发酵香肠是指在一定的控制条件下,通过微生物发酵使香肠pH值下降,水分活度降低而制成的一类风味独特的肉制品[1]。发酵香肠的制作过程主要包括腌制、发酵、干燥和成熟 4个阶段,其中成熟阶段是发酵香肠特征风味物质形成的重要阶段[2]。Marco等指出,发酵肉制品的风味物质主要包括了醛类、酮类、醇类、酯类、酸类、含硫化合物、呋喃类以及芳香族化合物等[3],Calkins等指出这些物质的来源是通过脂肪的水解氧化、蛋白质的降解、硫胺素的降解、酯化反应和微生物的作用而得到[4],但在这些反应当中,脂肪的水解氧化和蛋白质的水解作用占主导地位[5]。
脂肪是发酵香肠的主要成分,在发酵香肠加工中脂类物质的变化主要表现在脂肪的水解和氧化。这两种反应存在着一定的联系,在脂肪水解反应中产生的游离脂肪酸,成为脂肪氧化反应的重要底物,是发酵香肠重要的风味前体物质之一[6]。Waade等通过添加葡萄球菌来生产发酵香肠,发现添加发酵剂后不饱和脂肪酸含量增加,远高于饱和脂肪酸含量[7]。Lorenzo等发现在发酵香肠加工过程中,在发酵和成熟过程中脂肪酸有明显的逐渐释放的现象,而成熟以后各组脂肪酸含量并无显著差异[8]。Xiao等研究发现微生物对发酵肉制品中单不饱和脂肪酸的组成有一定的影响[9]。郭壮等研究发现乳酸菌对腊肠的发酵成熟和风味品质的形成有着至关重要的作用[10];Zalacain等在发酵香肠中添加外源脂酶,发现脂酶可促改变游离脂肪酸组成,试验组的香肠脂肪酸总量略有增长,不饱和脂肪酸含量显著增加[11]。如今微生物脂肪酶已从细菌属中广泛分离,如芽孢杆菌,葡萄球菌,假单胞菌等[12-13]。脂肪酶会影响发酵肉制品生产过程中脂肪酸的释放速度及其组成比例,且在发酵香肠加工过程中不饱和脂肪酸释放速度大于饱和脂肪酸。
本文通过中性红平板培养基变色反应、三丁酸甘油酯透明圈直径测试,对试验菌株进行产脂肪酶能力测试,同时分析比较不同产酶能力菌株中脂肪酶基因Lip0069、Lip0893表达量的变化情况,筛选出产脂肪酶能力较高的乳酸菌TR1-1-3。以菌株TR1-1-3调制发酵剂来制作发酵香肠,以自然发酵ZR组、添加脂肪分解酶M组、产脂肪酶中等和弱的菌株ZF22和ZF19组为对照,分别在发酵香肠制备过程中0、2、4、6、12、24 d取样,分析了不同发酵阶段乳酸菌对发酵香肠中脂肪酸组成的影响。
1 材料与方法
1.1 试验材料
1.1.1 材 料
试验乳酸菌菌株由内蒙古农业大学肉品科学与技术团队提供。培养基:MRS、TPY培养、中性红油脂平板、富集培养基、发酵产酶培养基均参照文献[14]执行。
原料肉:羊肉(内蒙古草原金鑫食品有限公司提供,肥瘦比为1∶4)。肠衣:市售25 mm 羊小肠。
1.1.2 药品试剂
37种脂肪酸甲酯混标,美国 Sigma 公司。DNA试剂盒,蛋白酶K,天根试剂公司。Taq-DNA聚合酶,dNTP Mix,DNA Marker,溶菌酶,北京全式金生物技术有限公司。对硝基苯酚酯,Sigma公司。RNA试剂盒,反转录试剂盒,TB GreenTM Premix Ex Taq™ II 定量试剂盒,大连宝生物公司。甲醇、无水硫酸钠、焦性没食子酸、正己烷、氢氧化钠等均为分析纯。
1.1.3 仪器设备
ISQ型GC-MS联用仪,美国Thermo公司。Eppendorf 5810R台式高速冷冻离心机,德国艾本德公司。LightCycler® 96 SW 1.1 实时定量PCR仪,上海罗氏有限公司。凝胶成像系统,美国 Bio-rad。NanoDrop2000核酸蛋白分析仪,美国 Thermo Fisher Scientifc 公司。
1.2 试验方法
1.2.1 产脂肪酶菌株的筛选
用TPY液体培养基活化试验菌株三代,镜检保证其纯度,再37 ℃富集培养48h,得到富集培养液。参照文献,通过中性红平板变色法和三丁酸甘油酯透明圈法判定菌株的产脂肪酶能力[15-16]。
1.2.2 菌株脂肪酶相关基因表达量的测定
1)普通PCR扩增
依据菌株TR1-1-3全基因组测序结果[17],Lip0069、Lip0893分别为编码脂肪酶的基因,由上海美吉生物公司设计相应引物,提取菌株TR1-1-3的DNA为模板,采用相应引物进行普通PCR,用质量分数1%琼脂糖凝胶电泳检测扩增后的产物并测序,从而判断菌株中是否含有脂肪酶基因。
普通PCR扩增基因Lip0069:正向引物:5′-GAC TGA TTG TAG GAG TTC CA-3′;反向引物:5′-TTG TGC CTA TCT CCT TGT TT-3′,长度764bp。Lip0893正向引物:5′-CGA TCT TGA TAC TTA GTC ATC C-3′;反向引物:5′-GTT CTT AAC ATC AGA CTA CTG G-3′,长度1 250 bp。
普通 PCR反应体系:模板 DNA 2.0μL、上游引物1.0μL、下游引物 1.0μL、2×Taq PCR Mix 12.5μL、R Nase Free dH2O 8.5μL[18]。
2)RNA的提取及cDNA的合成
采用细菌 RNA试剂盒提取菌株 RNA,经核酸蛋白分析仪与琼脂糖凝胶电泳检测被提取总RNA的纯度与含量。cDNA使用反转录试剂盒两步法将RNA样品进行反转录,置于−20 ℃保存、待用。
3)荧光定量PCR检测
依据TB GreenTM试剂盒说明书设定荧光定量PCR程序和试剂配制。Lip0069,Lip0083为试验基因,以核糖体18S rRNA为参考基因,以cDNA为模板,在 Light Cycler® 96 SW 1.1 仪中对目的基因及参考基因进行相对定量 PCR 扩增,检测供试菌株中脂肪酶基因的表达量。引物序列见表1。
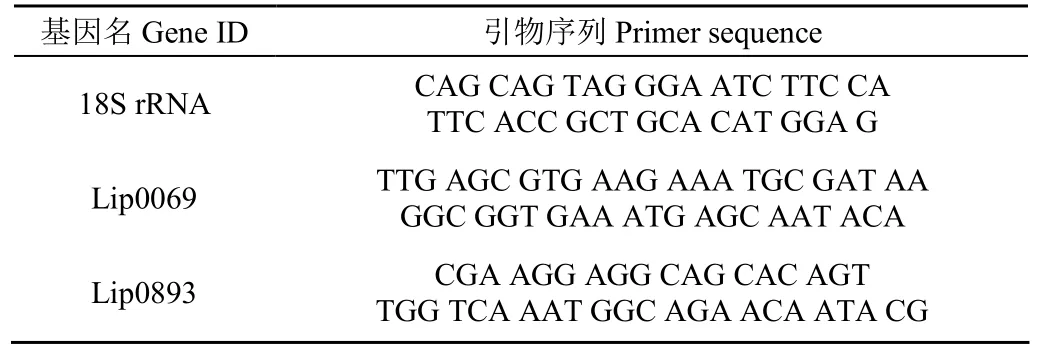
表1 实时定量PCR引物Table 1 Primers of real-time quantization PCR
反应体系:TB GreenTMPremix Ex Taq™ II 12.5μL、上游引物 1.0μL、下游引物 1.0μL、cDNA 模板 2.0μL、R Nase Free dH2O 8.5μL;反应条件为:95 ℃预变性 30 s,95 ℃变性 5 s,55 ℃退火 30 s,95 ℃延伸 15 s,共 40 个循环,60 ℃延伸30 s,4 ℃保存待测[19]。
实时荧光定量数据处理方法:本试验采用的是相对表达量,计算方法选用2-ΔΔCt。
1.2.3 香肠工艺
参照文献[20],略有改动。配料:瘦肉 75%、肥膘25%、蔗糖 0.5%、葡萄糖 0.5%、食盐 2.5%、亚硝酸钠100 mg/kg、抗坏血酸0.05%、发酵剂108CFU/g。工艺流程:原料肉→瘦肉绞碎,肥肉切丁→搅拌腌制(4 ℃,12 h)→灌肠→排气→发酵(湿度90%~95%,25 ℃,48 h)→干燥(湿度85%,15 ℃,48 h)→成熟(湿度75%,12 ℃,48 h)→成品贮藏(4 ℃,6~24 d)。
1.2.4 香肠的分组
以产脂肪酶能力强的2株乳酸菌TR1-1-3和ZF22分别调制发酵剂来制作发酵香肠,分别以自然发酵ZR组、添加脂肪分解酶M组、产脂肪酶弱的菌株ZF19组为对照,分别在发酵香肠制备过程中 0、2、4、6、12、24 d取样,分析不同发酵阶段乳酸菌对发酵香肠中脂肪酸组成的影响。
1.2.5 脂肪酸的测定
取不同阶段的发酵香肠去除肠衣后,液氮研磨至颗粒粉末,取0.4~0.5 g肉样于50 mL离心管中,依据《食品中脂肪酸的测定:GB5009.168-2016》中所述方法进行脂肪酸测定[21]。
色谱条件:色谱柱,柱长100 m,内径250μm,膜厚0.2μm;进口温度与检测器温度分别为250 和280 ℃;高纯氮气为载气;分流比9:1;进样量1.0μL;升温程序:初始温度120 ℃,持续5 min;150 ℃,升温速率1.5 ℃/min,28 min;220 ℃,升温速率 1.5 ℃/min,10 min。
1.2.6 数据处理与统计方法
结果以平均值±标准差(χ±SD)表示,试验数据采用Excel 2016 进行整理,采用统计软件 SPSS 22.0进行oneway ANOVA分析,P<0.05为差异显著。
2 结果与分析
2.1 产脂肪酶菌株的筛选
2.1.1 产脂肪酶乳酸菌初筛试验
经前期菌株生理生化特性分析,选取了10株产生物胺阴性、对大肠杆菌和金黄色葡萄球菌均有一定的抑制作用、具有耐盐及耐亚硝酸盐特性、且具有降胆固醇能力的乳酸菌,进行产脂肪酶初筛试验。通过观察中性红平板变色情况,首先定性分析菌株是否具有产脂肪酶能力,试验结果如表2所示。
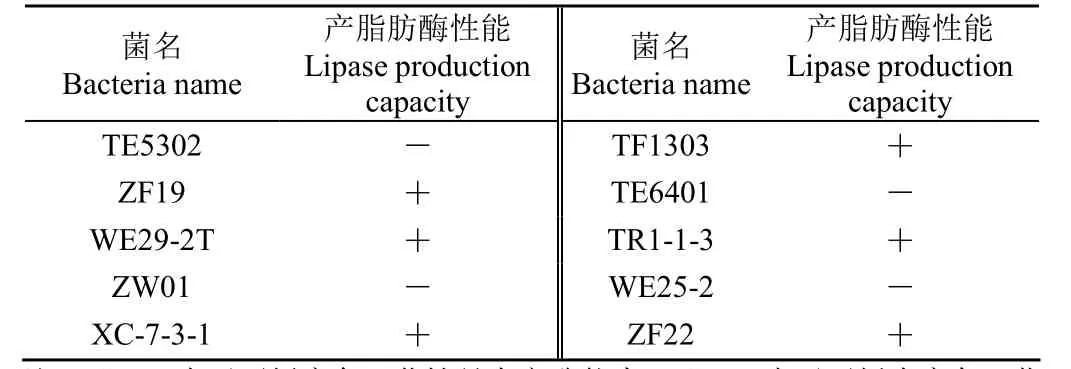
表2 产脂肪酶定性试验Table 2 Qualitative test of lipase production
根据表 2中性红平板的变色情况可知,TE5302、ZW01、TE6401和WE25-2并未使中性红平板变色,表明这 4株菌没有产脂肪酶的能力或产脂肪酶的能力较弱。WE29-2T、XC-7-3-1和TF1303、TR1-1-3以及ZF19使培养基颜色发生变化,即菌株在代谢过程中产生的脂肪酶能够分解橄榄油产酸,使培养基颜色发生变化。因此对这6株菌进行产脂肪酶复筛试验。
2.1.2 产脂肪酶乳酸菌复筛试验
将能使中性红平板变色的 6株乳酸菌活化,接种到三丁酸甘油酯平板中,观察菌株分解三丁酸甘油酯产生的透明圈大小,定性判断菌株产脂肪酶活力的大小。试验结果如表3所示。
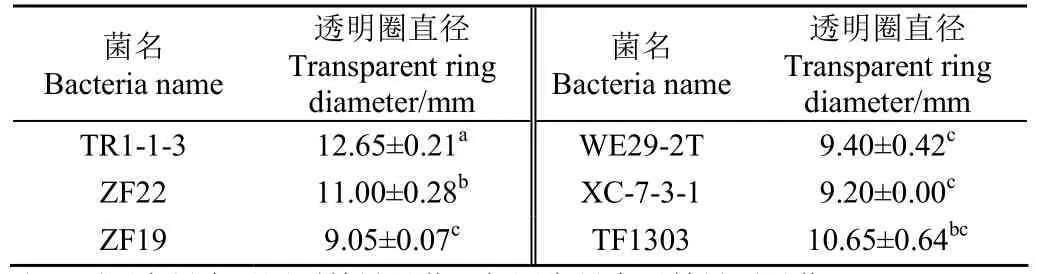
表3 乳酸菌产脂肪酶能力试验Table 3 Lipase production capacity test of lactic acid bacteria
观察菌株代谢过程中分解三丁酸甘油酯所产的透明圈直径范围为 9.05~12.65 mm,透明圈直径平均为10.33 mm。其中瑞士乳杆菌TR1-1-3、ZF22分解三丁酸甘油酯所产的透明圈直径分别为(12.65±0.212 )和(11.00±0.28)mm,透明圈直径显著高于其他菌株(P<0.05),因此定性确定TR1-1-3、ZF22产脂肪酶活力显著高于其他试验菌株,且TR1-1-3产酶活力最强。
2.2 菌株脂肪酶相关基因表达量测定分析
2.2.1 普通PCR结果
以试验菌株提取的DNA为模板,用各基因相应引物进行普通PCR扩增,扩增后的产物用1.0%琼脂糖凝胶电泳检测,结果如图 1所示。条带从左到右依次为扩增Lip0069、Lip0893基因的产物片段。由图可知,各基因目的条带清晰明亮,产物单一,大小分别为764、1 250 bp将目的基因的片段与DL2000DNA Marker比较,其大小一致,说明获得预期产物,引物反应性能良好,符合试验要求,同时说明菌株中含有此功能特性基因。
2.2.2 菌株脂肪酶相关基因表达量分析
选取来自不同种属和相同种属的脂肪酶活性高低不同的菌株,MRS培养基37 ℃培养24 h提取RNA,进行脂肪酶相关基因(Lip0069、Lip0893分别为编码脂肪酶的基因)表达量的测定,以此从基因角度分析验证菌株产脂肪酶活性的原因所在,具体测定如图2所示。
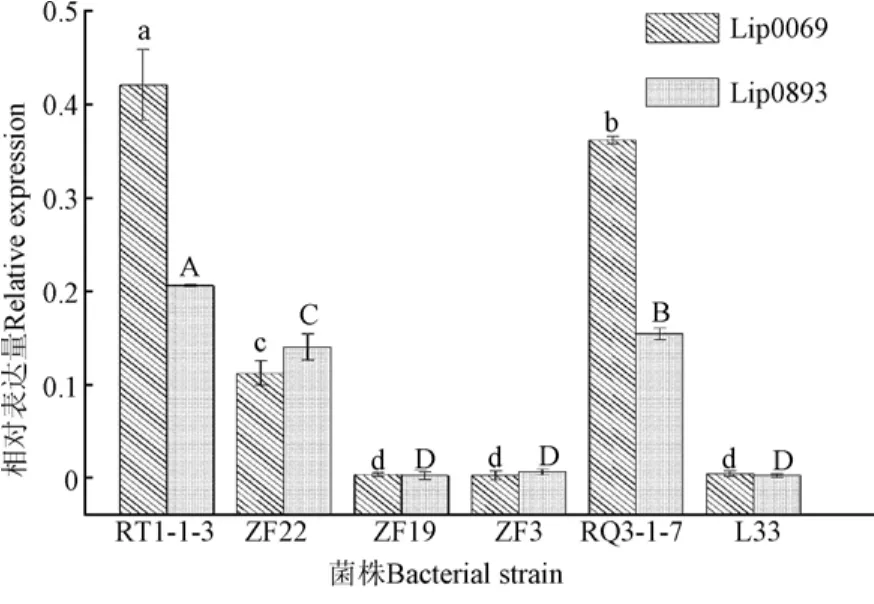
图2 菌株脂肪酶基因的相对表达量Fig.2 Relative expression of lipase gene in the strain
由图2可知,菌株TR1-1-3在MRS培养基中37 ℃培养24 h后,脂肪酶相关基因Lip0069、Lip0893的相对表达量分别为(0.421±0.038)、(0.206±0.001),2种脂肪酶基因表达量显著(P<0.05)高于其他菌株,TR1-1-3、ZF22、ZF19基因表达量与其菌株酶活性的测定结果一致,Lip0069、Lip0893基因相对表达量较高的菌株其脂肪酶活性也较高,同时试验菌株中TR1-1-3菌株表达量高于 RQ3-1-7。Meghwanshi等分析结果表明,乳酸菌中产脂肪酶活性较高的菌株主要存在于乳杆菌属中[22]。
2.3 乳酸菌对脂肪酸组成的影响
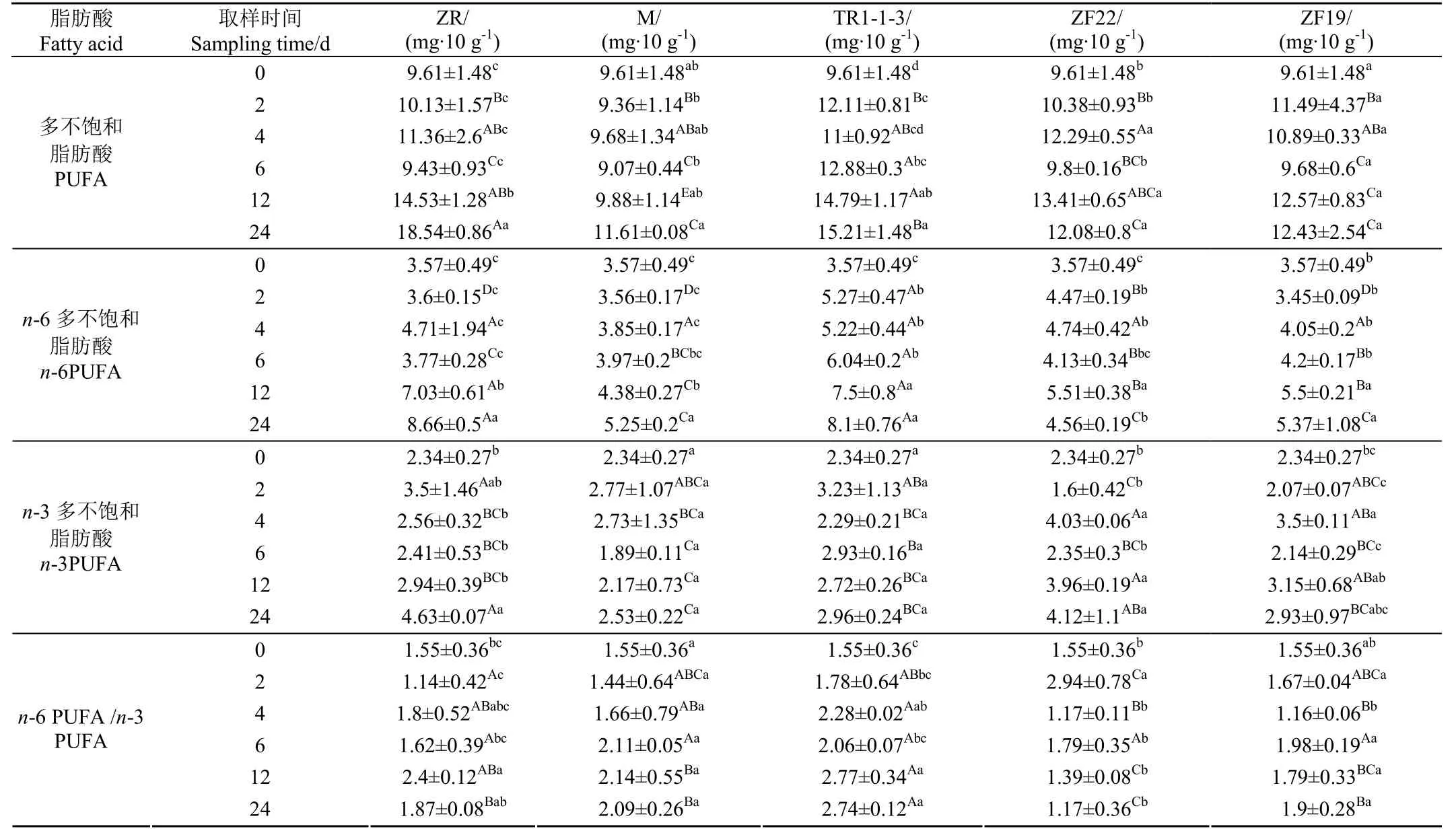
脂肪酸的含量及其在全部脂肪酸中所占比例如表 4所示,发酵过程不同时间段样品中饱和脂肪酸(Saturated Fatty Acids, SFA)、单不饱和脂肪酸酸(Monounsaturated Fatty Acids, MUFA)和多不饱和脂肪酸(Polyunsaturated Fatty Acids, PUFA)的含量如表5、6、7所示。
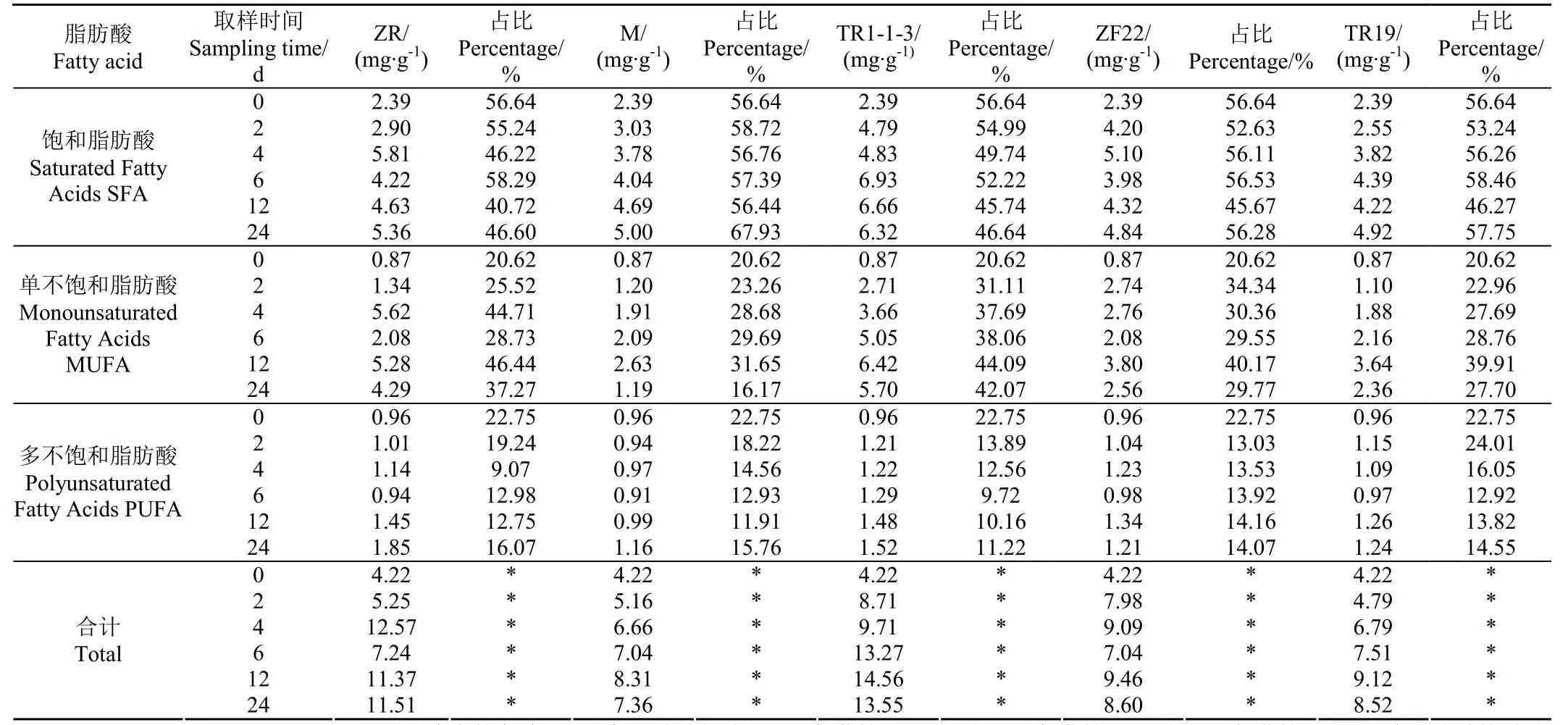
表4 脂肪酸的含量及其占比Table 4 Fatty acid content and its proportion
由表4可知,香肠在发酵和4 ℃低温冷藏阶段,SFA、MUFA和PUFA的含量均表现为上升趋势,其中24 d时,ZR和TR1-1-3中SFA的含量增加了但是在脂肪酸中所占比例却有所下降,ZR和TR1-1-3均从0 d的56.6%下降到24 d的46.6%,而添加酶制剂的M组SFA的百分比含量从0 d的56.6%上升到了67.9%,其他组别 SFA的占比变化不明显。24 d时 ZR、TR1-1-3、ZF22和ZF19组中MUFA的含量和占比均有所上升,且TR13增幅最大,仅M组中MUFA的占比表现为下降趋势。
2.3.1 乳酸菌对饱和脂肪酸的影响
饱和脂肪酸SFA的测试结果如表5所示。由表5可知,试验组检测到的 SFA共有 16种,碳原子数小于 6的短链脂肪酸没有检测到,碳原子数为 6~12的中链脂肪酸检测到5种,分别为己酸(C6:0)辛酸(C8:0)、癸酸(C10:0)、十一烷酸(C11:0)和月桂酸(C12:0),碳链上碳原子数大于12的长链脂肪酸检测到11种,含量较高的主要有肉豆蔻酸(C14:0)、棕榈酸(C16:0)和硬脂酸(C18:0),且C18:0的含量最高。
SFA总体表现为上升趋势,TR1-1-3和ZF22在发酵的0~2 d时间内,饱和脂肪酸的增长速度最快,且与ZR、M和ZF19相比差异显著(P<0.05)。在4 ℃低温冷藏的6~24 d,TR1-1-3对SFA含量的影响与其他处理组在统计学上差异显著(P<0.05)。
2.3.2 乳酸菌对单不饱和脂肪酸的影响
单不饱和脂肪酸MUFA的测试结果如表6所示。由表6可知,试验组检测到的MUFA共有9种,分别为肉豆蔻烯酸(C14:1)、顺-十五碳烯酸(C15:1)、棕榈油酸(C16:1)、十七碳烯酸(C17:1)、反油酸(C18:IT9)、油酸(C18:1C9)、二十碳烯酸(C20:1)、二十二碳烯酸(C22:1)和神经酸(C24:1)。试验组观察阶段含量较高的主要是油酸(C18:1C9)、棕榈油酸(C16:1)、十七碳烯酸(C17:1)、肉豆蔻烯酸(C14:1),其中油酸(C18:1C9)含量最高。
MUFA总体表现为上升趋势,12 d观测值几乎达到最高,在低温冷藏的12~24 d的过程中,试验组均表现为MUFA的含量有所下降。TR1-1-3和ZF22在发酵的0~2 d时间内,MUFA的增长速度最快且与ZR、M和ZF19相比差异显著(P<0.05)。发酵4 d后MUFA的含量,除ZR组外其他处理组均发生了明显变化,其中TR1-1-3组 MUFA的含量上升到了 36.57 mg/10 g,增加了321.80%,增长幅度最高。12 d时5个试验组的含量均达到最高,其含量分别为 52.78、26.34、64.19、37.98、36.36 mg/10 g,分别增长了508.77%、203.81%、640.37%、338.06%、319.38%。TR1-1-3试验组增长比例最高,且与其他处理组差异显著(P<0.05)。
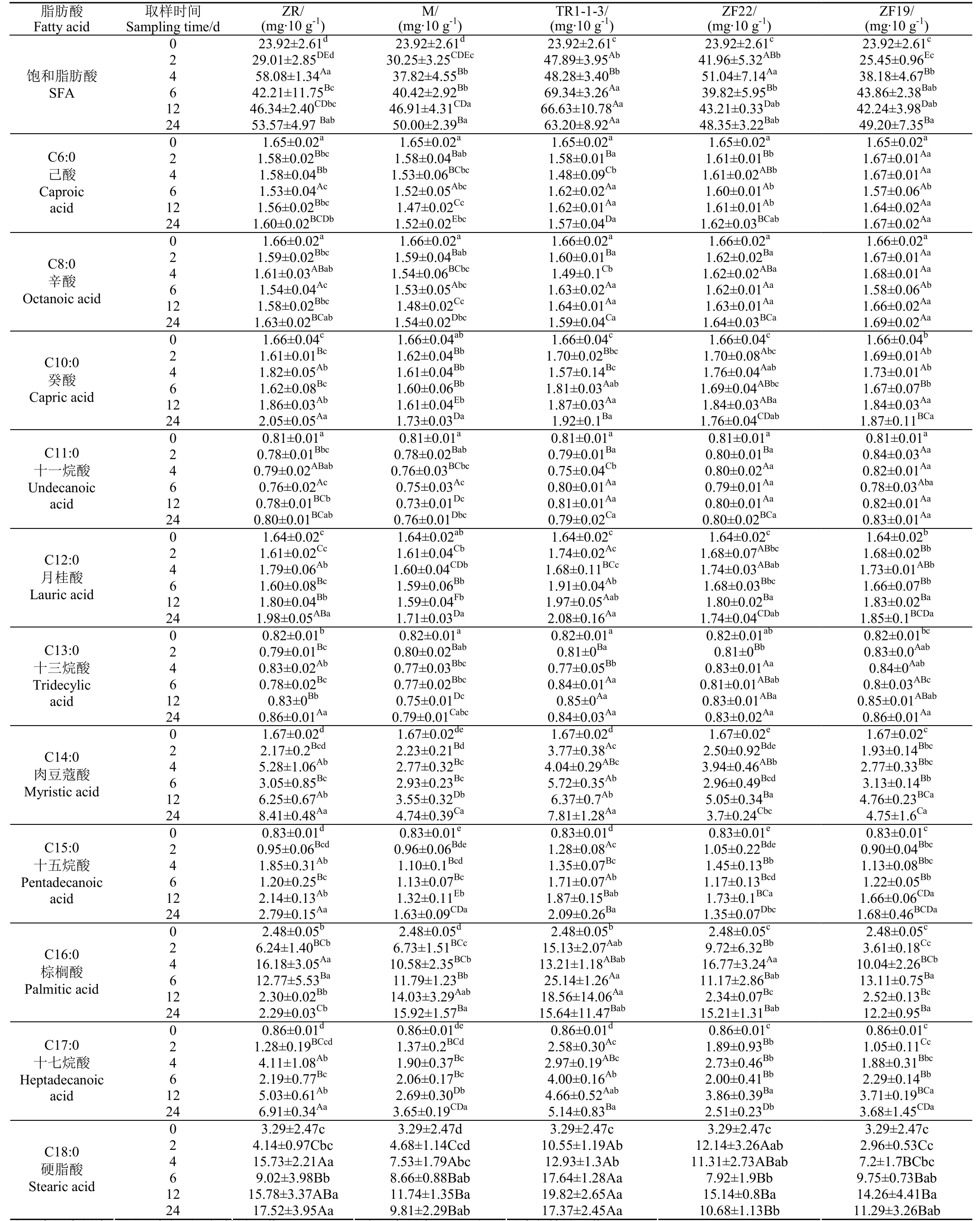
表5 乳酸菌对饱和脂肪酸的影响Table 5 Effects of lactic acid bacteria on saturated fatty acids
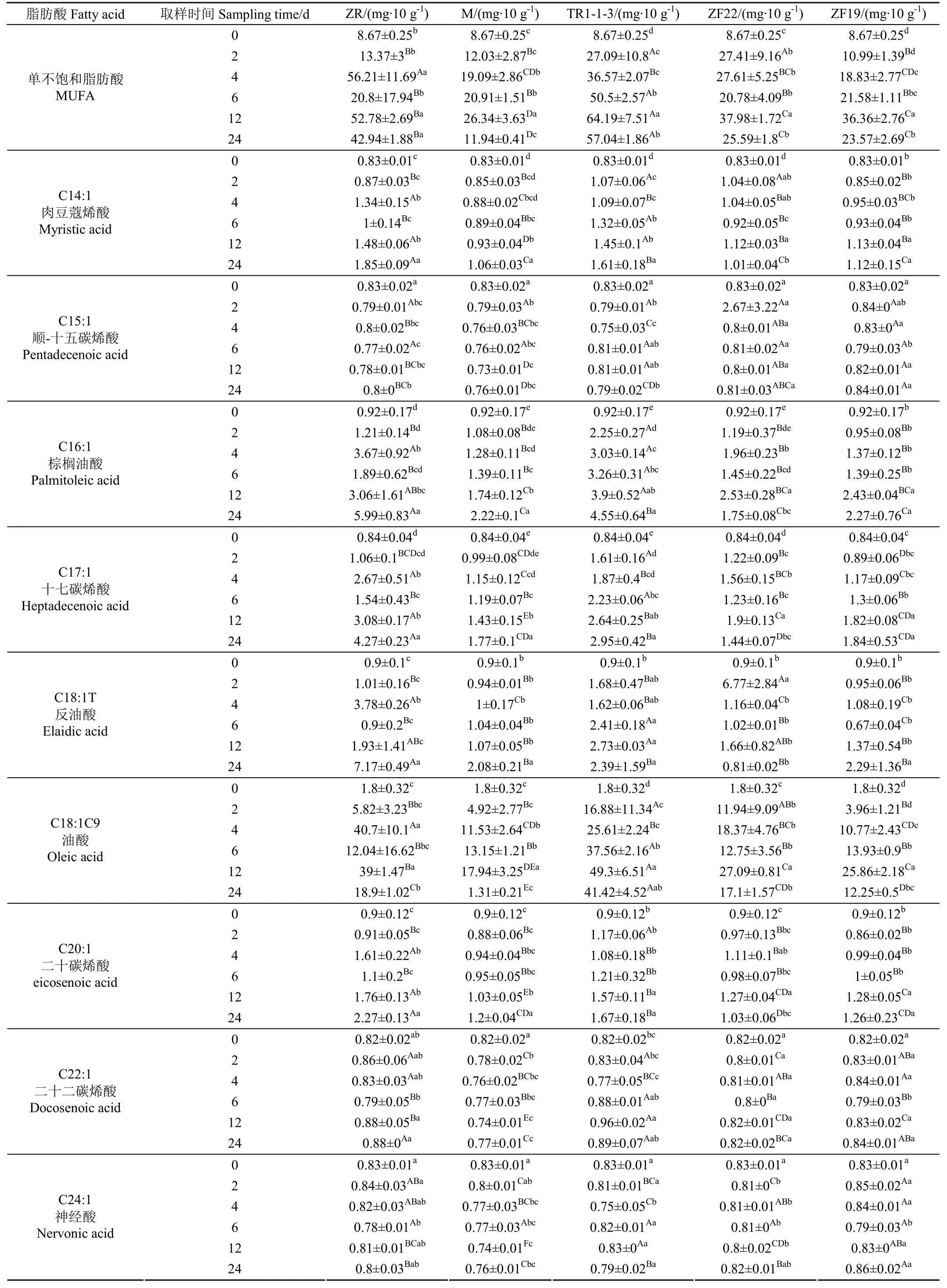
表6 乳酸菌对单不饱和脂肪酸的影响Table 6 Effects of lactic acid bacteria on mono-unsaturated fatty acids
ZR、M、TR1-1-3、ZF22、ZF19组0 d时 MUFA的平均含量为8.67 mg/10 g,其中油酸(C18:1C9)含量最高,含量为1.8 mg/10 g,所占比例为20.76%。在12 d 时油酸(C18:1C9)含量分别为 39.00、17.94、49.30、27.09、25.86 mg/10 g,与0 d相比分别增长了20.67、8.97、26.39、14.05、13.37倍,且在 12 d时含量达到最高,其中TR1-1-3变化最大,与其他试验组相比均差异显著(P<0.05)。
2.3.3 乳酸菌对多不饱和脂肪酸的影响
多不饱和脂肪酸PUFA的测试结果如表7所示。由表7可知,试验组检测到的 PUFA共有 9种,分别为反亚油酸(C18:2T9)、顺亚油酸(C18:2C9)、γ-亚麻酸(C18:3N6)、α-亚麻酸(C18:3N)、二十碳二烯酸(C20:2)、二十碳三烯酸(C20:3)、顺-二十碳三烯酸(C20:3N3)、花生四烯酸(C20:4)和二十二碳六烯酸(C22:6,DHA)。其中亚油酸(C18:2C9)、亚麻酸(C18:3N6、C18:3N3)、花生四烯酸(C20:4)、二十二碳六烯酸DHA(C22:6)含量较高。
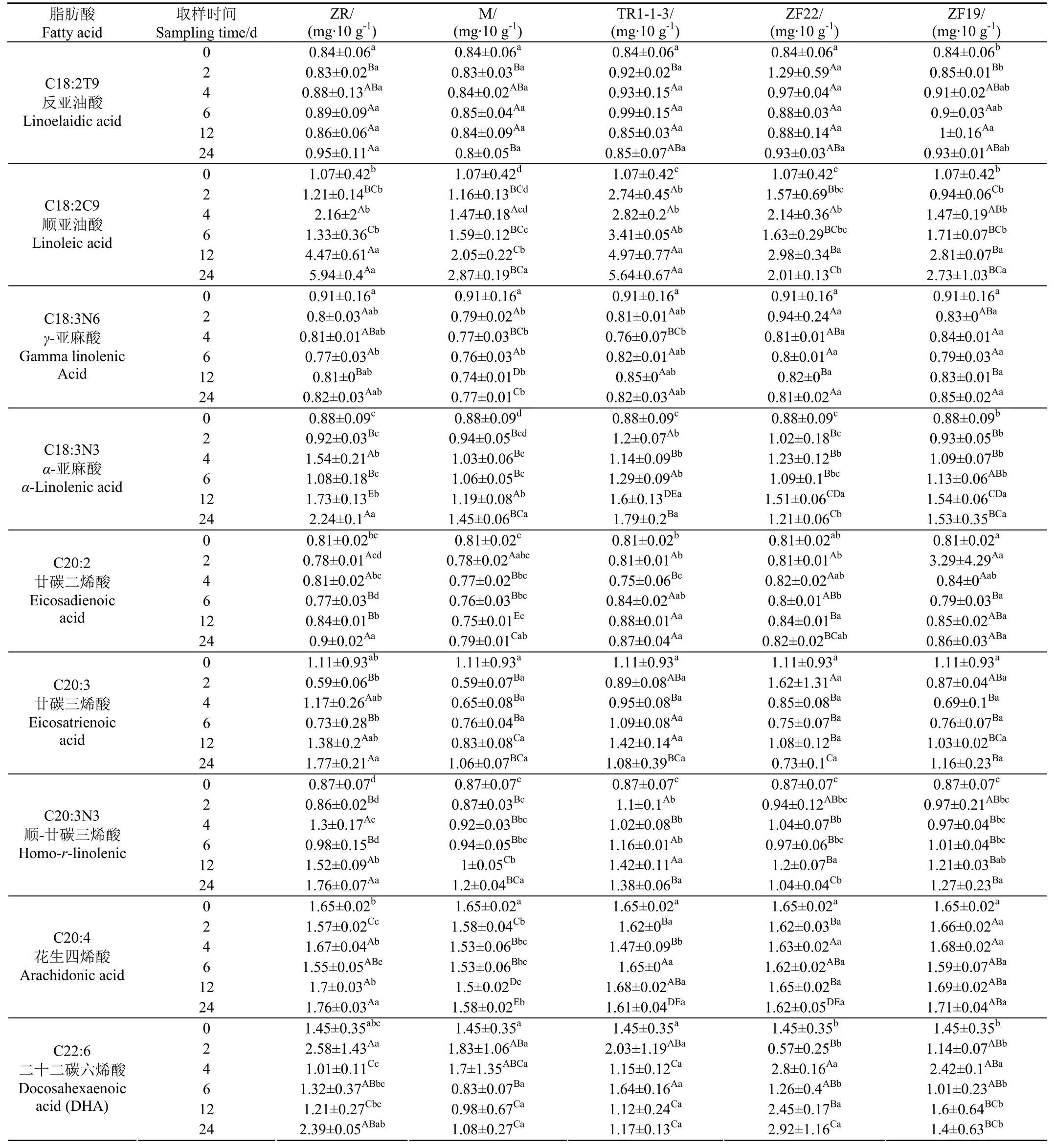
表7 乳酸菌对多不饱和脂肪酸的影响Table 7 Effects of lactic acid bacteria on polyunsaturated fatty acids
续表 (continued table)
PUFA 总体表现为上升趋势, ZR、M、TR1-1-3、ZF22、ZF19组在0 d时,多不饱和脂肪酸(PUFA)含量为9.61 mg/10g,随着发酵的进行,PUFA的含量增加。发酵2 d后PUFA的含量,只有TR1-1-3发生了明显的变化(P<0.05),含量上升到了 12.11 mg/10g,增长了 26.01%。发酵4 d 后PUFA的含量TR1-1-3和ZF22组发生了明显变化(P<0.05),其含量分别增长了27.06%和27.89%。在6~24 d的4 ℃低温冷藏阶段,PUFA的含量总体呈上升趋势,其中12 d时,ZR、M、TR1-1-3、ZF22、ZF19中PUFA的含量分别增加了51.04%、3.13%、54.17%、39.58%、31.25%,TR1-1-3和ZR的增加量最高,且与其他组相比差异显著(P<0.05)。
PUFA中n-3PUFA主要包括α-亚麻酸(C18:3N3,α-Linolenic Acid,ALA)、二十二碳六烯酸(C22:6,Docosahexaenoic Acid,DHA)、二十碳五烯酸(C20:5,Eicosapentaenoic Acid,EPA),对抑郁症、心血管疾病有预防和治疗作用[23-24]。富含n-3 PUFA 的饮食可以显著降低人类血液中血脂(TG)含量[25-26],抑制动脉硬化[27]。DHA和EPA 是目前关注较多的n-3 PUFA,Egert 等[28]和Mori 等[29]的研究均发现,DHA 对血脂正常和高血脂症人群都有显著的降血脂作用。ZR、M、TR1-1-3、ZF22、ZF19组在12 d时共检测到2种亚麻酸,分别为γ-亚麻酸(C18:3N6)和α-亚麻酸(C18:3N3),其中 C18:3N6在试验的不同阶段其含量变化差异不显著(P>0.05),12 d时α-亚麻酸(C18:3N3)的含量分别为1.73、1.19、1.60、1.51、1.54 mg/10 g,分别增加了 86.81%、31.87%、75.82%、64.84%、64.84%,其中ZR和TR1-1-3的增幅最大。二十二碳六烯酸DHA(C22:6)各组试验阶段变化差异均不显著(P>0.05)。
PUFA中n-6PUFA主要包括反亚油酸(C18:2T9)、顺亚油酸(C18:2C9)和花生四烯酸(C20:4)。ZR、M、TR1-1-3、ZF22、ZF19组在12 d时亚油酸(C18:2C9)含量分别为4.47、2.05、4.97、2.98、2.81 mg/10g,分别增加了320.56%、96.26%、367.30%、180.37%、161.68%,TR1-1-3和ZR变化最大且与其他组差异显著(P<0.05)。TR1-1-3与对照组ZR相比,TR1-1-3在发酵的第2 d 时亚油酸(C18:2C9)的含量已发生明显差异,ZR在冷藏的第 12 d时亚油酸(C18:2C9)的含量才发生明显差异(P<0.05),可见TR1-1-3明显加快了亚油酸(C18:2C9)的产生速度。对照组ZR在12 d时PUFA的含量增长了51.04%,TR1-1-3在12 d时PUFA的含量增长了54.17%,且TR1-1-3与其他试验组相比均差异显著(P<0.05)。反亚油酸(C18:2T9)各组变化差异均不显著(P>0.05)。在整个试验阶段n-6/n-3为2.77,远小于FAO/WHO的上限标准(5:1)[30]。
TR1-1-3与对照组ZR相比,TR1-1-3在发酵的第2 d时 PUFA的含量已发生明显差异,ZR在冷藏的第 12 d时PUFA的含量才发生明显差异,可见TR1-1-3可明显加快PUFA的生成速度,缩短发酵香肠的成熟时间。
3 结 论
1)10株试验菌株中有6株在代谢过程中产脂肪酶,其中瑞士乳杆菌TR1-1-3产酶活力最强。荧光定量PCR检测发现菌株 TR1-1-3中编码脂肪酶的基因 Lip0069、Lip0893表达量最高。
2)乳酸菌对发酵香肠脂肪酸组成的影响试验表明,香肠在发酵、干燥/成熟和4 ℃低温冷藏阶段,试验组共检测到34种脂肪酸,包括16种SFA、9种MUFA、9种PUFA。
3)SFA含量较高的主要有肉豆蔻酸(C14:0)、棕榈酸(C16:0)和硬脂酸(C18:0),在4℃低温冷藏阶段仅ZR和TR1-1-3中SFA的含量在脂肪酸中所占比例有所下降,而添加酶制剂的M组有所上升,其他组别SFA的占比变化不明显(P>0.05)。
4)MUFA中含量较高的主要是油酸(C18:1C9)、棕榈油酸(C16:1)、十七碳烯酸(C17:1)、肉豆蔻烯酸(C14:1)。发酵2 d后,仅TR1-1-3和ZF22组MUFA的含量明显上升(P<0.05)。12 d时5个试验组MUFA的含量均达到最高,其中TR1-1-3增长比例最高,且与ZR、M组差异显著(P<0.05)。
5)PUFA中含量较高的主要是亚油酸(C18:2C9)、亚麻酸(C18:3N6、C18:3N3)、花生四烯酸(C20:4)、DHA(C22:6)。发酵2 d后只有TR1-1-3组PUFA的含量发生了明显的变化(P<0.05),ZR在冷藏的第12 d时PUFA的含量才发生明显差异,TR1-1-3在12 d时PUFA的含量增长了54.17%,且与其他试验组相比均差异显著(P<0.05)。
综上可知,所有试验组中SFA、MUFA和PUFA的含量在0~12 d均表现为上升趋,12~24 d变化趋势变缓。乳酸菌TR1-1-3可降低产品中SFA在脂肪酸中所占比例,明显加快 MUFA、PUFA的增加速度及其含量,可为研究改善香肠脂肪特性提供良好的前景。