载PaMZ/nHA 抗结核人工骨的最优配方筛选
2020-07-25唐学峰刘昌昊于树印曾庆丰施建党
唐学峰, 刘昌昊, 于树印, 曾庆丰, 施建党
(1.宁夏医科大学,银川 750004; 2.西安点云公司,西安 710000; 3.宁夏医科大学总医院脊柱骨科,银川 750004)
脊柱结核病灶局部药物浓度过低及病灶清除术后骨缺损修复材料不足是脊柱结核病灶难以治愈及容易再燃的主要原因,如何增加病灶局部药物浓度及有效修复重建病灶骨缺损,促进病灶愈合是临床思考的难题[1]。局部应用载抗结核药缓释植骨材料有望同时解决上述难题[2]。本研究选择了最新三联抗痨药物组合PaMZ[Pa-824(Pretomanid,Pa)、莫西沙星(Moxifloxacin,M)、吡嗪酰胺(Pyrazinamide,Z)]及纳米羟基磷灰石(nanohydroxyapatite,nHA),设计并 3D 打印了载药 PaMZ/nHA 抗结核人工骨用于脊柱结核的病灶治疗。Pa是通过抑制细菌霉菌酸和蛋白合成来杀灭结核杆菌,在无氧和有氧条件下都可以高效杀灭结核杆菌,有出色的组织渗透性[3],对耐药结核杆菌有高度的敏感性[4],PaMZ 对多重耐药性结核病有理想的治疗效果[5]。如何使载药人工骨既能满意释药,又能满足支撑强度是人工骨制作中必须首先回答的问题。载药人工骨的药物配比及不同孔径对释药均有影响,亦对3D 打印人工骨压缩强度产生影响,在确保足够强度的前提下,确定材料不同孔径及不同载药量的配比是此部分研究的关键。本研究通过对不同孔径nHA 与不同含量的PaMZ 药物构成的9 种载药抗结核人工骨的释药性能和抗压缩强度测试,筛选出最优药物配比和孔径的载PaMZ 的nHA 抗结核人工骨。
1 材料和方法
1.1 试剂和仪器
高效液相色谱仪(安捷伦公司);RGM-G010电子万能材料试验机(深圳市瑞格尔仪器有限公司);AL-204 电子天平(上海梅特勒有限公司);QL-861 涡旋混合器(中国其林贝尔仪器制造公司);纳米羟基磷灰石晶须粉体、羟基磷灰石粉体(西安点云公司);聚乳酸-羟基乙酸(poly lactic co glycolic acid,PLGA)75/25OH(济南岱罡生物工程有限公司);二氯甲烷(徐州天鸿化工有限公司)、丙酮(烟台市双双化工有限公司)、无水乙醇(天津市天力化学试剂有限公司);Pa 样品(美国MedChemExpress 公司)、M(大连美仑生物技术有限公司),Z(大连美仑生物技术有限公司);3D 打印机(西安点云公司)。聚乙烯醇(PVA)(天津光复精细化工研究所)。Pa 标准品(厦门慧嘉生物技术有限公司);M 标准品(大连美仑生物技术有限公司);Z 标准品(中国食品药品检定研究院);甲醇(色谱级)(Fisher chemical 公司)。
1.2 材料制备
1.2.1 nHA 浆料的制备 nHA 和纳米羟基磷灰石晶须按照1∶10 的比例混匀,加入一定比例的PVA 粘接剂,将三者混匀充分后备用。
1.2.2 制备PaMZ-PLGA 固体分散体溶液 分别制备3 种不同的固体分散体溶液,Pa 加到丙酮中涡旋溶解形成溶液a;PLGA 加入到二氯甲烷涡旋溶解形成溶液b,M、Z 加入到无水乙醇中涡旋溶解形成溶液c,将a、b、c 溶液充分混合后,加热到70 ℃,待挥发至少量时,降低温度至25 ℃,将该固体分散体黏稠液体加入到上述制备的nHA浆料中混匀,准备行3D 打印。
1.2.3 载抗癆药人工骨的3D 打印 按照是否载药分为载药和非载药人工骨组,按照孔径及载药量不同,载药人工骨分为 A、B、C、D、E、F、G、H、I组(共 9 组),非载药人工骨分为 J、K、L 组(共 3组)。将上述配制的混匀浆料加入到3D 打印机中进行常规打印。
1.2.4 载PaMZ/nHA 3D 打印人工骨大体形态学观察 载药组为长方体状,呈奶白色,质韧而硬,表面粗糙,可以看到孔隙,非载药组,长方体状,呈白色,质硬,表面粗糙(图1)。
1.3 实验分组
设计的支架体积为10 mm×8 mm×8 mm,孔径分别是 200、400 和 600 μm,孔隙率 60%,实验组(载PaMZ 的3D nHA 抗结核人工骨组)根据上述不同孔径、不同载药量制作成不同人工骨分为9 组,即 A、B、C、D、E、F、G、H、I 组,根据药物配比分为 3 个组,药物配比 6∶12∶45∶95 为实验组 1(A、B、C 组),药物配比 4∶12∶45∶244 为实验组 2(D、E、F 组),药物配比 3∶12∶45∶140 为实验组 3(G、H、I 组)。对照组(非载药的 nHA 人工骨)根据上述不同孔径制作成非载药人工骨分为3组 :J、K、L 组 中 加 入 nHA 混 合 物 总 量 均 为429.59 mg。将人工骨冷冻干燥后,钴60 灭菌后保存备用(表1)。
1.4 抗压缩强度的测定
将制备好的底面边长为8 mm、高度为10 mm的长方体载药或不载药人工骨共9 组,依次固定在电子万能材料试验机上,将压缩冲头的速度设置为1 mm·min-1,施加不同的载荷于样品上,直到样品在垂直方向压缩至 80%停止,以载荷-位移曲线中载荷下降时最大载荷时的压强确定为各人工骨的最大抗压缩强度。每组均做3 个,记录每次测量值。
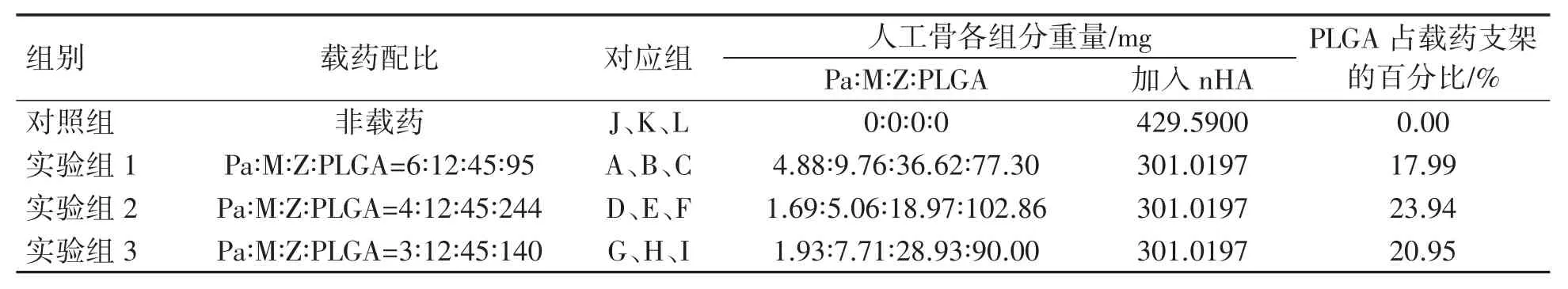
表1 不同载药配比人工骨重量的比较
1.5 高效液相色谱对载PaMZ/nHA 抗结核人工骨释药性能进行观察
1.5.1 建立色谱条件及标准曲线 采用色谱柱:GL sciences WondasilTM C18superb 色谱柱(4.6 mm×250 mm,5 μm);检测波长 250 nm;柱温 40℃;进样量10 μL。流动相条件为:甲醇-0.1%的冰乙酸,流速为1 mL·min-1,梯度出峰进样。利用Pa标准品分别配置 0.1~10 μg·mL-1之间的浓度,M分别配置 0.1~1000 μg·mL-1之间的浓度,Z 分别配置 0.1~2000 μg·mL-1之间的浓度。按照上述的色谱条件进行测定,记录峰面积。以浓度为横坐标(X),峰面积为纵坐标(Y)。将呈线性的点连接,形成标准曲线方程(表2)。

表2 PaMZ 标准曲线方程
1.5.2 载PaMZ/nHA 抗结核人工骨释药性能的观察及参数的测定 分别将上述的9 种不同的载药人工骨(A~I 组)装入一端扎好的透析袋中,注入2 mL 磷酸盐缓缓冲液(pH=7.4)液,将另一端扎紧,置入装有5 mL PBS 液的离心管中,在37 ℃下,以100 r·min-1的水浴摇床中进行体外释药试验。于 1、4、8、12、24、36 和 48 h 取样,第 3天及第3 天以后每天同一时间段取样,3 d 后的取样时间为第 4、5、7、11、14、21、28、35 和 42 天(6 周)。取样于-20℃密封、冻存待检。同时补充5 mL 新鲜PBS 液于离心管中。将所取的样品经过 0.22 μm 的微孔滤膜过滤后,取 10 μL 利用前面建立的液相条件进样记录峰面积,并根据标准曲线方程计算出浓度、累积释药率。
1.6 统计学方法
结果数据采用SPSS 22.0 统计软件进行分析,所有计量资料以均数±标准差()表示。两组间比较采用t 检验,多组间比较采用F 检验,孔径及药物配比的比较采用 2×2 析因设计方差分析,P≤0.05 为差异有统计学意义。
2 结果
2.1 人工骨抗压缩强度测定结果
不同孔径非载药人工骨的最大抗压强度间的差异无统计学意义(F=2.532,P=0.160),表明非载药人工骨的最大抗压强度和孔径无关(表3)。同孔径载药和非载药人工骨的最大抗压缩强度间的差异无统计学意义(P 均>0.05)(表3)。表明nHA 的人工骨的最大抗压强度和是否载药无关。药物配比及孔径两因素析因设计的方差分析中,不同药物配比人工骨的最大抗压缩强度间差异有统计学意义(F=18.873,P<0.001)(图 2),表明各组中载药人工骨的最大抗压缩强度和药物配比有关。其中 Pa∶M∶Z∶PLGA=3∶12∶45∶140(实验组3)的最大抗压缩强度高于其余实验组(P均<0.01)(图 2)。表明 Pa∶M∶Z∶PLGA=3∶12∶45∶140(实验组3)的最大抗压缩强度最大。不同PLGA 含量的人工骨的最大抗压强度间的差异有统计学意义(F=18.873,P<0.001),表明各组中载药人工骨的最大抗压缩强度和人工骨中PLGA的含量有关,其中,PLGA20.95%的载药人工骨(3∶12∶45∶140)(实验 3 组)的最大抗压强度高于其余实验组(P 均<0.01),表明载药人工骨中PLGA含量20.95%的人工骨最大抗压强度是最大的。
2.2 载药人工骨的Pa、M、Z 的释药性能分析
记录不同组别载药人工的释药情况(表4),9 组载药人工骨间的6 周Pa 释药率间的差异有统计学意义(F=8.449,P<0.001)(图 3),其中 G组Pa 的6 周累积释药率均低于除B 组外的其他各组(P 均<0.05 或<0.01);B 组的 Pa 的 6 周累积释药率低于除C、G 组外的其余各组(P 均<0.05或<0.01);B、G 组间 Pa 释药率差异无统计学意义(P>0.05);B、G 组间 Pa 释药率相对较低,G 组的Pa 释药率9 组中最小的是16.74%。
表3 非载药人工骨和载药人工骨抗压强度的比较(,MPa)
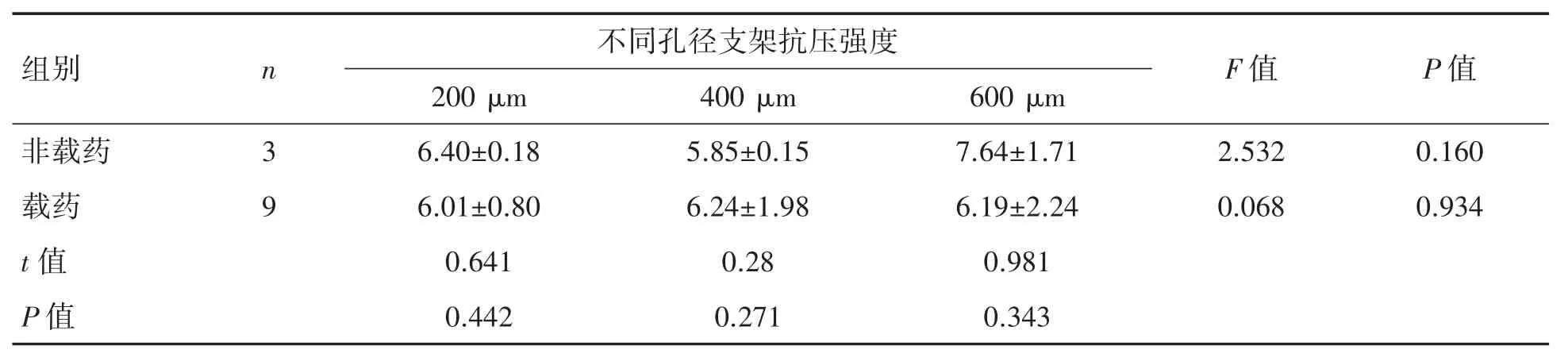
表3 非载药人工骨和载药人工骨抗压强度的比较(,MPa)
组别 n 不同孔径支架抗压强度 F 值 P 值200 μm 400 μm 600 μm非载药 3 6.40±0.18 5.85±0.15 7.64±1.71 2.532 0.160载药 9 6.01±0.80 6.24±1.98 6.19±2.24 0.068 0.934 t 值 0.641 0.28 0.981 P 值 0.442 0.271 0.343
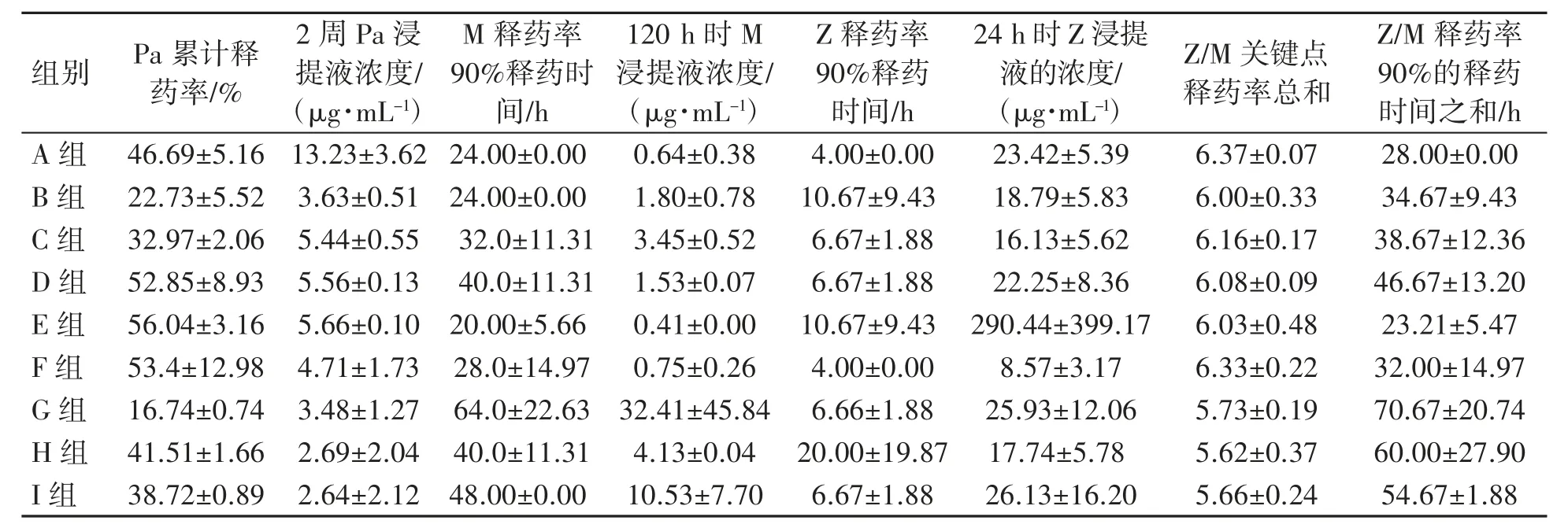
表4 不同组别载药抗结核人工骨中PaMZ 各药的释药情况比较
2.3 孔径和药物配比两因素析因设计释药率的方差分析
孔径和药物配比两因素设计的释药率方差分析中,不同孔径载药人工骨的Z 和M 关键点(释药1、8、12 和24 h)释药率总和间差异无统计学意义(F=0.7859,P=0.4708),表明各组中载药人工骨的释药率与孔径无关。药物配比间的差异有统计学意义(F=6.525,P=0.0074)(图 4)。表明各组中载药人工骨的释药率和药物配比有关,其中,药物配比 Pa∶M∶Z∶PLGA=3∶12∶45∶140(实验组3)的释药率是最小的,其和 6∶12∶45∶95(实验组1)及 4∶12∶45∶244(实验组 2)的比较差异有统计学意义(P 均<0.01)(图 4)。
2.4 孔径和药物配比两因素析因设计释药时间的方差分析
孔径和药物配比两因素的释药时间的方差分析中,不同药物配比的Z 和M 的释药率90%时的释药时间总和之间的差异有统计学意义(F=7.449,P=0.0044)(图 4),表明各组载药人工骨的亲水性药物释药时间与药物配比有关。其中,药物配比 Pa∶M∶Z∶PLGA=3∶12∶45∶140(实验组 3)的亲水性药物释药时间最长,和 4∶12∶45∶244(实验组 1)及 6∶12∶45∶95(实验组 2)比较差异均有统计学意义(P 均<0.01)(图 5)。A~I 组的载药人工骨孔径和药物配比两因素析因设计的Z 和M 释药率90%的释药时间总和的方差分析中,实验组1、实验组2 均与实验组3 的差异有统计学意义。其中,实验组3 的Z 和M 释药率为90%的释药时间之和最大。
2.5 最优载药人工骨的筛选结果及其释药曲线
以最大抗压强度为载药人工骨的筛选指标,最佳载药人工骨为实验组3,以释药性能为载药人工骨的筛选指标,最佳载药人工骨为G 组,因而,以最大抗压强度和释药性能为总的筛选条件得出最佳载药人工骨为G 组。G 组的释药曲线如图6。
3 讨论
3D 打印的载药nHA 支架可望解决脊柱结核病灶局部浓度不足及植骨材料缺乏的临床难题。nHA 是构建骨组织工程支架的理想材料,3D打印可以设计nHA 的孔径及孔隙率。3D 打印后的多孔结构材料机械强度必然下降[6-9]。如何在孔结构和强度之间进行调节,快速成型技术可以解决这一难题[10];如何在材料载药后确保nHA 支架足够的支撑强度,确定材料最优的的孔径及合适的药物配比是成为人工骨制作中首要解决的问题。
3.1 最佳强度时配比的确定
本研究观察9 组载药PaMZ 的nHA 抗结核支架中,药物辅料配比 Pa∶M∶Z∶PLGA=3∶12∶45∶140(实验组3)的人工骨具有最优的抗压缩强度,表明PLGA 占支架20.95%时,载药人工骨的抗压缩强度最大。在孔径相同的情况下,载药和非载药的人工骨的最大抗压缩强度无差别,说明加入药物PaMZ 的载药人工骨的最大抗压缩强度和非载药人工骨的基本相同,孔隙率60%时的人工骨既确保了载药人工骨植入骨缺损处的支撑作用,又确保了在骨缺损处的成骨和足够的药物浓度。
在脊柱结核病灶局部治疗中,人工骨需要有一定孔隙率和足够载药量,才能满足长程、缓慢释药的要求。而本组载药支架的孔隙率尽可能达到松质骨孔隙率的50~90%[11]。而松质骨的抗压强度2~12 MPa[10]。本研究所制备的载PaMZ 的3D nHA 抗结核支撑人工骨能够满足以上条件,具有较高的60%孔隙率,抗压强度较大,平均6.17 MPa,承载足量的抗结核药物,可以满足支撑植骨的要求。
3.2 PLGA 对人工骨强度有加强作用
多孔HA 的抗压强度很低,多孔HA 的支架强度为0.88 MPa 左右[12]。常难以达到支撑植骨。本组研制的载药多孔HA 抗压强度,平均达6.17 MPa,非载药多孔HA 最大抗机械压缩强度平均为7.06 MPa,明显高于多孔HA,达到松质骨的强度。理论上HA 支架加入大比例抗结核药物后抗压强度将下降[13],但本研究采用的nHA 加入三种药物总量百分比从5.99%增加到11.93%,载药人工骨的抗压强度却无明显下降,究其原因,我们认为PLGA 抵消了加入药物所造成机械强度的下降,当载药辅料PLGA 从17.99%增加到20.95%,载药人工骨的最大压缩强度逐渐增大,从20.95%增加到23.94%时,载药人工骨的最大抗压缩强度逐渐下降,说明PLGA 增加了材料的机械强度,并且在PLGA 质量比为20.95%时,机械强度最大,随后又开始下降。Chen 等[14-18]认为,PLGA 可增强磷酸钙骨水泥的机械强度,机制是PLGA 强化了nHA 晶体矩阵,减少了HA 孔壁的裂隙缺陷数目,改善了脆性nHA 基质的机械稳定性。HA孔隙表面上缺陷的减少导致机械强度的增加[15]。但当浓度过大时,PLGA 强度毕竟远小于nHA,并使nHA 晶体间分布过于松散,最大抗机械压缩强度就会开始变小。
3.3 最佳释药性能时配比的确定
本研究观察9 组载药PaMZ 的nHA 人工骨在体外释药时,其中G 组释药最佳,Pa 释药6 周远远未达到完全释放,缓释效果很好。Pa 是脂溶性药物,在磷酸盐缓释液中缓释效果相对较好,Z和M 是偏水溶性药物,会出现明显的突释,如能增加Z 和M 的释药时间和减少二者关键点(释药 1、8、12 和 24 h) 的释药率,PaMZ 复合配方就是最佳的。本研究结果显示,G 组Pa 释药时间最长,Pa∶M∶Z∶PLGA=3∶12∶45∶140(实验组 3)的载药人工骨关键点(释药 1、8、12 和 24 h)上 Z 和 M的释药率总和是最小的,该组Z、M 的释药时间也是最长的,唯有G 组Pa 在释药2 周、Z 在释药24 h、M 在释药120 h 的药物平均浓度均高于各自药物10 倍的最低抑菌浓度。Z、M、Pa 的体外药物最 低 抑 菌浓 度 分 别 是 2[19]、0.025 ~0.5[20]和0.015~0.25 μg·mL-1[3]。因而同时满足 Pa 优良释药率、Z 和 M 的关键点(释药 1、8、12 和 24 h)释药率总和最小、最大Z 和M 的释药率90%时的释药时间总和、10 倍的MIC 的只有G 组。
综上,载PaMZ/nHA 抗结核具有较好的载药缓释特性和理想的抗机械压缩强度,可以满足脊柱结核术后骨缺损的支撑植骨和局部有效杀菌的要求。研究确定 Pa∶M∶Z∶PLGA=3∶12∶45∶140,孔径200 μm 为最佳,三种药物释放均在10 倍最低抑菌浓度以上。支架在较高孔隙率60%时,人工骨抗压强度可达平均6.17 MPa,达到了松植骨的抗压强度,能够满足骨缺损的椎间支撑植骨要求。PLGA 可增加载药人工骨的机械抗压强度,当PLGA 含量达到20.95%时,其抗压强度最大。
