pH值、静置、冷冻对不同种类蔬菜中丁硫克百威测定的影响
2020-07-23王世成林桂凤李国琛
王 莹,王世成,李 玲,林桂凤,李国琛*
(1.中国科学院 沈阳应用生态研究所,辽宁 沈阳 110016;2.农业农村部 农产品质量安全环境因子风险评估实验室(沈阳),辽宁 沈阳 110016)
丁硫克百威,化学名称为2,3-二氢-2,2-二甲基-7-苯并呋喃[(二丁基氨基)硫代]甲基氨基甲酸酯[1],是美国FMC公司开发的一种具有内吸性和高脂溶性、在土壤和植物中易于降解代谢的高效、广谱的氨基甲酸酯类杀虫杀螨剂。这种克百威低毒化衍生物在昆虫体内可转化为更高毒性的克百威和3-羟基克百威[2]。自2017年8月1日起,我国撤销了丁硫克百威在蔬菜上的农药登记申请,自2019年8月1日起禁止在蔬菜上使用[3]。GB 2763─2019《食品安全国家标准:食品中农药最大残留限量》规定了蔬菜中丁硫克百威的最大残留限量为0.05~1 mg/kg,但不包含其代谢产物[4]。
目前,蔬菜中丁硫克百威及其代谢物多采用液液萃取、固相萃取、凝胶渗透色谱净化、加速溶剂萃取等[5-13]前处理手段进行提取和净化,并结合气相色谱法、气质联用法、液相色谱串联质谱技术进行检测[5-13]。杨爽等(2008)采用丙酮提取-液液分配净化-气质法检测了辣椒中丁硫克百威及其代谢产物[8];赵桦林等(2013)建立了白菜中硅藻土混合分散-加速溶剂萃取-固相萃取柱净化-液相色谱串联质谱检测方法[9];方宗壮等(2016)采用混合溶剂提取-弗罗里硅土净化-气质联用法检测了豇豆中丁硫克百威及其代谢物的残留量[10]。上述方法均是对某一种类蔬菜基质进行检测,而且未论述在前处理过程中丁硫克百威母体是否发生降解为克百威、3-羟基克百威的现象。因此,为了准确测定蔬菜中丁硫克百威母体的残留量,我们对菜豆(果菜类)、结球甘蓝(茎菜类)、萝卜(根菜类)三种蔬菜基质经乙腈提取后,通过考察pH值、静置时间、冷冻三因素,确定了最优的前处理方法,并与具有高灵敏度和选择性的液相串联质谱技术结合,建立了测定不同种类蔬菜中丁硫克百威残留量的基质校正的UPLC-MS/MS分析方法。
1 材料与方法
1.1 主要仪器与试剂
仪器: 1250超高效液相色谱仪、TSQ Quantum Access MAX三重串联四级杆质谱仪、Vanquish超高效液相色谱仪、Q Exactive四级杆-静电场轨道阱高分辨质谱仪(美国Thermo Fisher Scientific公司)、T18数显型高速分散机(德国IKA公司)、Vortex genius 3涡流振荡器(德国IKA公司)、TD25-WS离心机(湖南湘仪公司)。
试剂:乙腈、氯化钠、氢氧化钾(均为分析纯,天津康科德试剂公司);乙腈、甲醇、甲酸(均为色谱纯,默克公司);超纯水。
农药标准品:丁硫克百威、克百威、3-羟基克百威的100 mg/L标准溶液均购自农业部环境保护科研检测所。
1.2 实验方法
1.2.1 农药标准工作溶液的配制 分别移取丁硫克百威、克百威、3-羟基克百威的100 mg/L标准溶液各1 mL于10 mL容量瓶中,用甲醇溶解并定容,配制成混合标准溶液10 mg/L。
蔬菜基质对分析过程易产生基质效应,影响分析结果的准确性[14]。为了消除基质效应的影响,采用空白样品经过前处理后得到的溶液作为溶剂,将混合标准溶液分别稀释成系列基质混合标准溶液,以待测物的质量浓度为横坐标,定量离子对的色谱峰面积为纵坐标,绘制外标法曲线。
1.2.2 检测条件 UPLC条件: T3柱(2.1 mm×150 mm,5 μm,美国Waters公司);柱温35 ℃;流动相A为水;流动相B为甲醇。梯度洗脱程序:10% B保持1 min;在3.5 min内由10% B线性增加到95% B并保持1 min;随后在3.5 min内线性回落到起始10% B并保持4 min;流速0.3 mL/min;进样量5 μL。
MS/MS条件:电喷雾离子源(ESI);扫描方式为正离子扫描;监测方式为多反应监测模式(MRM);喷雾电压3500 V;蒸汽温度300 ℃;离子传输管温度270 ℃;鞘气压力25 arb;辅助气压力10 arb;碰撞能量、定性离子对、定量离子对见表1;色谱图见图1。
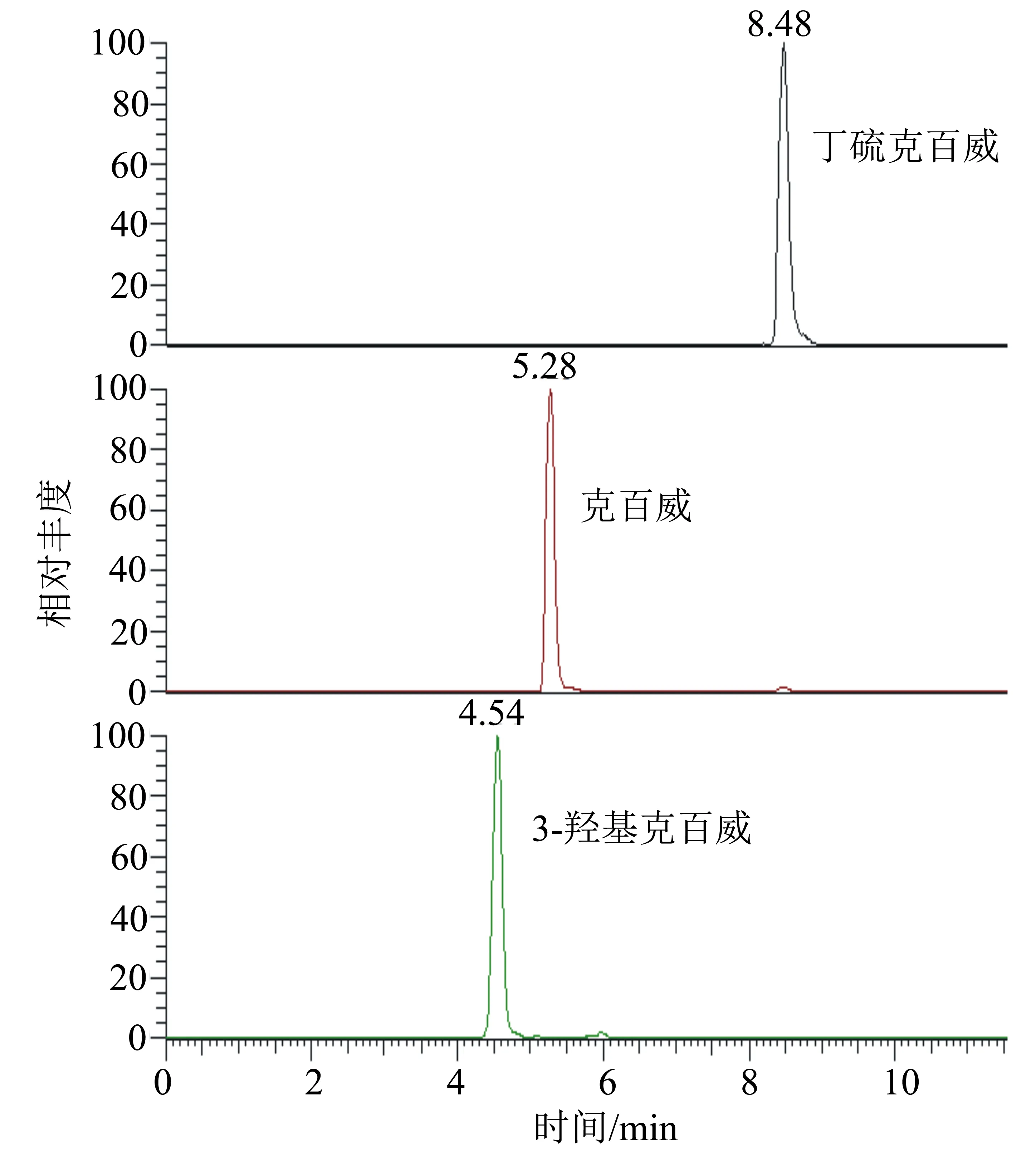
图1 丁硫克百威、克百威、3-羟基克百威(浓度均为50 μg/L)的MRM色谱图
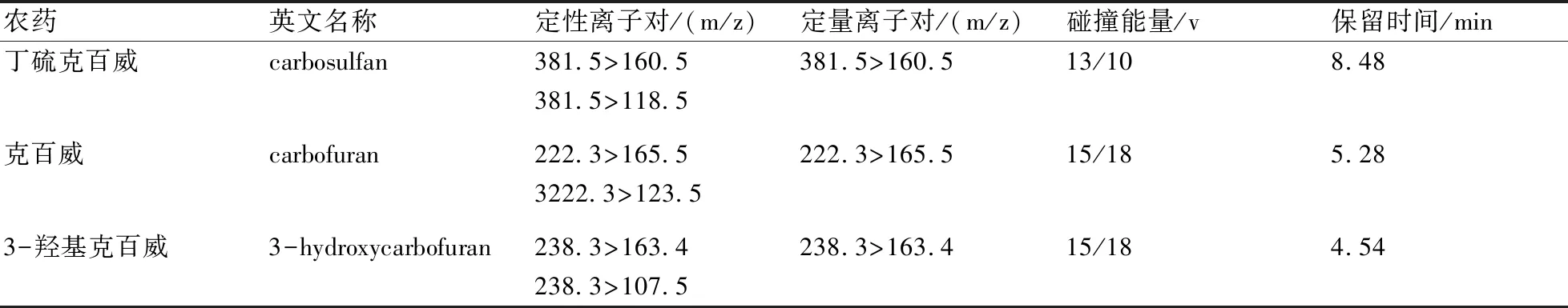
表1 丁硫克百威、克百威、3-羟基克百威的质谱检测条件
HRMS条件:电喷雾离子源(ESI);扫描方式为正离子扫描;喷雾电压3200 V;雾化温度350 ℃;离子传输管温度320 ℃;鞘气压力40 arb;辅助气压力10 arb;监测模式为数据依赖性扫描(Full MS/dd-MS2),扫描范围m/z 50~750, Full MS分辨率70000, dd-MS2分辨率17500;在MS/MS模式下,归一化阶梯碰撞能量为20%、40%、60%。
1.2.3 前处理方法 本实验按照检测时间分为3组(立即检测组、静置2 h检测组、冷冻5 d检测组),每组设2个处理(调pH值、不调pH值)和3个添加浓度(0.01、0.05、0.10 mg/kg)。具体分组见表2。
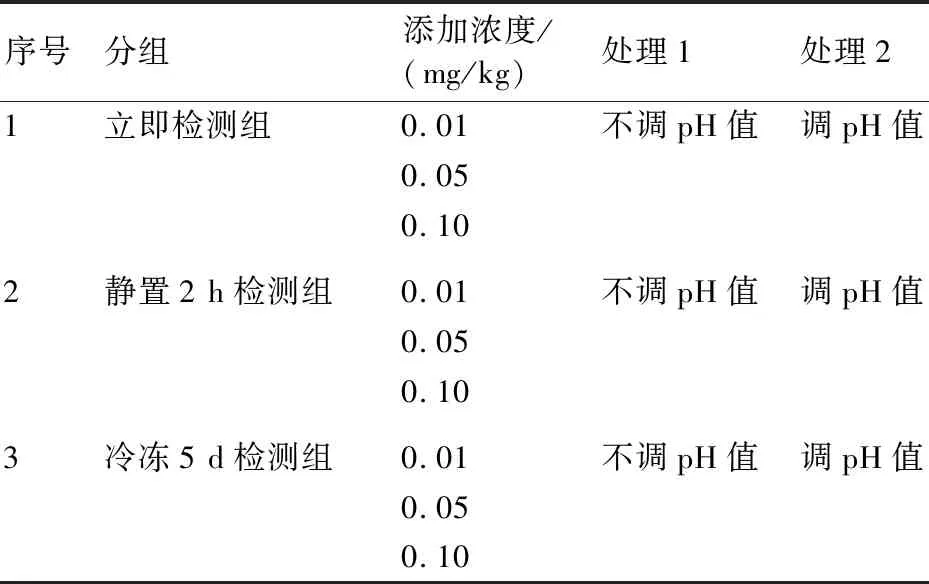
表2 前处理方法分组
称取10.0 g样品,向不调整pH值的样品中加入10 mL水,向调整pH值的样品中加入10 mL 0.025 mol/L KOH溶液,涡旋混匀。立即检测组:迅速加入20 mL乙腈,以12000 r/min高速匀浆2 min;再加入7 g氯化钠,剧烈振荡1 min;然后以5000 r/min离心5 min;最后取1 mL上清液,过0.22 μm膜,进行测定。静置2 h检测组:在调整或不调整pH值后,密封,在室温下静置2 h,然后按照立即检测组的方法进行前处理。冷冻5 d检测组:在调整或不调整pH值后,于-18 ℃密封冷冻5 d,然后取出解冻,按照立即检测组的方法进行前处理。
2 结果与分析
2.1 检测条件的选择
采用UPLC-MS/MS常用流动相甲醇+0.1%甲酸(v+v,1+1)配制丁硫克百威标准溶液,放置10 min、2 h、6 h、10 h、14 h、18 h后分别进行UPLC-MS/MS检测,结果发现丁硫克百威在酸性条件下2 h内已经降解76.5%,4 h即达到91.7%。主要是因为丁硫克百威的N-S键在酸性条件下容易断裂,转化成克百威等降解产物[2]。因此检测丁硫克百威,在配制标液、前处理以及上机检测时,均建议不加酸。
采用标准溶液蠕动泵注射全扫描方式确定丁硫克百威、克百威、3-羟基克百威均以[M+H]+为母离子,再对母离子进行二级碰撞能量优化,建立了MRM模式的最佳质谱条件(表1)。同时,对乙腈-水、甲醇-水两种流动相条件下3种农药的色谱峰面积进行比较,结果发现:甲醇-水流动相测得的3种农药的峰面积较高,是乙腈-水流动相的1.3~7.8倍。所以本次实验采用甲醇-水作为流动相。
2.2 丁硫克百威在酸性条件下的降解产物
将甲醇与0.1%甲酸水以体积比1∶1混合,配制1 mg/L丁硫克百威标液,于4 ℃避光条件下放置18 h后,采用UPLC-HRMS进行正离子模式Full MS/dd-MS2扫描。
丁硫克百威的分子式为C20H32N2O3S,理论分子量为380.22064,在ESI正离子模式下形成准分子离子峰C20H33N2O3S+,质量数为381.22064。它在酸性条件下不稳定,N-S键易断裂,形成不同碎片离子(图2),包括克百威(分子式C12H15NO3)的准分子离子峰C12H16NO3+,但未见3-羟基克百威(分子式为C12H15NO4)的准分子离子峰C12H16NO4+(238.10738)。由此可推断在酸性条件下,丁硫克百威可降解为克百威,但不生成3-羟基克百威。
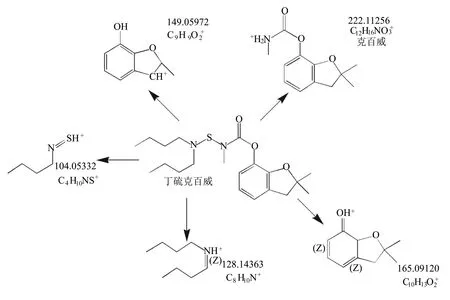
图2 丁硫克百威在酸性条件下的降解产物
2.3 pH值、静置、冷冻时间对丁硫克百威回收率的影响
从2.1、2.2部分的实验结果可以看出,在酸性条件下丁硫克百威不稳定,回收率会降低。所以本次实验选取3种不同蔬菜品种,包括菜豆(果菜类)、结球甘蓝(茎菜类)、萝卜(根菜类),在提取过程中进行了加水、加碱液的回收率比较。
由图3a可以看出:在不调pH值的条件下,菜豆3个处理组的回收率为63.3%~130.0%;在调pH值的条件下,立即检测组与静置2 h检测组的回收率与不调pH值没有较大差异,而冷冻5 d后检测的0.01 mg/kg、0.05 mg/kg的回收率已经下降到0%。由图3b可以看出:结球甘蓝调pH后回收率基本都优于不调pH的,其中立即检测组调pH后3个浓度的回收率分别是83.6%、86.7%、110.0%,高于静置2 h组、冷冻5 d组的。由图3c可以看出:调pH对萝卜的前处理影响最明显;不调pH,仅立即检测组0.1 mg/kg的回收率是64.7%,其余处理为0%~2.8%;调pH立即检测组3个添加浓度的回收率均较高,分别是85.1%、91.7%、99.3%。总体来说,是否调pH和静置2 h对菜豆的检测基本上没有影响;菜豆样品匀浆后,加入水或碱液立即检测或静置2 h检测均可。对于结球甘蓝和萝卜,不调pH、调pH静置2 h和冷冻5 d都会降低回收率。综上所述,对于3个不同种类蔬菜,先加入0.025 mol/L KOH溶液10 mL,再加入乙腈高速匀浆离心,在盐析振荡后立即检测是最优方法。
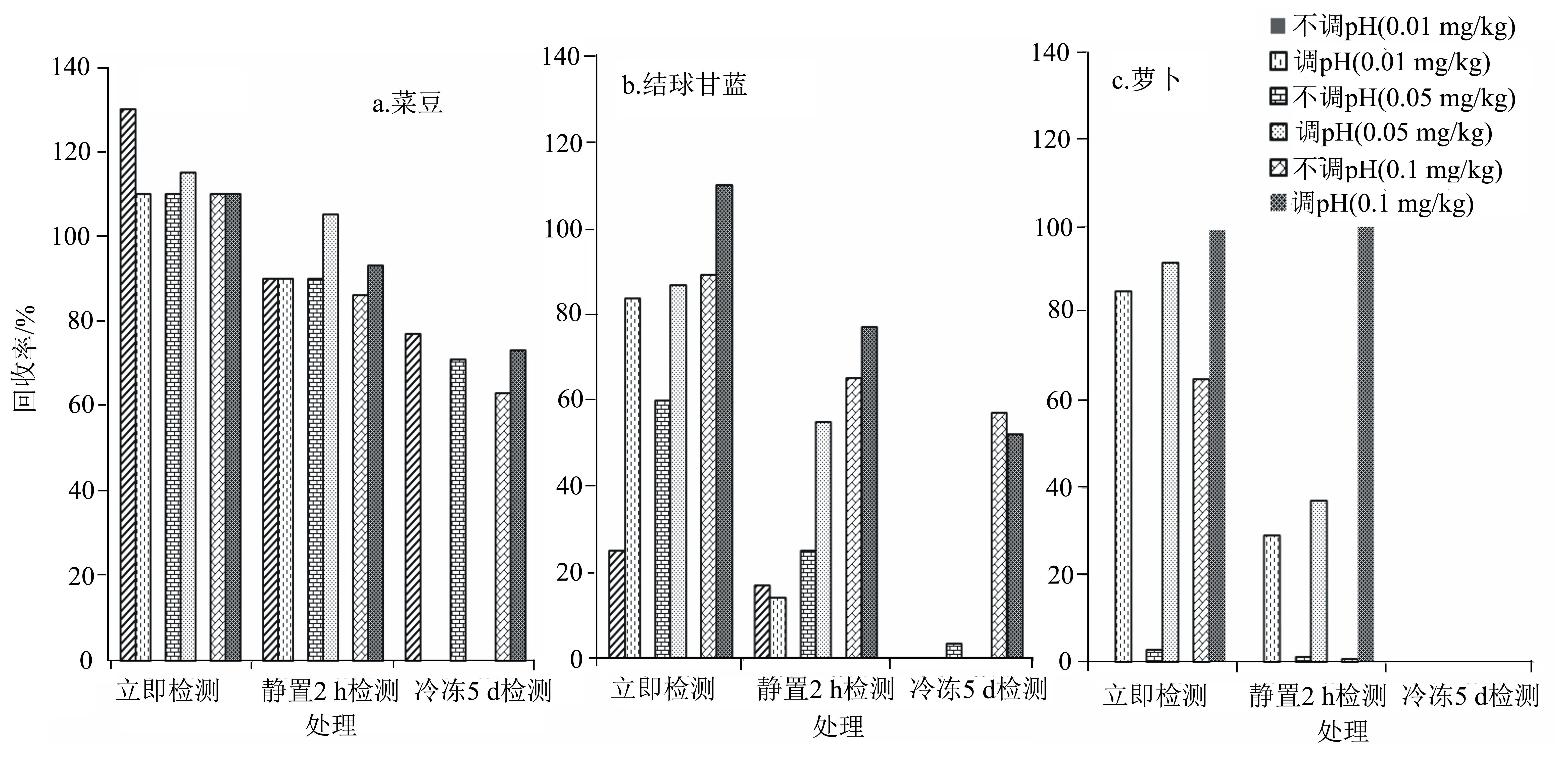
图3 在3种蔬菜基质中不同前处理方法的丁硫克百威回收率
2.4 在前处理过程中丁硫克百威的降解产物
实验结果也表明,菜豆、结球甘蓝、萝卜在不调pH情况下,丁硫克百威的降解量随时间增加而增多,而且添加样品中都有克百威检出,但未检出3-羟基克百威(≤0.001 mg/kg);萝卜中丁硫克百威的降解速度明显快于菜豆和结球甘蓝中的,部分丁硫克百威刚加入就直接分解。在调pH值处理中,样品处于较强的碱性环境中,丁硫克百威在3种基质中的降解速度都有一定程度的减缓,但随着静置时间增加或冷冻,其含量也会逐渐降低,但均未检出克百威(≤0.001 mg/kg)和3-羟基克百威(≤0.001 mg/kg)。根据上述现象可以推断:当待测样品处于酸性环境中时,丁硫克百威易降解并产生代谢产物克百威;在待测样品中加入适量的碱液,调节样品基质到中性或弱碱性时,可以降低其降解速度且不产生代谢产物克百威和3-羟基克百威。
因此,基于丁硫克百威在酸碱性条件下的分解特性,为了准确测定蔬菜中丁硫克百威母体,确保在前处理过程中不生成代谢产物克百威和3-羟基克百威,本研究采用2.3中确定的加入0.025 mol/L KOH溶液、用乙腈匀浆提取、立即检测的前处理方法。在阴性蔬菜样品中添加0.01、0.05、0.10 mg/kg三个浓度水平,每个浓度设6个平行,进行验证实验。结果表明,3个浓度添加水平均未检出克百威(<0.001 mg/kg)和3-羟基克百威(<0.001 mg/kg)。因此,2.3中确定的前处理方法是最优的丁硫克百威母体的前处理方法。
2.5 分析方法的灵敏度、精密度与准确度
用蔬菜空白基质配制1、5、10、25、50、100、200 μg/L的系列标准溶液,在优化的检测条件下上机测定。实验结果表明丁硫克百威在1~200 μg/L范围内线性关系良好,线性方程为Y=-94313.3+4599370X,相关系数R为0.9991。按照2.3中确定的前处理方法,在阴性蔬菜样品中分别添加丁硫克百威 0.01、0.05、0.10 mg/kg三个浓度,每个浓度设6个平行,同时做空白实验,均在扣除本底后计算回收率和相对标准偏差;分别以3倍和10倍信噪比对应的添加浓度作为检出限和定量限。实验结果表明:丁硫克百威在3种蔬菜中的检出限为0.001 mg/kg,定量限为0.005 mg/kg,添加回收率为83.6%~115.4%, RSD为3.2%~9.1%(表3)。因此,该方法的精密度与准确度均符合痕量分析要求。
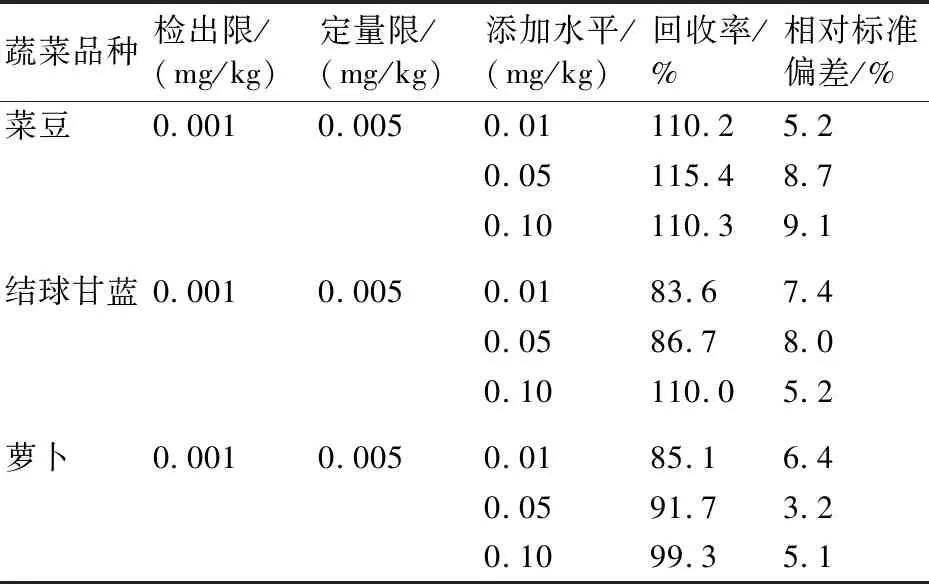
表3 在3种蔬菜中丁硫克百威的检出限、定量限、回收率和相对标准偏差
3 结论
通过对菜豆、结球甘蓝、萝卜三种不同蔬菜基质前处理过程中调节pH值、静置、冷冻条件的实验结果进行比较,最终确定在样品中加入0.025 mol/L KOH溶液涡旋混匀,加入乙腈高速匀浆,盐析并离心,取上清液立即进行检测是丁硫克百威母体的最优前处理方法。同时,确定了最佳的超高效液相色谱-串联质谱检测条件。本方法简便、快速、灵敏度高、重复性好、实用性强,可实现不同蔬菜基质中丁硫克百威母体的准确定性定量分析。
