不同纤维源日粮下东北梅花鹿瘤胃微生物功能基因的宏基因组分析
2020-07-22丛立新赵晨旭刘国文
张 辉,丛立新,魏 园,2,赵晨旭,刘国文
(1.吉林农业科技学院 动物科技学院, 吉林 吉林市 132101;2.吉林农业大学 动物科学技术学院, 吉林 长春 130118;3.吉林大学 动物医学学院, 吉林 长春 130062)
瘤胃微生物在纤维素的降解过程中发挥着重要作用,全球每年植物通过光合作用产生的纤维素高达1.55×109吨,是地球生物圈中最丰富纤维素生物资源,但其中89%尚未被人类利用,纤维素生物质资源的有效生物转化对于可持续生化产品的生产极其重要[1]。瘤胃作为反刍动物消化吸收的重要生态系统,因其在高效降解木质纤维素上的特殊地位,而成为微生物研究者及动物营养学者的重点关注对象[2],国内外学者利用分子生物学方法对纤维素酶分子的结构和功能进行了深入研究,但不同动物瘤胃微生物分泌纤维素酶的能力以及受饲料粗纤维的影响尚不清楚。梅花鹿作为具有典型特色的反刍动物,其瘤胃微生物具有显著的适应环境和饲料的特点,尤其是未受现代工业和生活污染的特性,使其成为研究瘤胃微生物的适宜材料。因此,本试验通过宏基因组测序方法对不同纤维素源日粮下梅花鹿瘤胃微生物进行测序和分析,以能够较深入的探索梅花鹿瘤胃样品中的微生物酶功能多样性,以及它们之间的相互作用机制,为更好的利用瘤胃微生物基因资源和反刍动物鹿的营养研究提供理论依据和数据支持。
1 材料与方法
1.1 试验动物分组与处理吉林农业科技学院试验基地选择健康、体质量相近的3岁东北梅花鹿公鹿10头。试验于2015年7月至9月进行。TIANGEN粪便基因组DNA提取试剂盒(天根生化科技(北京)有限公司)。
将10头健康、体质量相近的公鹿随机分成JG、ZS 2组(每组5头),分别以玉米秸叶和柞树叶为粗纤维源分别与精料混合均匀。饲养试验2个月。试验鹿每头鹿分别隔开成一个喂饲和活动区域,每日采食饲料量为4.5 kg/头。试验用东北梅花鹿不同粗纤维来源饲粮营养水平和组成见表1。

表1 试验用东北梅花鹿不同粗纤维来源饲粮营养水平和组成
饲养试验结束后,瘤胃穿刺收集瘤胃液离心留取上清,使用TIANGEN粪便基因组DNA提取试剂盒提取梅花鹿瘤胃液中微生物总基因,然后对所提取的DNA进行质检。将质检过的基因组DNA打断及相应处理,收集一定长度范围内的目的片段完成测序文库的构建与Illumina MiSeq上机测序,测序后结果利用软件CASAVA (version1.8.2)进行图像碱基识别(Base calling)和优化数据,下机数据经过处理后获得PF data经处理后进行宏基因组的组装。基于组装结果,进行物种注释及丰度分析、编码基因预测,然后对预测出的基因进行KEGG、CAZy 等数据库的功能注释分析。
2.1 检测指标瘤胃微生物总基因测序文库测序后处理后获得PF data经处理后进行宏基因组的组装,然后进行物种注释及丰度分析、编码基因预测,预测出的基因进行eggNOG、KEGG、碳水化合物活性酶数据库(CAZy)等数据库的功能注释分析。
2 结果
2.1 宏基因组测序结果不同处理组鹿瘤胃液样品的宏基因组结果见表2。
由表2可知,通过宏基因组测序的JG和ZS 2组样本的总碱基数量和总序列数量分别为11 150 909 160,12 540 742 633和75 018 396,84 518 090,且ZS组高于JG组,而2组样品的平均序列分别为148.64,148.38 bp 。

表2 2组梅花鹿瘤胃液样品的宏基因组测序结果
2.2 梅花鹿瘤胃样品宏基因组测序的基因功能注释基因KEGG 生物通路数据库注释分析结果见图1。从图1可以看出,不同的代谢途径在JG和ZS 2组差异很大,但2种样品代谢途径的模式总体上相似。其中新陈代谢强度ZS组显优于JG组。

图1 2组梅花鹿瘤胃液样品的KEGG pathway功能分类分布图
CAZy功能注释分析结果结果见图2。可以看出,虽然JG和ZS 2组的碳水化合物活性酶多样性总体上相似,但各碳水化合物活性酶的丰度却存在差异。JG和ZS 2组中GHs的含量最高,分别占总碳水化合物活性酶的49.44%,42.54%,其次为糖基转移酶(glycosyl transferases,GTs)(23.38%,32.67%)、碳水化合物结合模块(carbohydrate-binding modules,CBMs)(21.59%,15.78%)、碳水化合物酯酶(carbohydrate esterases,CEs)(3.4%,6.79%)和多糖裂合酶(polysaccharide lyases,PLs)(1.95%,2.13%),而辅助氧化还原酶(auxiliary activities,AAs)丰度最低,分别仅占总碳水化合物活性酶的0.24%,0.09%。

图2 2组梅花鹿瘤胃液样品的CAZy功能分类分布图
eggNOG功能注释分析结果见图3。结果显示,JG和ZS 2组的功能基因多样性和丰度均存在差异,其中复制、转录、信号传导机制、辅酶转运与代谢等参与主要代谢等功能基因在 2组样品中占主导地位,而次生代谢产物的合成、转运和代谢等功能基因的丰度相对较低些。
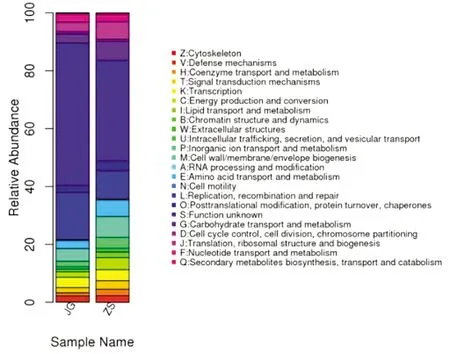
图3 2组梅花鹿瘤胃液样品的eggNOG功能分类分布图
纤维素酶及半纤维素酶的优势类群的分析结果见表3,4。由表3可见,JG和ZS 2组样品中约1/2以上的纤维素GHs来自于Ruminococcus(JG和ZS 2组样品分别为52.79%,51.07%)和Fibrobacter(JG和ZS 2组样品分别为14.22%,15.49%)。除此之外,还有约1%的纤维素GHs来自真细菌属(Eubacterium),Prevotella和Clostridium中的一些种群。同时本试验还发现,在瘤胃中大量存在的拟杆菌门中的拟杆菌属(Bacteroides)对瘤胃中纤维素的降解却没有很大的作用。Epidinium和Polyplastron是原生动物,Piromyces属于真菌门,它们对于纤维素的降解也具有重要作用。另外,JG组较ZS组总体微生物丰度总值高。

表3 编码推定纤维素酶的优势类群的分析
由表4可见,JG和ZS 2组样品中的很大部分半纤维素酶由Ruminococcus(39.20%,37.55%),Prevotella(22.68%,20.66%),Fibrobacter(8.86%,9.48%),Clostridium(2.27%,1.94%)分泌(表4)。此外,Eubacterium,Bacteroides,Polyplastron和Epidinium也是分泌半纤维素酶的优势菌群,对半纤维素的降解有着不可或缺的作用。同样,JG组较ZS组总体微生物丰度总值高。

表4 编码推定半纤维素酶的优势类群的分析

图5 2组梅花鹿瘤胃中参与半纤维素降解的各种GHs的丰度

图6 2组梅花鹿瘤胃中参与寡糖降解的各种GHs的丰度
GHs家族参与植物细胞壁多糖的降解情况见图4~6。由图可见,共有24个GHs家族参与植物细胞壁多糖的降解,参与纤维素、半纤维素和寡糖降解的GHs在 2组梅花鹿瘤胃中含量丰富。在这24中GHs中,GH5、GH9、GH45和GH48为降解纤维素的优势酶类,GH8、GH10、GH11、GH26、GH28、GH51、GH53、GH78对于半纤维素降解起重要作用,而对于寡糖降解起主要作用的有GH1、GH2、GH3、GH43和GH94。总体趋势显示,ZS组参与寡糖降解的酶丰度值高于JG组,而JG组参与半纤维素降解的酶丰度值高于ZS组。
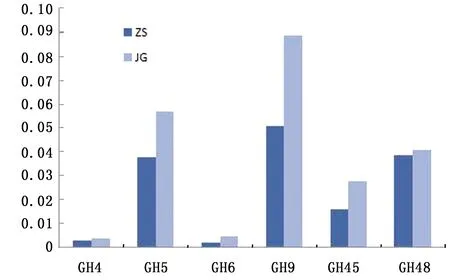
图4 2组梅花鹿瘤胃中参与纤维素降解的各种GHs的丰度
3 讨论
3.1 不同处理组鹿瘤胃液样品的宏基因组测序结果在本试验中,玉米秸叶和柞树叶喂饲的梅花鹿瘤胃微生物宏基因组测序结果显示,JG和ZS 2组样本的总碱基数量和总序列数量分别为11 150 909 160,12 540 742 633和75 018 396,84 518 090,ZS组高于JG组,而2组样品的平均序列分别为148.64和148.38 bp,这可能是由于柞树叶富含适宜瘤胃微生物生长繁殖的营养物质,更适合瘤胃内微生物大量的繁殖和生长[3],因此ZS组样品的总碱基数量和总序列数量均高于JG组。同时在表2中JG和ZS 2个样本测序错误率小于1%的碱基数量百分比(Q20)、测序错误率小于0.1%的碱基数量百分比(Q30)和C+G 的碱基占所有碱基的数量百分含量(GC)分别为95.3%,94.4%和88.88%,87.08%以及44.29%,47.39%,Q20、Q30和GC数据显示 2组样本的数据均满足试验要求,能够较全面地反映样品中功能基因的多样性,为后续试验的顺利进行提供了保障。
3.2 梅花鹿瘤胃样品KEGG pathway功能分析结果虽然JG和ZS 2组的代谢途径的模式总体上相似,但各代谢途径在JG和ZS 2组差异很大,其中新陈代谢途径的差异最大,其在JG和ZS 2组的丰度分别为49.76%,61.62%。提示ZS组梅花鹿饲采食柞树叶更有利于促进新陈代谢率。这与魏园[4]报道结果一致。说明以柞树叶为粗纤维来源组成的日粮对东北梅花鹿营养需求与瘤胃发酵更为有利。
3.3 梅花鹿瘤胃液样品的CAZy功能分析结果JG和ZS 2组的碳水化合物活性酶多样性总体上相似,但各碳水化合物活性酶的丰度却存在差异。本试验结果显示,JG和ZS 2组中GHs的含量最高,分别占总碳水化合物活性酶的49.44%,42.54%,其次为糖基转移酶(glycosyl transferases,GTs)(23.38%,32.67%)、碳水化合物结合模块(carbohydrate-binding modules,CBMs)(21.59%,15.78%)、碳水化合物酯酶(carbohydrate esterases,CEs)(3.40%,6.79%)和多糖裂合酶(polysaccharide lyases,PLs)(1.95%,2.13%),而辅助氧化还原酶(auxiliary activities,AAs)丰度最低,分别仅占总碳水化合物活性酶的0.24%,0.09%,说明2种处理梅花鹿瘤胃微生物功能参与碳水化合物的转运及代谢的相关的基因是最多的,这些结果与张慧敏等[5]报道类似,本试验还显示出JG组碳水化合物活性酶比例高于ZS组,提示JG组日粮中富含碳水化合物促成瘤胃更多的碳水化合物相关的酶基因表达。
3.4 梅花鹿瘤胃液样品的eggNOG功能分析结果eggNOG数据库根据细菌、藻类和真核生物完整基因组的编码蛋白系统进化关系分类构建的基因直系同源簇。通过比对可以将某个蛋白序列注释到某1个eggNOG 中,每一簇eggNOG 由直系同源序列构成,从而可以推测该序列的功能[6]。本试验显示,JG组和ZS组的功能基因多样性和丰度有相同的趋势,其中复制、转录、信号传导机制、辅酶转运与代谢、物质运输与代谢等功能基因在 2组样品中占主导地位,而次生代谢产物的合成、转运和代谢等功能基因的丰度相对较低些,这与印度水牛的报道相似报道类似[7]。
3.5 编码推定纤维素酶、半纤维素酶的优势类群的分析结果在本试验中降解纤维素的GHs主要来自于Ruminococcus,Fibrobacter。而很大一部分半纤维素酶由Ruminococcus,Prevotella,Fibrobacter,Clostridium分泌。其中Fibrobacter可以合成大量具有降解纤维素和半纤维素能力的酶。另有文献报道,瘤胃中降解植物细胞壁多糖的绝大多数GHs来自于拟杆菌门和厚壁菌门,少数由Fibrobacteres分泌[8]。后又有研究发现产琥珀酸丝状杆菌是瘤胃中降解植物细胞壁多糖的优势菌群[9]。
此外,参与纤维素、半纤维素的GHs在 2组梅花鹿瘤胃中含量丰富。在这24中GHs中,GH5、GH9、GH45和GH48为降解纤维素的优势酶类,GH8、GH10、GH11、GH26、GH28、GH51、GH53、GH78对于半纤维素降解起重要作用,参与纤维素、半纤维素的GHs JG组较ZS组总体微生物丰度总值均高。说明瘤胃厌氧真菌和原生动物能够有效的降解纤维素,降解纤维素的优势酶GH5、GH9和GH48来源于瘤胃厌氧真菌和原生动物[10]。因此,厌氧真核微生物降解纤维素和半纤维素比降解寡糖能力要强。
3.6 参与半纤维、寡糖降解的各种GHs的丰度分析结果本试验发现,共有24个GHs家族参与植物细胞壁多糖的降解,其中GH5、GH9、GH45和GH48为降解纤维素的优势酶类,GH8、GH10、GH11、GH26、GH28、GH51、GH53、GH78对于半纤维素降解起重要作用,而对于寡糖降解起主要作用的有GH1、GH2、GH3、GH43和GH94。我们在JG和ZS 2组瘤胃样品中发现很多降解植物细胞壁多糖的微生物,包括真核生物和原核生物。本试验还发现降解纤维素的GH5和GH9以及降解半纤维素的GH10,与张俊等[11]报道结果一致。总体趋势显示,ZS组参与寡糖降解的酶丰度值高于JG组,而JG组参与半纤维素降解的酶丰度值高于ZS组。分析其原因可能是由于纤维分解菌及其分泌的消化酶的活性对纤维素具有一定的依赖性,因此当饲喂含纤维较多的玉米秸叶时降解纤维的菌群如瘤胃球菌属和纤维杆菌属为优势菌群,继而分泌大量的纤维素和半纤维素降解酶;而饲喂含粗蛋白等碳水化合物较丰富的柞树叶时降解可溶性蛋白质、淀粉等非纤维植物成分的普雷沃菌属等菌群为优势菌群,所以糖降解酶的含量降低。
本试验通过宏基因组测序技术研究不同日粮对梅花鹿的瘤胃功能能基因多样性的影响,试验结果表明,当饲喂粗纤维较多的日粮时,以降解纤维素为主的纤维降解酶的比例升高,而寡糖降解酶在瘤胃中的比例降低;当饲喂含丰富可发酵碳水化合物的饲粮时,结果相反。为了这为进一步探究梅花鹿瘤胃中各种微生物类群和功能基因的功能多样性提供试验依据。
