梭状芽孢杆菌对DON处理生长猪肠道屏障和菌群区系的影响
2020-07-22杨婉莹陈红菊袁学军王鹏巍黄丽波王春阳
杨婉莹,陈红菊,袁学军,王鹏巍,黄丽波,王春阳
(山东农业大学 动物科技学院/山东省动物生物技术与疫病防治重点实验室,山东 泰安 271018)
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)又名呕吐毒素,是镰刀菌产生的次级代谢产物,广泛存在于玉米、小麦、大麦等谷物及其产品中[1-2]。DON可通过食物链对人畜造成危害,低浓度的DON能引起动物生产性能降低,采食量下降,体增重、饲料的转化率差,而高浓度的DON可导致人和动物呕吐、腹泻、免疫异常甚至死亡[3-4]。DON分布广泛,2016年我国20个省市饲料及饲料原料DON污染状况分析结果显示,谷物及饲料原料受DON污染相当严重,中等程度以上的污染水平均超过60%[5]。
DON化学结构非常稳定,有较强的酸性和耐热性,在350℃的高温下仍能保持结构稳定,这也是其在饲料中普遍存在的重要原因之一[6]。目前常用的DON脱毒方法有物理、化学和生物法,但物理和化学方法脱毒效果不理想,同时会破坏食物原料中的营养成分,还易造成二次污染[7-8],而微生物降解毒素的方法因其高效环保而受到广泛的关注。研究发现动物肠道的混合微生物菌团对DON的降解率可接近50%[9-10],芽孢杆菌属中的某些菌株甚至可达80%以上[11-12],但多数的相关研究都是用单株菌株直接与DON标准品进行体外降解试验,没有验证其在动物肠道环境中对DON的降解效率和动物使用的安全性。
肠道是DON毒性作用的主要靶标,而肠道屏障的完整性和肠道菌群的多样性与DON的毒性作用密切相关。因此,本试验以生长猪为研究对象,以体外试验DON降解率大于90%的梭状芽孢杆菌(Clostridium)为解毒菌,从肠道屏障和肠道菌群多样性的角度探讨Clostridium对DON处理猪的保护作用和安全性,以期为DON生物降解的实践应用提供理论依据。
1 材料与方法
1.1 菌株Clostridium(CN102485883.B),L10培养基37℃厌氧培养48~72 h。产DON真菌株(Fusariumgraminearum),由中国农业科学院饲料研究所王金全博士惠赠,于大米培养基中27℃培养7 d,烘干粉碎得到DON的粗产品。
1.2 试验日粮,试验动物及试验设计基础日粮参考美国NRC(2012)营养标准配制(表1),污染日粮是在基础日粮的基础上添加终质量浓度为5 mg/kg的DON,试验所需的所有饲料在试验开始前7 d一次性配制完成。饲料中DON、AFB1、ZEA和 FB1均由中国农业科学院农业质量标准与检测技术研究所采用LC-MC检测方法检测。
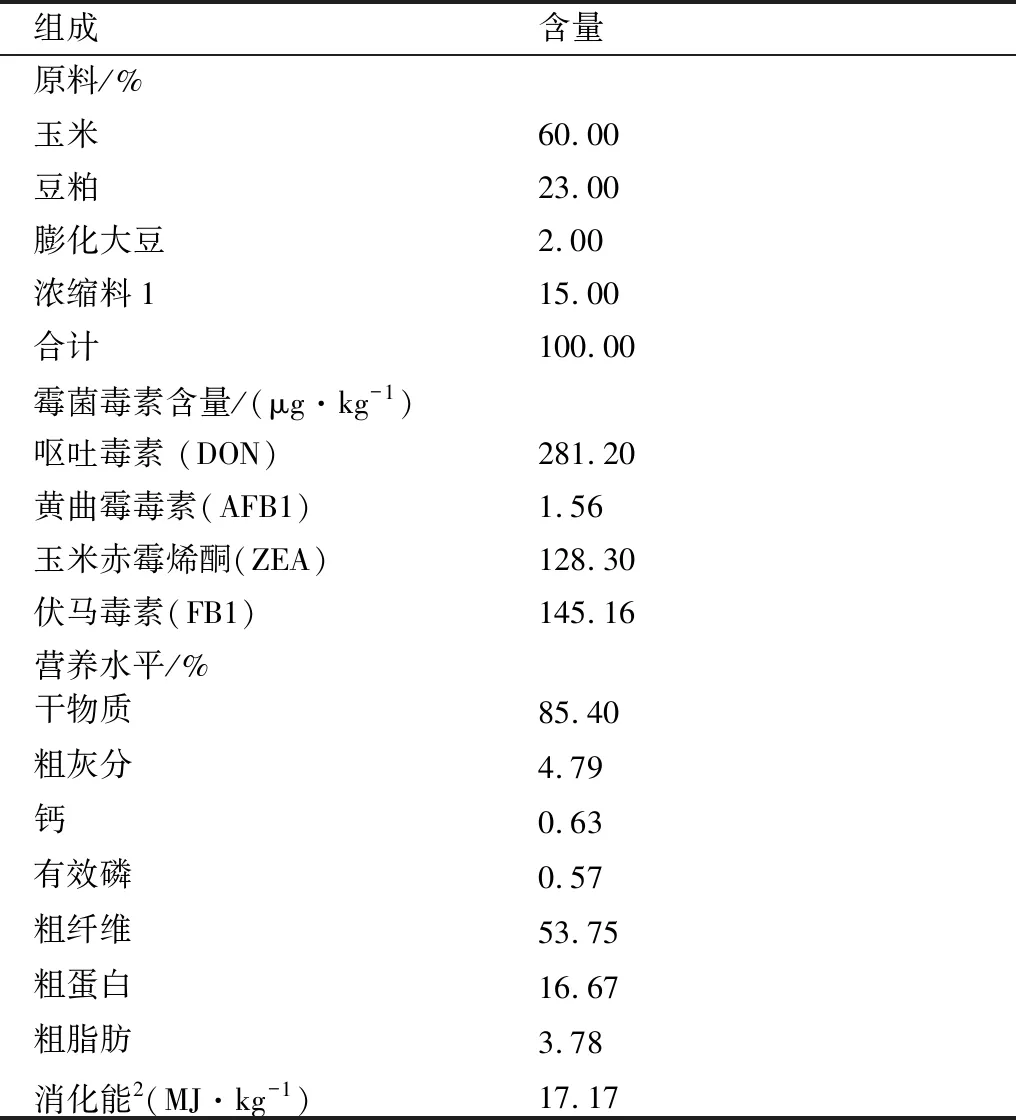
表1 基础日粮成分及营养水平表
试验采用单因子试验设计,选取4月龄日龄体质量为(55.58±1.83)kg的健康PIC父母代生长猪24头,随机分为3组,每组8个重复,每个重复1头猪,组间初始体质量差异不显著(P>0.05)。对照组:饲喂基础饲粮;DON组:饲喂5 mg/kg DON污染日粮;DON+C组:在饲喂污染饲料的基础上,添加Clostridium菌液(15 mL/kg)。预试期7 d,正试期28 d。试验期间自由采食和饮水,饲养和免疫按常规程序进行。
试验结束后,每组屠宰3头,将仔猪电击、放血致死。剖开腹腔后迅速将各个肠段结扎分离,用无菌刀片切取回肠、盲肠和结肠组织(各肠段中段取样)约2 cm,并迅速放入含2.5% 戊二醛的固定液中。同时采集回肠、盲肠和结肠的肠内容物并立即置于液氮中保存。
1.3 组织样品的电镜观察将固定液中的肠道组织块,经酒精梯度乙醇脱水、冷冻干燥、喷金等程序后,应用高分辨激光共聚焦与扫描电镜(ZEISS公司,德国)进行扫描拍照。
1.4 肠道微生物测序及其群落分析提取肠道内容物中的微生物总DNA,测定DNA浓度和纯度,然后每组每个肠段的DNA样品等量混合为1个样品。
16S rRNA高通量测序技术检测猪肠道菌群结构。引物341F(5′-CCTAYGGGRBGCASCAG-3′) 和806R (5′-GGACTACNNGGGTATCTAAT-3′) 用于扩增16S rRNA 基因V3-V4可变区。基于Illumina HiSeq2500(北京诺和生物信息技术有限公司)测序平台,利用双末端测序的方法,构建小片段文库进行双末端测序。通过对Reads拼接过滤,OTUs(Operational Taxonomic Units)聚类,并进行物种注释及丰度分析,可以揭示样品物种构成;并通过α多样性分析(Alpha Diversity)和β多样性分析(Beta Diversity)挖掘样品之间的差异。
2 结果
2.1 肠道的组织形态学电镜观察结果显示,正常对照组的回肠、盲肠和结肠绒毛排列整齐,形态完整;饲喂DON后,各个肠段绒毛均表现出不同程度的损伤,其中回肠部分的受损最为严重,绒毛上皮大片脱落,肠道形态不再完整;添加Clostridium后,小肠绒毛损伤破裂的现象明显得到缓解(图1~3)。

图1 回肠黏膜的扫描电镜图(n=3)

图2 盲肠黏膜的扫描电镜图(n=3)

图3 结肠黏膜的扫描电镜图(n=3)
2.2 肠道菌群丰度及多样性分析采用Illumina HiSeq测序平台获得的用于后续分析的有效序列和平均长度。本次试验数据显示,平均每个样品有42 045条有效序列,其平均长度是388 bp。Chao指数反映微生物丰度,Shannon指数反映微生物的多样性。在同一肠段,各组间Chao和Shannon 指数差异均不显著。3个肠段中,盲肠的Chao和Shannon指数最高,而回肠的最低,反映了盲肠和结肠中微生物的丰度和多样性均高于回肠。
2.3 微生物在门水平和种属水平的变化根据物种注释结果,选取每组样品在门水平上最大丰度排名前10的物种(图4)。从图中可见所有处理组的厚壁菌门(Firmicutes)相对丰度最高(>72%);饲喂DON污染饲料后,回肠和结肠Firmicutes的相对丰度显著降低,而回肠和结肠的拟杆菌门(Bacteroidetes)及回肠的螺旋体门(Spirochaetes)的相对丰度显著增加;添加Clostridium后,这些细菌的数量并没有受到显著影响。结果表明,DON对回肠和结肠的优势菌群有较明显的影响,但对盲肠优势菌群影响不大。

表2 微生物丰度与多样性分析

图4 各组样品前10名物种分布柱状图(门水平) 不能进入前10名的序列被指定为“others”序列。下同
在种属水平上,生长猪回肠排前三的优势菌群分别是乳酸菌(Lactobacillus)(18.7%)、毛螺旋菌(Trichospirillum)(12.7%)和瘤胃球菌(Ruminococccaceae)(9.2%)。饲喂DON后,Lactobacillus和Trichospirillum分别降至5.5%和2.1%,Ruminococccaceae增加至36.5%%。添加Clostridium后,虽然Lactobacillus(9.5%)较之对照组还明显降低,但是Clostridium明显增加,从7.4%上升至14.9%。其他菌种的相对丰度较对照组未有明显的变化(图3-回肠)。
盲肠排前三的优势菌群分别是Lactobacillus(14.1%),Trichospirillum(12.7%)和Clostridium(7.8%)。饲喂DON后,Lactobacillus和Trichospirillum分别降至6.0%和6.2%,Clostridium未有明显变化。添加Clostridium后,Lactobacillus(9.6%)较之对照组还明显降低,但是Clostridium明显增加至15.8%,成为盲肠中最多的优势菌群。值得关注的是,盲肠部分对照组、DON组和DON+C组的“其他类”分别为44.8%,54.5%和48.1%,这一数据均明显高于同一处理组回肠和结肠段的相对丰度值,可能提示盲肠的菌种数更多,也更为复杂。
结肠排前三的优势菌群分别是Christensenellaceae(10.4%),Lactobacillus(10.1%)和Subdoligranulum(9.2%),与回肠和盲肠有较大的差异。饲喂DON后,Lactobacillus和Subdoligranulum分别降至3.9%和5.6%。Ruminococccaceae从3.1%升至7.2%,而消化链球菌属从7.9%降至2.0%。应用Clostridium后,除了Clostridium从6.3%升至14.1%及Subdoligranulum(3.5%)明显低于对照组外,其他几种均较对照组变化不明显。
2.4 样品组内和组间分析样品的组间分析见图6a,花瓣图中每个花瓣代表1个样品组,不同的颜色代表不同的样品组,中间的core数字代表的是所有样品共有的OTU数目,花瓣上的数字代表该样品组特有的OTU数目,结果显示组间差异不显著。样品间的分析见图6b,样本的组成越相似,NUMDS图中显示的距离越近。结果表明,各处理组间回肠部分的差异最为显著。

图5 各组样品间种属水平前10名物种分布 A.回肠;B.盲肠;C.结肠

图6 肠道样品分析 A.组内;B.组间
3 讨论
3.1 DON与肠道形态完整性肠道不仅是动物机体营养物质吸收的主要场所,也是机体抵抗外源病原物入侵的天然屏障。肠道屏障的完整性是有效预防肠道细菌,毒素、炎症介质和其他有害物质通过肠黏膜进入血液的第1道屏障[13]。DON主要被小肠吸收,它可以通过肠道屏障进入血液循环和分布系统,到达周围器官,从而影响细胞的活性和功能。DON会引起动物的肠道组织的损伤,而且DON对肠道形态的影响程度受DON浓度、侵染时间,和动物的年龄的不同而有所不同[14-16]。猪是对DON最为敏感的动物,许多的数据都是关于断奶仔猪的研究,关于生长猪的研究数据相对较少。
本研究结果表明,DON处理组生长猪的回肠、盲肠和结肠的微观结构均不同程度受到损伤,其中回肠段损伤最为明显,而结肠段损伤最轻,这可能是由于猪盲肠和回肠中的某些微生物能够降解DON,也有可能在前段肠段中有部分DON被破坏吸收,到盲肠和结肠中的DON量减少,降低了DON的损伤作用。DON可以通过破坏肠道屏障的完整性从而诱发肠道病变,这与之前的研究结果一致[17]。添加Clostridium后,DON对生长猪肠道屏障的损伤虽然要强于对照组,但较之DON处理组明显减轻。Clostridium可以通过降解DON的毒性作用,从而保护肠道屏障的完整性。
3.2 DON与肠道微生的区系DON在肠道中主要通过旁细胞途径,在小肠上端以被动扩散的方式被快速有效地吸收,DON的毒性作用与其吸收入血的速度和效率成正相关。DON的吸收率在动物中表现出较大的差异,猪、鸡、羊和牛的吸收率分别为82%,19%,9.9%和1%,这些差异主要与动物小肠前后菌群的分布有关[18]。DON在进入反刍动物和家禽小肠之前,就被肠道微生物降解。对于人类和单胃动物来说,DON不能在胃中被水解,同时小肠前部微生物菌群较少,所以人类和猪对DON的敏感性高于家禽和反刍动物[19]。
动物的消化道,特别是哺乳动物的消化道,非常适合微生物的大规模繁殖,哺乳动物胃肠道寄宿着大约1014个微生物,是一个最密集的微生态系统,保持肠道菌群的平衡对维持动物良好健康至关重要。虽然有迹象表明呕吐毒素暴露可能破坏共生菌的平衡和多样性并会引起生态失调,但有关DON对肠道菌群的潜在影响的文献仍较少。有研究显示,给大鼠饲喂DON (100 μg/kg)4周后,拟杆菌数量显著增加,而肠道中拟杆菌属的增殖与腹腔疾病发生和炎性肠病有关[20]。也有研究观察到呕吐毒素暴露(136 μg/kg)改变了肠道后部的菌群,从而导致嗜温需氧菌增加,还原性亚硫酸盐厌氧菌减少[21]。本试验通过16S rRNA基因测序,研究Clostridium和DON对生长猪肠道菌群多样性的影响。结果显示,在门水平上Firmicutes为优势菌群,占72%以上。Spirochaetes位于第2优势菌群。当给猪饲喂DON污染饲料后,回肠和结肠段拟杆门菌相对丰度均明显增加。
在种属水平中,回肠、盲肠和结肠中Lactobacillus的数量最多,回肠中尤其多。在DON组和Clostridium添加组,Lactobacillus的丰度在几个肠段均显著下降。添加Clostridium后,肠道中的Clostridium相对丰度明显增加,说明Clostridium能够在猪肠道中定植,这也可能是Clostridium能够保护肠道健康,抵抗DON毒性作用的重要原因。本研究结果还显示,回肠和结肠的肠道菌群结构受DON的影响明显,而盲肠变化不明显。
综上所述,本试验从肠道屏障完整性及肠道菌群多样性两个方面探讨了Clostridium对DON处理猪的保护作用,但仍需进一步研究其作用机制并优化其培养条件,为DON的生物降解开发利用提供研究基础。
