奶牛子宫组织a-7nAChR介导LPS上调PGE2合成抑制效应
2020-07-22阿如娜魏泓毓贺鹏飞
阿如娜,杨 超,陈 灰,魏泓毓,刘 科,贺鹏飞,2*
(1.内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018;2.农业部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特 010018)
子宫内膜炎是导致奶牛繁殖力显著下降的主要疾病之一,据报道,我国奶牛子宫内膜炎年发病率为30%~40%,在内蒙古自治区患有不孕症的奶牛中约有66.3% 由子宫内膜炎引起,该病极大制约了我国奶牛业的发展[1-3]。前列腺素E2(PGE2)为炎症反应中疼痛和发热的介质,参与炎症的病理生理过程,PGE2的生物合成受3种酶的顺序调控,磷脂酶A2 (PLA2)- 环氧合酶(COX)-前列腺素E2合成酶(PGES)[4-7]。脂多糖(Lipopolysaccharide,LPS)是革兰阴性菌内毒素,在机体受到革兰阴性菌感染时,LPS作用于细胞膜受体引起机体一系列的炎症反应。在奶牛子宫内膜组织、子宫上皮细胞及输卵管上皮细胞中,LPS可上调COX-2和mPGES-1表达促进PGE2合成,这种效应在TAO组眼眶成纤维细胞也有报道[8-10]。PGE2在炎症发生期可促进炎症发展,抑制PGE2的合成具有抗炎效应,其合成途径是抗炎药物筛选的有效靶点。
最新的研究进展表明,激活免疫细胞和内皮细胞上的α-7nAChR 可以调节炎症和免疫反应,并且可能成为治疗炎症疾病及炎性细胞因子相关疾病的新靶点。α-7nAChR由同源的α-7亚基组成的五聚体,其对 Ca2+具有高度通透性[11]。激活α-7nAChR可以通过下调核转录因子NF-κB、Toll样受体4(TLR4)的表达、募集 JAK2 蛋白形成异源二聚体并触发 signal transducer and activator of transcription 3 (STAT3)介导的信号转导,负性调节NF-κB 与 DNA 的结合等机制参与抗炎效应[12]。在人星形胶质细胞中,α-7nAChR可能通过调节PGE2合成发挥抗炎作用[13],但相关研究较少,α-7nAChR是否通过调节PGE2合成发挥抗炎作用有待证实。
在炎性奶牛子宫膜组织中,α-7nAChR是否调控PGE2合成尚无相关研究报道。因此,本研究采用LPS刺激奶牛子宫内膜组织建立子宫内膜炎模型,探讨激动α-7nAChR对PGE2合成的关键酶COX-2 和mPGES-1的表达及PGE2分泌的影响,初步阐明奶牛子宫膜组织α-7nAChR在炎症发生时对PGE2合成的调控机理,以为后续α-7nAChR通过调节PGE2合成发挥抗炎作用机制的研究提供理论基础。
1 材料
1.1 主要试剂及仪器BCA 试剂盒(Thermo,德国);胎牛血清(Inc,中国);6×蛋白上样缓冲液(biosharp,中国);DMEM/F-12(Gibco,美国);PNU-282987(MCE 生物公司,美国);青霉素(Gibco,美国);链霉素(Gibco,美国);脂多糖(LPS,Sigma,美国);两性霉素 B、SDS(GENERAY,中国);甲基牛扁碱(MLA,MCE 生物公司,美国); AxyPrep Multisource Total RNA Miniprep Kit(Axygen Scientific,美国);SYBR Premix Ex TaqⅡ(TaKaRa,日本);Primer Script RT Master Mix(TaKaRa,日本);Prostaglandin E2ELISA Kit-Monoclonal item:514010 (Cayman chemical,美国); T-PER 组织蛋白裂解液、蛋白酶抑制剂(Thermo,德国);Western 封闭液、超敏显色液 ( Pierce,中国 ) ; 蛋白酶抑制剂 ( Pierce,中国 ) ;SDS-PAGE 制胶试剂盒(Solarbio,中国); Trizma base(Sigma,美国);COX-2单克隆抗体 ( Cell Signaling,美国) ;β-actin单克隆抗体(天津三箭,中国);mPGES-1单克隆抗体(Cayman chemical,美国);羊抗兔 IgG HRP-linked、羊抗鼠 IgG HRP-linked(Cell Signaling,美国);抗体稀释液(biosharp,中国);qPCR引物均由 Invitrogen公司合成。
超纯水仪,中国Biotech 公司;高速低温离心机,德国 Beckman 公司;制冰机,日本Panasonic 公司;高压自动蒸汽灭菌锅,日本 Hirayama 公司;酶标仪,美国 Bio-TEK 公司;低速台式离心机,中国上海安亭公司;-80℃低温冰箱,德国Thermo 公司;电子天平,德国Sartorius 公司;-20℃低温冰箱,中国美菱公司;凝胶成像分析系统,法国 Vilber 公司;ABIViiATM7 型实时荧光定量 PCR 仪,德国Life公司;二氧化碳培养箱,德国Thermo公司;超净工作台,日本Airtech公司。
1.2 试验组织健康奶牛双侧子宫角采自内蒙古呼和浩特市某屠宰场,样品保存在无菌生理盐水缓冲液中,1 h内送回实验室,通过肉眼观察卵泡大小及黄体形态,选取发情前期的双侧子宫角部位组织进行组织培养。
1.3 组织培养将新鲜组织用生理盐水(含100 IU/mL双抗,2.5 mg/ L两性霉素 B)冲洗3遍,4℃保存1 h;无菌条件下,纵向剖开子宫角用弯剪刀和眼科镊子取下将含有子宫内膜上皮细胞的子宫内膜组织并剪成直径大小约为2 mm的碎块,放入含有5 mL培养液(DEME/F-12,10%胎牛血清(血清56℃ 热灭火30 min),100 IU/mL双抗,2.5 mg/L两性霉素B)的六孔板中,放入细胞培养箱中(5% CO2、37℃)培养,每天更换1次培养基,连续培养5 d 直至组织生长稳定之后,进行药物处理后收集组织及上清。
1.4 LPS作用时间筛选终浓度1 mmol/L LPS 刺激离体奶牛子宫内膜组织,分别培养 2,4,8,12,24 h,应用 RT-q PCR 技术评估组织中的 IL-6 m RNA 的相对表达量。
1.5 药物处理把培养5 d的子宫内膜组织的培养基换成无双抗的的DMEM/F-12培养基,试验分为8组,分别为空白对照组、LPS组、LPS与α-7nAChR激动剂组(PUN-282987,5,10,15 mmol/L),激动剂试验组分别设立 5 μmol MLA抑制剂组,共7个试验组,每组6个重复,分别培养12 h,收集样品,进行COX-2 和m PGES-1基因及蛋白表达及PGE2的检测。
1.6 总 RNA 提取及 cDNA 合成将各试验组组织称取40 mg,应用组织匀浆机进行研磨,按照说明书提供的方法使用总RNA提取试剂盒提取组织总RNA,通过酶标仪检测总RNA的吸光度,D260 nm/D280 nm值在1.9~2.0,浓度在500~1 000 mg/L之间可进行下一步试验;将总RNA浓度调整到500 mg/L,然后按照说明书提供的方法使用反转录试剂盒mRNA反转录合成cDNA。
1.7 RT-q PCRRT-qPCR 反应体系为:SYBR Premix Ex TaqⅡ 10 μL,上游引物0.4 μL,下游引物0.4 μL,ROX 0.4 μL,cDNA 2 μL,水6.8 μL,总计20 μL;反应条件为:95℃ 预变性30 s;95℃ 变性15 s,58℃ 退火34 s;72℃ 延伸30 s,共40个循环。RT-qPCR 反应中所用的引物序列表见1。

表1 引物序列信息表
1.8 总蛋白提取及浓度测定将各试验组组织称取 40 mg,应用组织匀浆机进行研磨,按照说明书提供的方法使用总蛋白提取试剂盒提取组织总蛋白,按照BCA试剂盒操作说明建立标准曲线并测定各试验组蛋白浓度,以最低浓度的蛋白质样品为基准,调整所有蛋白质样品的浓度一致后,按1∶5比例混合的6×蛋白质上样缓冲液, 置于100℃的金属加热器中5 min使蛋白质变性。
1.9 SDS-PAGE电泳和Western blot检测按照SDS-PAGE凝胶电泳试剂盒说明书,配制12% 的分离胶和5% 浓缩胶,将蛋白样品依次上样,在80V电压下进行电泳。根据预染Marker选择截取目的蛋白所在区域,进行转膜。将转印后的聚偏氟乙烯膜置入封闭液中2 h,一抗4℃ 孵育14 h,TBST液洗膜,10 min /次,共3次;二抗室温孵育1 h,TBST液洗膜,10 min /次,共3次;然后加入显色液进行显色,在成像系统中调节图像参数一致,使用 Image 软件进行灰度值分析。
1.10 ELISA 检测 PGE2奶牛子宫内膜组织培养液10 000 r/min 离心10 min,取上清液,按照 PGE2ELISA 试剂盒操作步骤测定标准品和样品D值,绘制标准曲线并计算样品D值相应的 PGE2浓度。
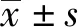
2 结果
2.1 奶牛子宫内膜组织LPS炎症模型时间优化由图1可知,LPS处理奶牛子宫内膜组织之后IL-6 mRNA相对表达水平在12 h最高,并在12 h达峰值,因此本研究选择 12 h作为组织 LPS 刺激炎症模型作用时间。

图1 LPS不同作用时间IL-6 mRNA相对表达水平 不同小写字母间表示差异显著(P<0.05)
2.2 COX-2 和mPGES-1 基因及蛋白表达结果由图2可知,LPS 刺激奶牛子宫内膜组织12 h能够显著上调COX-2 mRNA和蛋白的表达,α-7nAChR特异激动剂PNU-282987 5,10,15 mmol/L均能显著抑制COX-2的表达,α-7nAChR特异抑制MLA能够明显抑制激动剂效应;LPS 刺激奶牛子宫内膜组织 12 h 能够显著上调mPGES-1 mRNA和蛋白表达,α-7nAChR特异激动剂PNU-282987 5,10,15 mmol/L 均能显著抑制mPGES-1 mRNA的表达,α-7nAChR特异抑制MLA可逆转激动剂效应,但仅有5 mmol/L试验组差异显著,激动剂均可抑制mPGES-1蛋白表达,且抑制剂均可显著抑制该效应,均差异显著。

图2 LPS作用奶牛子宫内膜组织12 h 及不同浓度药物处理COX-2和mPGES-1的基因和蛋白相对表达水平 1.对照组;2.LPS;3.5 mmol/L PNU-282987;4.5 mmol/L PNU-282987+5 mmol/L MLA;5.10 mmol/L PNU-282987;6.10 mmol/L PNU-282987+5 mmol/L MLA;7.15 mmol/L PNU-282987;8.15 mmol/L PNU-282987+5 mmol/L MLA
2.3 PGE2的分泌结果由图3可知,与对照组相比较, LPS 刺激奶牛子宫内膜组织 12 h 能够显著促进上清液中PGE2的分泌量,α-7nAChR 特异性激动剂 PNU-282987 5,10,15 mmol/L 均能显著抑制PGE2的分泌,α-7nAChR 特异性拮抗剂 MLA 均可抑制激动剂效应,但只有5,10 mmol/L组差异显著。

图3 LPS 作用奶牛子宫内膜组织12 h及不同浓度药物处理 PGE2分泌水平 1.对照组;2.LPS;3.5 mmol/L PNU-282987;4.5 mmol/L PNU-282987+5 mmol/L MLA;5.10 mmol/L PNU-282987;6.10 mmol/L PNU-282987+5 mmol/L MLA;7.15 mmol/L PNU-282987;8.15 mmol/L PNU-282987+5 mmol/L MLA
3 讨论
奶牛子宫内膜炎是产后奶牛高发疾病,革兰阴性菌感染是产后奶牛子宫内膜炎的主要病因, LPS可被子宫上皮细胞模式识别受体(pattern recognition receptors,PRRs)识别,从而激活胞内信号通路诱导细胞因子的分泌促进炎症发生[14],因此本研究采用LPS建立体外组织炎症模型。IL-6 是评价炎症模型常用的细胞因子[15],由图 1 可知,LPS 处理奶牛子宫内膜组织 12 h IL-6 mRNA 的相对表达量最高且达峰值,因此本研究选择 12 h作为 LPS 处理组织时间点。
前期研究表明, LPS 能诱导奶牛子宫内膜组织中单核细胞、巨噬细胞、内皮细胞COX-2和mPGES-1的表达升高促进PGE2合成,相同的研究结果在奶牛输卵管上皮中也有报道[16]。PGE2具有重要的生理及病理作用,在生殖系统中,小剂量的PGE2在机体排卵,受精、着床及组织再生等生理功能中发挥重要作用,而较大剂量时则对子宫有直接刺激作用[17]。COX-2是机体生成PGE2的限速酶,在生理状态下表达量很少,在病理状态下当机体细胞受到炎性刺激时开始表达。在各种肿瘤和慢性炎症中均可见COX-2的过量表达。COX-2在炎症反应细胞(成纤维细胞、巨噬细胞和滑膜细胞)中大量表达,促进 PGE2的生成而参与炎症反应[18]。mPGES-1与炎症的关系非常密切,其在体外可被炎症因子(LPS、TNF-a、IL-1β)诱导而大量表达,mPGES-1 是 PGE2合成的终末限速酶,与 COX-2 一起参与 PGE2的合成[19]。
抑制COX-2表达及PGE2分泌具有抗炎抗氧化的作用,临床上据此开发多种有效药物,如阿司匹林[20]。激活免疫细胞和内皮细胞上的 α-7nAChR 可以调节炎症和免疫反应。在人星形胶质细胞中,α-7nAChR可能通过调节PGE2合成发挥抗炎作用[10],但相关研究较少,α-7nAChR是否通过调节PGE2合成发挥抗炎作用有待证实。在本研究中,LPS刺激奶牛子宫内膜组织可明显上调COX-2及mPGES-1表达并促进PGE2释放,该结果与前期研究结果一致。不同浓度α-7nAChR特异激动剂PNU-282987预处理奶牛子宫组织均可抑制LPS刺激效应,显著降低了COX-2及mPGES-1表达并抑制PGE2释放,对于COX-2,α-7nAChR特异阻断剂MLA均可显著抑制PNU-282987激动效应;mPGES-1虽在mRNA 水平上只有5 mmol/L试验组MLA可逆转激动剂效应,但在蛋白水平上各组织抑制效应均显著;PGE2释放基本与α-7nAChR介导的COX-2及mPGES-1表达一致。上述结果表明,奶牛子宫内膜组织 α-7nAChR 可通过调控 PGE2的合成途径参与炎症反应。
研究结果表明,奶牛子宫内膜组织α-7nAChR激动剂可抑制LPS上调COX-2 和mPGES-1表达及PGE2分泌效应,证明奶牛子宫内膜组织α-7nAChR介导PGE2合成途径发挥抗炎效应。
