糖尿病和心血管病相关的重要靶点基因PPARγ过表达转基因克隆猪模型的建立
2020-07-22吴彩霞刘朝明颜泉梅张全军欧阳振樊娜娜赖良学
吴彩霞,刘朝明*,颜泉梅,张全军,欧阳振,赵 宇,樊娜娜,赖良学,2*
(1.中国科学院广州生物医药与健康研究院,广东 广州 510530;2.吉林大学 动物医学学院,吉林 长春 130062)
通过靶向修饰关键调控基因制备的动物模型,能够模拟人类疾病发生,对于研究疾病的发病机理与评价治疗策略的安全性和有效性均具有重要意义[1]。在生物医药研究中,啮齿类动物模型往往不能精确有效地模拟某些疾病的发展进程。猪与人类的亲缘关系更近,在很多方面与人类高度相似,主要表现在解剖结构、器官发育、疾病的发展进程等[2]。近年来猪的体细胞克隆和转基因技术发展迅猛,猪作为一种供食用的动物,在开展动物实验时受到的伦理限制少等优势,为科学家利用转基因猪来研究人类疾病发病机制、评估新的治疗方案提供了伦理支持[3]。
近年来的研究发现,过氧化物酶体增殖物激活受体(PPARs)可以改善代谢综合症相关的代谢异常[4]。PPARγ是胰岛素敏感的噻唑类药物(thiazolidinediones,TZDs)的靶标,噻唑烷二酮类药物(例如文迪雅)是胰岛素增敏剂,2006年曾经是临床上销售额最大的治疗糖尿病的药物[5]。PPARγ是调节糖、脂质代谢的重要因子,在血管、心脏组织均有表达[6]。TZDs在 20世纪80年代被作为一种抗氧化剂应用,可降低糖尿病患者血糖水平而不增加血浆胰岛素浓度。由于小鼠和人类心血管系统的差异,在小鼠模型中TZDs激活 PPARγ对心血管疾病具有很好的治疗效果,然而在人的临床应用中发现TZDs会引起肝脏损害、体质量增加等不良反应,导致TZDs使用受到限制[7]。有意思的是,心肌特异性敲除PPARγ的小鼠表现出随年龄增长逐渐进展的心肌肥大,而在小鼠中罗格列酮治疗会引起心肌肥大[8]。而罗格列酮治疗心肌特异性敲除PPARγ的小鼠也同样会引起心肌肥大,只不过程度较轻而已。说明在心肌细胞中,罗格列酮可以不依赖于PPARγ而诱发心肌肥大,但是之前用吡格列酮进行的研究并没有心肌肥大的报道。因此,导致心血管疾病风险增加的TZD类药物特定的靶向PPARγ及其脱靶的功能仍是一个有争议的和有待进一步研究的领域。但由于在小鼠模型中得出的结论并不适用于人类,急需一种新的能够模拟人类的大动物模型用于研究PPARγ在心血管系统中的功能及其与糖尿病的关系,猪的心血管系统与人类比较接近是人类心血管疾病最理想的动物模型[9]。本研究将采用转基因克隆技术,在国际上率先建立PPARγ基因修饰猪模型,为研究PPARγ基因功能提供更好的动物模型。
1 材料与方法
1.1 材料分子试验相关试剂无特殊说明均购自TaKaRa 公司;细胞培养相关试剂无特殊说明均为 Gibco;化学试剂无特殊说明均购自Sigma 公司。试验猪均来自中国科学院广州生物医药与健康研究院医用猪大动物基地;所用细胞均由中国科学院广州生物医药与健康研究院赖良学实验室自己分离冻存;所用卵均由我们从广州市屠宰场取回后由本实验室体外培养成熟。所有动物的饲养管理和使用都符合公共卫生服务条例,动物福利法规以及中国科学院广州生物医药与健康研究院关于保护和使用实验动物的相关政策(国际AAALAC标准);所有的动物实验均按照实验动物使用操作规程进行操作;实验动物饲养和使用均得到中国科学院广州生物医药与健康研究院实验动物管理委员会和实验动物福利和管理委员会的许可,实验动物许可证:#A5748-01。
1.2 猪胎儿成纤维细胞的电穿孔转染及筛选鉴定
1.2.1猪胎儿成纤维细胞的电穿孔转染 取约1×107个细胞,转入电转杯中,加入TALENs质粒与pcDNA 3.1质粒各50 μg,经电转仪共转染猪胎儿成纤维细胞。
1.2.2细胞筛选 电转后细胞分装到15个10 cm培养皿中,隔天换为含G418的细胞培养基,筛选8~10 d后,挑取细胞克隆。
1.2.3挑取克隆 在克隆环中加胰酶覆盖底部,消化5 min后加培养基终止反应。将每个克隆环中的细胞移入48孔板的1个孔中培养,第2天换液。
1.2.4 克隆的传代待培养于48孔板中的细胞克隆长满后需传代并取细胞进行鉴定。
1.2.5克隆的鉴定 加入10 μL NP40裂解液,置于烘箱中裂解,取出置于-20℃冰箱冷却。以细胞裂解液为模板,进行PCR鉴定。
1.3 基因修饰克隆猪的制作
1.3.1成熟液准备 24孔板,每孔0.5 mL成熟液,以石蜡油覆盖后置于CO2培养箱中平衡3 h以上。
1.3.2卵子准备 在配有热台的体式镜下用手吸管捡取卵丘卵母细胞复合物,体外成熟培养42~44 h 后,之后转移入39℃去卵丘操作液,将消化后的卵母细胞转移入盛有操作液的皿中,体式镜下挑取排放第1极体的卵母细胞于另一盛有操作液的皿中保存,待用。
1.3.3制作核移植操作滴: 在皿盖中滴上50μL去核操作滴,排成中间1点、外圈包围5点的形状,另外在外圈滴上2小滴10%PVP,在皿中轻柔加入石蜡油,直至覆盖所有液滴。
1.3.4卵母细胞去核和供体细胞卵周隙注射 固定针轻轻吸住卵母细胞,用注射针吸出极体以及周围的部分胞质,再将1个供体细胞沿刚才的针孔注入卵周隙中。
1.3.5卵母细胞和供体细胞融合以及重构胚胎激活 将平衡好的卵母细胞-供体细胞复合物置于2个电极中间,使去核卵母细胞和供体细胞的接触面平行于2个电极,最后按开关进行电脉冲处理。
1.3.6重构胚胎的体外培养 将重构胚胎加入4孔板中,置于5% CO2、38.5℃、100%湿度的恒温培养箱中培养。
1.3.7胚胎移植 在倒数第1和倒数第2对乳头之间切开,将装好的胚胎移植管,从输卵管伞部慢慢伸入输卵管,将卵巢输卵管还纳回腹腔。以生理盐水冲洗创口后进行缝合。
1.3.8代孕受体的妊娠诊断 胚胎移植后26 d左右进行B超监测妊娠情况,每周进行1次B超,追踪核移植胚胎发育情况。
2 结果
2.1 心脏特异性高表达PPARγ的西藏小型猪的建立以心脏特异性启动子MYH7启动PPARγ的表达,并将此转基因载体转入猪胎儿成纤维细胞,利用此细胞克隆我们共计构建了1 100枚重构胚胎,分别移植到5头受体猪内,经B超鉴定3头怀孕,第1窝生出2个成活克隆猪,第2窝生出2个成活克隆猪,第3窝生出4个成活克隆猪,共计出生8头成活克隆猪,经PCR鉴定8头均为阳性猪模型,经克隆,获得了8只克隆猪(表1,图1)。
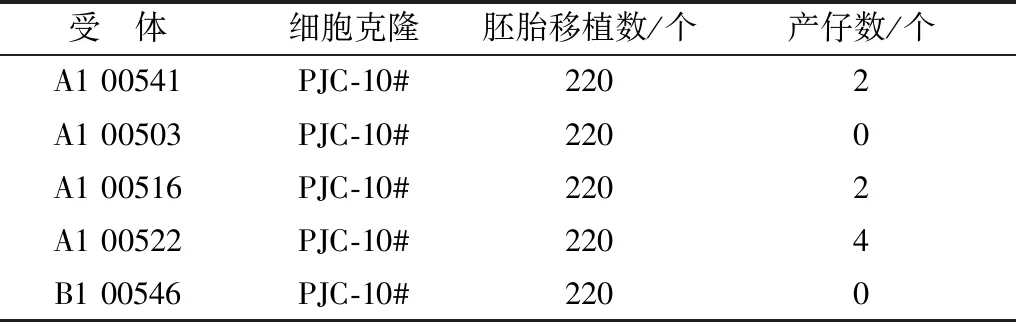
表1 MYH7-PPARγ转基因猪出生结果

图1 8只MYH7-PPARγ转基因克隆猪照片 A.第1窝;B.第2窝;C.第3窝
2.2 心脏特异性高表达PPARγ的西藏小型猪的PCR鉴定新生克隆猪在出生后1周剪取耳组织,利用组织基因组提取试剂盒提取克隆猪基因组DNA,以提取的基因组为模板进行PCR,经PCR鉴定所生的8只猪均是MYH7-PPARγ转基因阳性猪(图2,3),可以满足继续试验的需要。
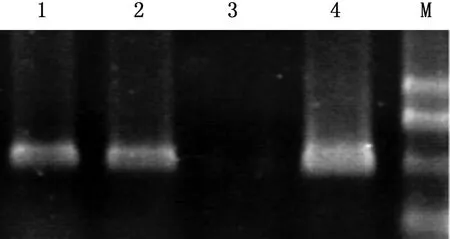
图2 第1窝所生克隆猪PCR鉴定结果 M.DNA Marker;1,2.第1窝克隆猪;3.阴性对照;4.目的基因

图3 第2窝和第3窝所生克隆猪PCR鉴定结果 M.DNA Marker;1~6.第2,3窝克隆猪;7.目的基因;8.阴性对照
2.3 心肌特异性高表达PPARγ的蛋白免疫印迹鉴定分别取2只克隆猪和2只同龄对照猪的左、右侧心肌组织,加入RIPA 裂解液含PMSF(Pierce)裂解组织,用超声细胞破碎仪破碎组织,离心取上清,用BCA 蛋白定量试剂盒测定蛋白浓度后,进行Western blot鉴定,经鉴定PPARγ的西藏小型猪在左、右两侧心肌组织均可高表达PPARγ(图4),可以满足继续试验的需要。

图4 Western blot鉴定克隆猪心脏中PPARγ表达情况
2.4 心脏特异性高表达PPARγ的西藏小型猪的繁殖建系及其鉴定我们将PPARγ的西藏小型猪和WT配种,经过114 d的怀孕足月后顺产分娩获得10头成活F1代仔猪,我们分别在不同位置取耳朵组织并对应进行编号1~10。利用组织基因组提取试剂盒提取克隆猪基因组DNA,以提取的基因组为模板,进行PCR,经PCR鉴定所生的10只F1代猪中有8头是MYH7-PPARγ转基因阳性猪(图5),可以满足继续试验的需要。

图5 心脏特异性高表达PPARγ小型猪的F1代鉴定结果 M.DNA Marker;1~10.F1代猪;11.阴性对照;12.水
3 讨论
多年来,限制小鼠以外的哺乳动物作为转基因动物模型的瓶颈就在于缺少高效的转基因动物制作手段,尤其是基因打靶动物。由于在猪等大动物中尚未获得具有生殖系嵌合能力的胚胎干细胞,使得猪等大动物难以通过ES细胞途径获得转基因和基因打靶动物,猪等大动物的基因编辑长期以来只能依赖于低效率的原核显微注射法。1997年,体细胞核移植技术的成功为猪等大动物的基因编辑提供了新的技术路线。但是目前,哺乳动物体细胞核移植技术的效率还很低,依旧受很多因素影响,包括受体卵母细胞的去核、重构胚的融合与激活、核移植方法等。卵母细胞的去核程度与重构胚重编程的状态密切相关,如果能缩短、简化去核步骤,就可提高效率。目前卵母细胞去核的方法很多,主要有如下几种:示核法,传统的Hoechst33342示核法,可以显示极体与卵母细胞中期板的相对位置,从而可以作为判断去核是否成功的标志[10];盲吸法,利用刚排出的第1极体多位于卵母细胞核物质附近的原理,达到去核的目的。不需要荧光,也避免了Hoechst33342可能对卵母细胞的不利影响[11];化学法,Etoposide+CHX,DC+CHX,Democolcine+sucrose等组合[12]。这种方法可以成批处理卵母细胞;离心法,由于卵母细胞核与细胞质,极体之间的质量不同,可以利用梯度离心法处理,但还没有见到获得克隆后代的报道[13-14]。
转基因克隆动物模型的研究始于1974年,JAENISCH等[15]第1次尝试将SV40病毒的DNA 注入小鼠囊胚腔中获得了嵌合体小鼠,证实病毒DNA可以整合到宿主基因组中,并在1976年,利用病毒感染胚胎的方式获得了第1个携带 M-Mu LV病毒基因组的转基因小鼠品系[16]。1980年,GORDON 等[17]将含有HSV病毒和SV40 病毒DNA的重组质粒注入小鼠受精卵的原核中成功获得2只转基因小鼠,直至目前为止该方法依旧是制备转基因小鼠最经济、方便的技术手段。2年后,PALMITER等[18]利用该方法将小鼠 MT-1基因启动子与大鼠 GH基因的融合基因插入小鼠基因组中,成功研制出著名的“超级小鼠”,证实外源基因可以在哺乳动物体内表达。1985年HAMMER等[19]利用原核注射技术相继成功获得了携带MT-h GH基因的转基因兔、转基因羊和转基因猪,再次迈出了基因修饰动物研究中里程碑式的一步。1997年,英国罗斯林研究院 WILMUT等[20]利用体细胞克隆技术成功获得了克隆羊“多利”,首次证明了哺乳动物体细胞核的全能性,该技术也为转基因克隆猪的研究开辟了新的途径。
PPARγ是胰岛素敏感的噻唑类药物(thiazolidinediones,TZDs)的靶标之一,TZDs是1组被广泛用于治疗2型糖尿病的药物。第1个FDA批准的TZD类药物,曲格列酮,由于在病人中出现肝损伤和肝功能衰竭的报告而被从美国和欧洲市场上撤回。尽管其他的TZD类药物,罗格列酮和吡格列酮,似乎并没有类似的肝损伤风险,但是直到现在,这些药物的使用仍有别的副作用。由NISSEN等[8]于2007年5月发表的分析报告以及其后发表的1份类似结论的分析报告均指出罗格列酮可能增加心肌梗死和心血管病死亡的风险。2个月后,1个FDA的委员会确认罗格列酮可能具有增加心脏缺血的风险,并于2007年8月起,在TZD类药物的标签上加了1个关于心脏衰竭的黑框警告。因此令我们产生疑问的是:究竟TZD类药物用于糖尿病人是否安全?它们到底会增加还是减少病人心血管病的风险,或者根本就没有影响?如果说这些药物具有心血管疾病方面的副作用,那么其机制是什么?这些TZD类药物心血管疾病的副作用是由于其激活了PPARγ引起的呢,还是由于其激活PPARγ的同时还作用于其他靶标引起的所谓脱靶效应?这些问题的解决都迫切需要建立糖尿病和心血管病相关的重要靶点基因PPARγ过表达转基因克隆猪模型。
本研究建立的模型将提供给美国密歇根大学陈育庆教授继续进行后续的研究,其在PPAR及其他相关代谢性核受体的心血管作用方面取得了一系列创新性成果,为理解TDZ类II型糖尿病治疗药物的心血管作用以及研究新的糖尿病和心血管治疗药物提供了理论基础[21-22]。在该模型的基础上进行的后续工作对于人类心血管疾病功能基因组学研究,必将起到重要的推动作用,有助于系统地研究PPARγ基因在心血管系统中的功能及其对糖尿病和心血管病的影响。将会对PPARγ基因在心血管系统中的功能有一个更加全面和深入的认识,同时为PPARγ相关的糖尿病及心血管病治疗新型药物的开发提供新的理论依据和理想动物模型。该模型的建立将有助于第1次在与人类更为接近的大动物模型中系统的回答TZD药物在临床应用中发现的一系列问题,系统地阐明PPARγ基因在心血管系统中的功能及其作用原理,为糖尿病和心血管系统疾病的治疗提供理论依据。 该模型的研究对于糖尿病相关的心血管系统疾病的研究将产生深远的影响。而且,该模型建立将会为其他靶向PPARγ的新型胰岛素激动剂药物的开发提供理想的动物模型。
