伪基因和长链非编码RNA在肾透明细胞癌患者血浆中的表达与临床意义
2020-07-21邹元章何宜宸陈兵海
邹元章, 何宜宸, 陈兵海
(江苏大学附属医院泌尿外科, 江苏 镇江 212001)
肾透明细胞癌占肾肿瘤的比例高达90%,是临床上最常见的肾细胞癌类型,通常简称为肾癌[1]。肾癌起病隐匿,缺乏早期症状,约有30%的患者在首次确诊时已处于晚期或发生转移,且对传统的放化疗方法并不敏感[2]。尽管局部肾癌可通过手术予以切除,但仍有20%~40%的患者最终会发生转移[3]。自2006年国际临床指南中将靶向药物(如舒尼替尼、索拉非尼等)作为一、二线治疗药物用于晚期肾癌和转移性肾癌,肾癌患者的治疗及预后得到了改善[4]。然而,近年来不少患者对靶向治疗也表现出耐药的现象[5]。目前,肾癌尚缺乏长期有效的治疗方法,因此,寻找特异的、有效的生物指标对治疗和改善肾癌患者的预后具有重要意义。
近年来,研究证实伪基因不仅存在于实体恶性肿瘤中,也可在液体肿瘤中检测到[6-7];研究也已发现很多伪基因在多种肿瘤中发生突变并与患者预后相关,具有作为肿瘤患者预后生物标志物的潜能[8]。长链非编码RNA(lncRNA)在肿瘤生物学过程中也起着关键的调节作用,并有可能作为肿瘤标志物用于肿瘤的诊断、治疗及预后判断[9-10]。我们的前期研究已报道了45个伪基因和27个lncRNAs在肾癌患者血浆中差异表达,且与肾癌患者预后相关[11],本研究对相关性最显著的前10个伪基因(PLEKHA8P1、OR2A9P、CXCR2P1、KLRAP1、PDXDC2P、SPACA6P、RNF216P、CFL1P1、FER1L4、PIPSL)和前8个lncRNA(TLX1NB、LINC00623、LINC001565、CDKN2A-AS1、DIO3OS、LINC00482、FAM225B、HAR1A)作进一步分析和验证,分析它们在肾癌发展中的功能以及与患者预后的关系,以探索肾癌的无创性筛查指标和评估预后的分子标志物。
1 材料与方法
1.1 病例
收集2016年11月至2019年4月本院病理科确诊为肾癌患者50例,年龄30~89岁,中位年龄62岁;对照组26例同期体检健康者,年龄20~77岁,中位年龄61岁。所有肾癌患者在采血前无其他肿瘤病史且术前均未行放射或化学药物治疗,术后病理诊断明确,手术后顺利出院并且在住院期间无死亡。本研究获得本院伦理委员会的批准,所有检测样本均在采血前征得研究对象的知情同意。
1.2 细胞系及培养
人胚肾上皮293T细胞系和肾癌786-O细胞系源于美国模式培养物集存库(ATCC),分别用含10% 胎牛血清的RPMI DMEM和RPMI 1640培养液于37℃、5% CO2温箱中进行培养。
1.3 仪器与试剂
大型台式离心机、低温高速离心机(美国赛默飞世尔科技公司);普通PCR仪和QuantStudio 5实时荧光定量PCR仪(美国ABI公司);Trizol试剂(美国Life Technologies公司);REV、GAG、VSVG质粒(上海汉恒生物科技有限公司);qRT-PCR相关的逆转录及扩增试剂盒(南京诺唯赞有限公司);细胞RNA快速提取试剂盒(上海超研生物科技有限公司);胎牛血清、DMEM、RPMI 1640和CCK-8试剂盒(南京福麦斯生物技术有限公司);随机引物(日本TaKaRa公司);引物序列均购自上海生工生物工程股份有限公司。
1.4 方法
1.4.1 血浆样本采集与处理 采用乙二胺四乙酸抗凝的15 mL离心管收集受试者空腹静脉血标本5 mL,于4℃大型台式离心机5 000×g离心10 min后,用移液器吸取上层血浆850 μL至1.5 mL无酶EP管内,再置于4℃高速离心机12 000×g离心10 min,移液器吸取上清液转至新的EP管中,存储于-80℃备用。
1.4.2 血浆RNA提取及逆转录 取出冻存血浆,解冻后用常规Trizol试剂提取血浆总RNA,用核酸蛋白紫外检测仪测定所提取的总RNA浓度和纯度,遵照血浆逆转录试剂盒说明书进行逆转录,将得到的cDNA 保存于-20℃冰箱或直接用于后续实验。反应条件:25℃ 10 min,42℃ 45 min,85℃ 5 min,4℃ 2 min。
1.4.3 细胞RNA提取及逆转录 胰酶消化处理并收集786-O细胞,按组织/细胞RNA快速提取试剂盒说明书提取细胞总RNA,测定总RNA浓度和纯度,随后根据逆转录试剂盒操作说明进行逆转录,得到的cDNA 保存于-20℃冰箱或直接用于后续实验。反应条件:50℃ 15 min,85℃ 2 min,4℃ 2 min。
1.4.4 qRT-PCR 选择5S RNA作为内参,参考qRT-PCR试剂盒说明书加样,取3~4个复孔。采用2-ΔΔCt计算目的基因的相对表达量。引物序列见表1。血浆qRT-PCR反应体系如下:SYBR Green预混液5 μL,上、下游引物各0.5 μL,cDNA模板1 μL,双蒸水3 μL。反应程序:95℃ 1 min,95℃ 10 s,60℃ 30 s,共40个循环。细胞qRT-PCR反应体系如下:SYBR Green预混液10 μL,ROX参比染料0.5 μL,上、下游引物各0.5 μL,cDNA模板1 μL,双蒸水7.5 μL。反应程序:95℃ 30 s,95℃ 10 s,60℃ 30 s,共40个循环;熔解曲线反应条件均设为95℃ 15 s,60℃ 60 s,95℃ 15 s;通过熔解曲线评估引物的特异性。

表1 检测基因引物序列
1.4.5 差异表达基因与肾癌患者预后分析 进入cBioPortal(https:∥www.cbioportal.org/),oncolnc(http:∥www.oncolnc.org/),GEPIA(http:∥gepia.cancer-pku.cn/),UALCAN(http:∥ualcan.path.uab.edu/),Kaplan-Meier plotter(https:∥kmplot.com/analysis/)等数据库,选择或下载肾细胞癌(kidney renal cell carcinoma)临床信息数据,输入目的伪基因和lncRNA,选择survival进行生存分析。
1.4.6 MPH-dCase9介导转录调控实验 用REV、GAG、VSVG质粒构建慢病毒载体,携载目的质粒感染密度为70%~80%的293T细胞,48 h后用EP管收集培养基,300×g离心5 min后将上清液转至新的EP管,即获得目的质粒病毒液;用该病毒液转染786-O细胞,加入适当浓度嘌呤霉素筛选能够稳定表达目的质粒的细胞。依此方法依次将dCase9、MPH、目的基因gRNA-FER1L4和gRNA-DIO3OS导入786-O细胞,PCR验证转染后786-O细胞中FER1L4和DIO3OS的表达。
1.4.7 CCK-8增殖实验观察目的基因上调后786-O细胞的增殖活性 收集密度80%~90%的786-O细胞,用细胞计数板进行计数,按10 000个细胞/孔接种到96孔板中,每组细胞4个复孔,设空白对照组,置于37℃培养箱中孵育2~4 h使细胞贴壁;加入10 μL CCK-8试剂,放入37℃温箱孵育1 h,使用酶标仪(450 nm)测量其光密度(D)值作为0 h的结果。随后每24 h通过相同方法测定D值。相对增殖活性=(实验组D值-空白对照D值)/(对照组D值-空白对照D值)。
1.4.8FER1L4和DIO3OS的miRNA靶标预测及分析 进入StarBase version 3.0数据库(http:∥starbase.sysu.edu.cn/),输入目的基因FER1L4和DIO3OS进行miRNA靶标预测,并分析预测的miRNA在肾癌组织与正常组织中的表达情况;在Kaplan-Meier plotter数据库(https:∥kmplot.com/analysis/)输入相应目标miRNA,选择肾癌样本,分析miRNA表达与肾癌患者预后的关系。
1.5 统计学处理
应用SPSS Statistics 25.0软件进行统计分析,GraphPad Prism 8软件进行图像绘制。选用双侧t检验进行两独立样本比较分析,以P< 0.05表示差异具有统计学意义。
2 结果
2.1 肾癌患者血浆伪基因和lncRNA表达水平
实时荧光定量PCR结果表明,50例肾癌患者和26例体检健康者的血浆样本10个伪基因和8个lncRNA中,有5个伪基因和3个lncRNA差异表达,即伪基因:PLEKHA8P1(t=4.591,P<0.05),CXCR2P1(t=16.134,P<0.01),KLRAP1(t=4.033,P<0.05),PDXDC2P(t=8.492,P<0.01),FER1L4(t=4.523,P<0.05)均高表达。lncRNA:TLX1NB(t=6.261,P<0.01)、DIO3OS(t=6.701,P<0.01)高表达;LINC00482(t=3.925,P<0.05)低表达。见图1。
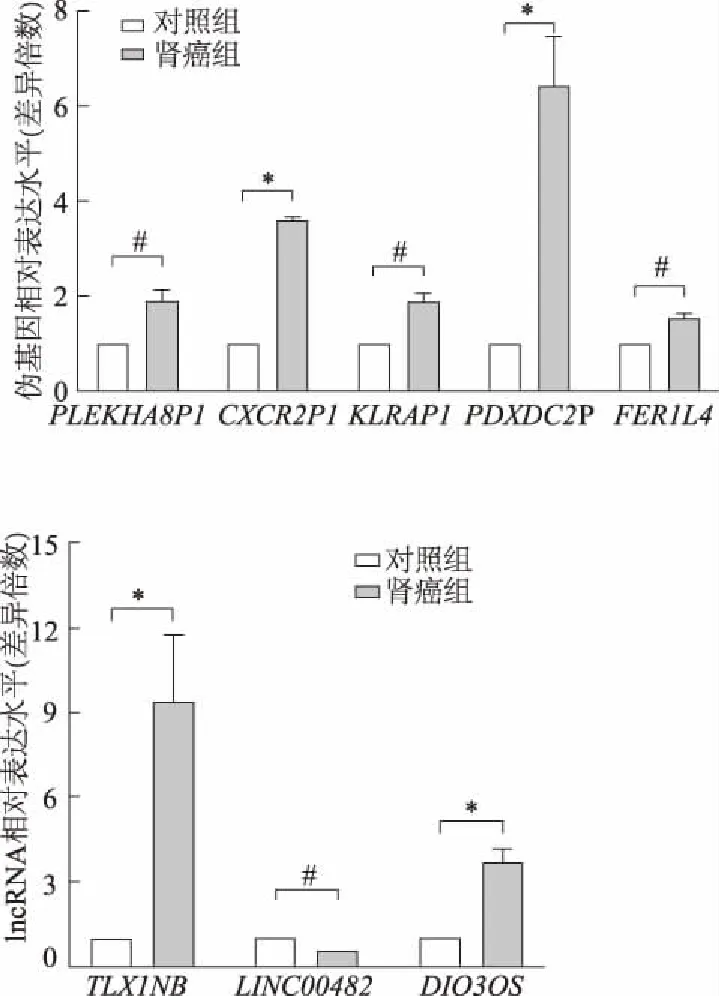
#:P<0.05,*:P<0.01
2.2 差异表达伪基因和lncRNA与肾癌患者预后的关系
通过cBioPortal、GEPIA、oncolnc、UALCAN等数据库分析差异表达的5个伪基因和3个lncRNA在肾癌临床样本中的突变、表达与肾癌患者预后关系。结果显示伪基因PLEKHA8P1、CXCR2P1、FER1L4和lncRNALINC00482、TLX1NB、DIO3OS发生不同频率的突变(图2),且与患者总体生存期相关(图3),其中,伪基因CXCR2P1、FER1L4和lncRNATLX1NB突变还与患者无病生存期相关(图4)。此外,伪基因PLEKHA8P1、KLRAP1、PDXDC2P、FER1L4和lncRNADIO3OS在肾癌中高表达与患者不良预后相关,TLX1NB低表达与患者不良预后相关,见图5。LINC00482表达与患者预后无关(P=0.73)。

图2 伪基因和lncRNA的突变频率

图3 基因突变与总体生存期的关系

图4 基因突变与无病生存期的关系
2.3 成功在786-O细胞系中上调FER1L4和DIO3OS表达
本研究通过MPH-dCase9介导转录调控实验,使dCase9和MPH成功导入786-O肾癌细胞系,即获得786-OdCase9+MPH+细胞系,通过慢病毒载体分别携载gRNA-FER1L4和gRNA-DIO3OS质粒转染786-OdCase9+MPH+细胞,使其在该细胞系中过表达。PCR结果显示FER1L4(t=5.702,P<0.01)和DIO3OS(t=10.954,P<0.01)在实验组细胞的表达明显高于母系786-OdCase9+MPH+细胞,见图6。
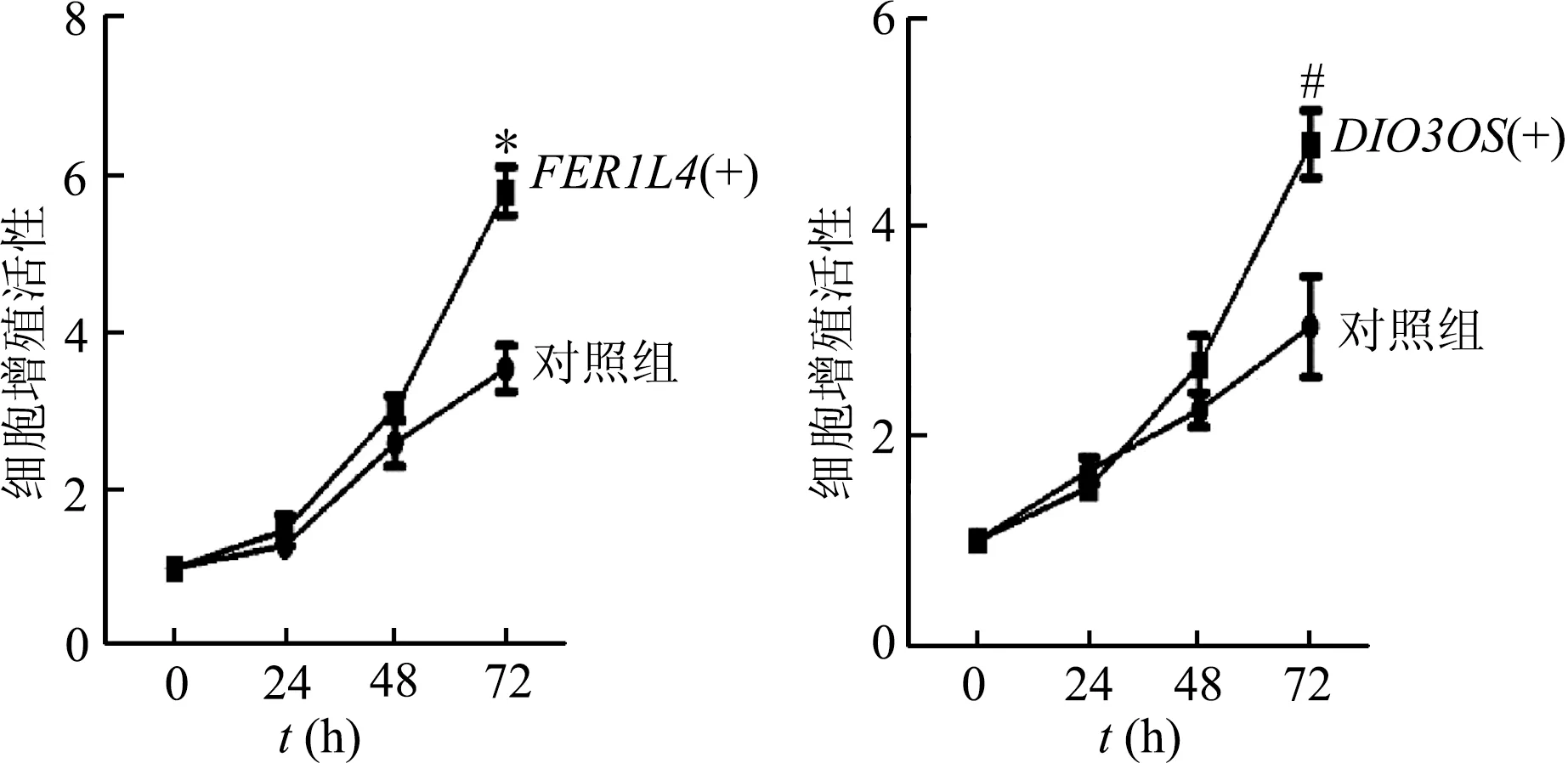
2.4 FER1L4和DIO3OS的异常表达与肾癌增殖密切相关
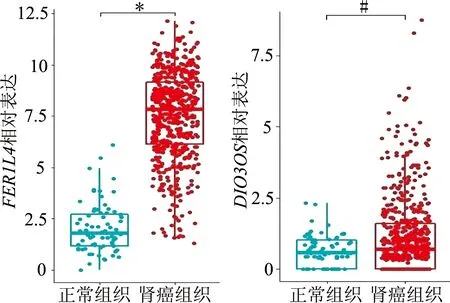
基于目前对伪基因FER1L4和lncRNADIO3OS在肿瘤中的研究相对较多,我们对两者在肾癌发展中的功能作了进一步研究。分析TCGA临床样本发现,与正常组织比较,FER1L4和DIO3OS在肾癌组织中高表达,见图7;CCK-8实验结果显示FER1L4和DIO3OS上调可促进肾癌细胞增殖,见图8。


图5 基因在肾癌中的表达与总体生存期的关系

*:P<0.01
2.5 FER1L4和DIO3OS在肾癌中分别通过调节hsa-miR-556-5p和hsa-miR-660-5p而发挥功能
我们通过StarBase Version 3.0数据库预测了FER1L4和DIO3OS的miRNA靶基因,分别获得24个和13个miRNA;其中,在肾癌中与FER1L4呈负相关的miRNA有2个,即hsa-miR-556-5p(r=-0.150,P=6.49×10-4)和hsa-miR-874-3p(r=-0.389,P=4.18×10-20),而与DIO3OS呈负相关的miRNA为hsa-miR-660-5p(r=-0.133,P=2.52×10-3)。进一步的分析结果表明3个miRNA在肾癌组织中的表达均较正常组织明显降低,见图9。通过Kaplan-Meier plotter数据库进一步分析3个miRNA与肾癌患者预后的关系,结果显示hsa-miR-556-5p和hsa-miR-660-5p低表达与患者不良预后相关,而hsa-miR-874-3p表达与患者预后无关,见图10。综上所述,hsa-miR-556-5p和hsa-miR-660-5p可能是FER1L4和DIO3OS在肾癌中的潜在作用靶点。
*:t=21.130,P<0.01;#:t=2.682,P<0.05
*:t=6.786,P<0.01;#:t=4.221,P<0.05
3 讨论
伪基因是与已知的编码基因序列非常相似的片段,这些编码基因称为母基因或真基因,据HGNC数据库(https:∥www.genenames.org/)最新统计,已有13 511个伪基因被发现。伪基因具有过早的终止密码子、缺失、插入和突变而缺乏母基因编码蛋白质或多肽的功能,因而曾被认为是生物分子过程中无关紧要的基因片段[12]。然而,随着首个伪基因PTENP1的功能鉴定和报道,伪基因在人类疾病尤其是肿瘤中的功能逐渐受到关注[8,13]。Wang等[14]研究发现,肝细胞癌样本中伪基因RACGAP1P表达水平较正常肝组织明显升高,且与肿瘤大小、临床分期、甲胎蛋白水平、早期复发及预后相关。类似地,Weng等[15]研究结果显示胃癌组织伪基因PTTG3P较正常组织表达明显升高,PTTG3P高表达可促进胃癌细胞增殖、迁移和侵袭,并与胃癌患者不良预后相关;此外,PTTG3P高表达还与乳腺癌患者预后相关[16]。这些结果提示伪基因在肿瘤组织中表达异常,具有作为肿瘤预后标志物的潜能。与伪基因类似,lncRNA也曾被认为是不发挥作用的长度大于200 bp且不具备蛋白编码功能的转录本。然而,随着研究的深入,lncRNA被发现在肿瘤生物过程中发挥着重要的调节作用甚至是关键作用,而且lncRNA的功能仍不断被揭示[17-18]。目前,已有大量研究显示lncRNA在肿瘤发生发展的多个方面发挥作用,包括肿瘤细胞增殖、迁移、侵袭、远处转移、淋巴结转移、凋亡、化疗药物及靶向药物耐药等[19]。因而lncRNA很有可能成为肿瘤诊断和预后的标志物,以及为肿瘤治疗提供特异性靶点。

图9 hsa-miR-556-5p、hsa-miR-660-5p和hsa-miR-874-3p在TCGA肾癌样本中的表达

图10 hsa-miR-556-5p、hsa-miR-874-3p和hsa-miR-660-5p与肾癌患者预后的关系
已有许多文献报道在血浆中也可检测到异常表达且较为稳定的伪基因和lncRNA,可作为无创性检测方法[20-22]。本研究在肾癌患者血浆中检测到伪基因PLEKHA8P1、CXCR2P1、FER1L4、KLRAP1、PDXDC2P和lncRNATLX1NB、DIO3OS均高表达,并与患者预后显著相关,而LINC00482在肾癌患者血浆中表达下降,但LINC00482和TLX1NB与总体生存期的关系与血浆检测结果的预期不符,因而LINC00482和TLX1NB不作为我们进一步深入研究的目的基因。
有文献报道伪基因FER1L4在胶质瘤中高表达,并与胶质瘤患者预后相关,可作为胶质瘤预后风险信号之一;另外,miR-372高表达可导致FER1L4和E2F1下调,从而可抑制细胞周期进程进而抑制胶质瘤细胞增殖[23-24];因此,FER1L4不仅与预后相关,还与肿瘤发生发展有关。CXCR2P1仅在肝细胞癌差异基因分析中报道可能作为肝癌分期的特异指标之一,而伪基因PLEKHA8P1仅被报道在一名10岁智能障碍男孩12号染色体上出现缺失[25],PDXDC2P仅在心力衰竭中被报道[26],它们在肿瘤中的研究尚未见报道。关于伪基因KLRAP1相关研究尚未见报道。已有文献报道lncRNADIO3OS在胰腺癌组织和细胞中均高表达,DIO3OS通过与miR-122直接结合并抑制其表达进而促进胰腺癌细胞增殖和侵袭,发挥促癌基因的作用[27];DIO3OS也与肝细胞癌预后相关,可能为肝细胞癌预后标志物[28]。内源性竞争RNA是lncRNA和伪基因的重要调节机制[29],而这些研究结果也提示FER1L4和DIO3OS作为内源性竞争RNA与miRNA结合进而影响肿瘤发生发展及预后。
本研究对肾癌样本进行分析,发现FER1L4和DIO3OS在肾癌组织中高表达且与患者不良预后相关;体外实验结果表明它们的过表达还可促进肾癌细胞增殖。进一步探索它们的机制显示FER1L4和DIO3OS可能是分别通过调节hsa-miR-556-5p和hsa-miR-660-5p而发挥作用。
综上所述,伪基因PLEKHA8P1、CXCR2P1、KLRAP1、FER1L4、PDXDC2P和lncRNADIO3OS可能作为肾癌的无创性分子生物指标。然而,目前对伪基因PLEKHA8P1、CXCR2P1、KLRAP1、PDXDC2P的研究还很少,它们在肿瘤生物过程中的作用尚不清楚,因此有待于更多的研究和样本进一步论证;而伪基因FER1L4和lncRNADIO3OS在肾癌中的作用和机制也需更多实验数据进一步证实和支持。
