人脐带间充质干细胞来源外泌体促进小胶质细胞向M2极化
2020-07-21周新茹金倩张蕾蕾吴佩佩傅强钱晖
周新茹, 金倩, 张蕾蕾, 吴佩佩, 傅强, 钱晖
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 上海交通大学附属第一人民医院脊柱外科, 上海 200080)
小胶质细胞是中枢神经系统的天然免疫细胞,与多种神经退行性疾病和脑炎性疾病的发病机制有关。它起源于胚胎卵黄囊原始髓系祖细胞[1-2],占脑部组织细胞5%~15%[3]。小胶质细胞通过其独具特点的“分枝”状结构,行使清除损坏组织、阻止毒性和死亡扩展的免疫学作用。此外,小胶质细胞可通过调控轴突生长、髓鞘形成和突触重塑来促进神经连接,从而调节神经发生、神经胶质形成和神经元迁移[4-6]。研究表明M1极化态小胶质细胞可加剧组织损伤,M2极化态有助于减少炎症并促进组织修复[7]。中风、阿尔茨海默病(Alzheimer’s disease,AD)和帕金森病(Parkinson’s disease,PD)等神经退行性疾病可致M1小胶质细胞过度极化,加重组织损伤。
本课题组前期研究表明,人脐带间充质干细胞外泌体(human umbilical cord mesenchymal stem cells exosomes,hucMSC-Ex)可通过降低炎症反应缓解肠炎、减少皮肤烫伤程度和肾损伤等[8-11]。在此基础上,本研究旨在探讨hucMSC-Ex能否通过促进小胶质细胞向M2极化以减少炎症反应,为治疗炎症性相关神经系统疾病提供可靠的治疗方案。
1 材料与方法
1.1 主要材料和仪器
大鼠小胶质细胞购自上海钰博生物科技有限公司;脂多糖(lipopolysaccharides,LPS,日本Sigma公司),兔抗人CD9单克隆抗体(美国CST公司),兔抗人CD63/CD81多克隆抗体(美国Proteintech公司),兔抗大鼠Iba1多克隆抗体(英国Abcam公司),小鼠抗大鼠iNOS/Arg1单克隆抗体(美国Santa Cruz Biotechnolog公司),兔抗大鼠p-NF-κB p65/NF-κB(美国CST公司),兔抗大鼠β-肌动蛋白(美国Bioworld公司),HRP标记抗兔/鼠IgG二抗(美国Invitrogen公司),BCA蛋白定量试剂盒(康为世纪公司),ELISA试剂盒(中国Excell Bio公司),外泌体提取试剂盒(美国SBI公司);Stepone plus荧光定量PCR仪(美国ABI公司),ImageQuant LAS 4000 mini化学发光成像仪、激光扫描共聚焦显微镜(美国GE公司),纳米颗粒分析仪(德国Particle Metrix公司),FEI Tecnai 12透射电子显微镜(荷兰Philips公司)。
1.2 hucMSCs培养及其外泌体分离
体外分离扩增hucMSCs,采用10% 胎牛血清的α-MEM培养基在37 ℃、5% CO2条件下培养。hucMSCs细胞融合率达70%~80% 时,弃上清液,PBS洗涤后更换为相应的不加血清空白培养液继续培养48 h,收集上清液立即置4 ℃、300×g离心10 min去除漂浮细胞等杂质,-80 ℃保存备用。应用外泌体提取试剂盒,结合超速离心法获得浓缩hucMSC-Ex,BCA蛋白定量试剂盒检测hucMSC-Ex总蛋白浓度。
1.3 透射电镜和纳米颗粒跟踪分析技术检测hucMSC-Ex形态与粒径大小
准备100 μL(浓度约为5.0×107个/mL)hucMSC-Ex,纳米颗粒分析仪进行粒径检测及数据分析。一次取20 μL hucMSC-Ex,混匀后滴加在铜网上,室温静置5 min,吸去残余液体后倒扣于30 g/L 磷钨酸(pH 6.8)液滴上,负染5 min,烘干后置于透射电镜下观察拍照。
1.4 蛋白质印迹法检测hucMSC-Ex表面分子、小胶质细胞表型标志物及信号通路相关蛋白
预先配置12% SDS-PAGE胶,200 μg蛋白量上样,80 V电泳,350 mA/120 min电转印至PVDF膜上,5%脱脂牛奶室温封闭1 h,分别与CD9抗体(1 ∶ 500)、CD63抗体(1 ∶ 500)、CD81抗体(1 ∶ 500)、β-肌动蛋白抗体(1 ∶ 10 000)、iNOS抗体(1 ∶ 50)、Arg1抗体(1 ∶ 50)、兔抗大鼠p-NF-κB抗体(1 ∶ 500)、兔抗大鼠NF-κB抗体(1 ∶ 500)孵育,4 ℃过夜,TBS/T洗涤后,与HRP标记抗兔/鼠IgG二抗37 ℃ 温育1 h,TBS/T洗涤,加入预先混合的 HRP化学发光底物,至化学发光成像仪检测。
1.5 免疫荧光检测小胶质细胞标志物Iba1表达
将小胶质细胞分为3组,分别用PBS(PBS组)、1 μg/mL LPS(LPS组)、1 μg/mL LPS加100 μg/mL hucMSC-Ex(LPS+hucMSC-Ex组)处理12 h。PBS、LPS和hucMSC-Ex处理过的小胶质细胞玻片用PBS清洗后,4%多聚甲醛固定30 min,PBS清洗;5% Triton室温破膜15 min,PBS清洗;滤纸吸干多余液体,滴加5% BSA,室温封闭30 min;去封闭液,直接滴加Iba1(1 ∶ 300稀释)抗体放入湿盒,4 ℃孵育过夜,TBS/T清洗;滴加稀释好的荧光二抗(注意避光),于湿盒中37 ℃孵育1 h,TBS/T 清洗;DAPI染核,避光孵育10 min,TBS/T 清洗;封片固定,荧光显微镜下观察染色情况并拍照。
1.6 qRT-PCR检测IL-1β mRNA和IL-10 mRNA
收集小胶质细胞(约5×105个),加入1 mL Trizol试剂提取细胞总RNA,按产品说明书将RNA逆转录成cDNA,置-20 ℃保存。qRT-PCR反应体系20 μL,包括2×Ultra SYBR Mixture(High ROX)10 μL、前向引物0.5 μL、后向引物0.5 μL、cDNA 2 μL、无RNA酶H2O 7 μL。参数设置: 95 ℃ 预变性15 min,94 ℃ 15 s,60 ℃ 30 s,70 ℃ 30 s,共40个循环,重复3次。
1.7 ELISA检测小胶质细胞上清液中IL-1β和IL-10的浓度
收集处理后的小胶质细胞上清液1 mL,按产品说明书操作,绘制标准曲线并求出标本中IL-1β和IL-10的浓度。
1.8 统计学分析
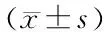
2 结果
2.1 hucMSCs原代培养及hucMSC-Ex鉴定
图1A为P1代hucMSCs典型形态。收集P3至P8代hucMSCs无血清外泌体培养上清液提取hucMSC-Ex,透射电镜观察囊泡的形态,呈典型的膜性“杯盘”状形态(图1B),纳米颗粒跟踪分析检测hucMSC-Ex的粒径大小为(119.7±47.9)nm(图1C)。免疫印迹法检测hucMSC-Ex表达CD9、CD63和CD81表面分子(图1D)。以上结果显示成功分离了hucMSC-Ex。

A: P1代hucMSCs典型形态(×40);B:透射电镜显示hucMSC-Ex典型形态(×12 500); C:纳米颗粒跟踪分析检测hucMSC-Ex粒径分布;D:免疫印迹法检测hucMSC-Ex表面标志物
2.2 hucMSC-Ex促进小胶质细胞向M2极化
细胞免疫荧光检测结果显示LPS组Iba1较PBS组高表达,LPS+hucMSC-Ex组Iba1增加更明显(图2A),说明hucMSC-Ex可以进一步促进小胶质细胞活化。免疫印迹法检测M1极化态标志物iNOS和M2极化态标志物Arg1的表达,结果表明hucMSC-Ex能够减少iNOS的表达、增加Arg1的表达,同时也发现hucMSC-Ex能够抑制NF-κB的磷酸化(图2B)。qRT-PCR结果也显示hucMSC-Ex能够减少小胶质细胞IL-1β mRNA表达(P<0.05),上调IL-10 mRNA表达(P<0.05)见图2C, 2D。以上结果提示hucMSC-Ex可能通过抑制NF-κB的活化促进小胶质细胞由M1型向M2型极化。
2.3 hucMSC-Ex促进小胶质细胞向M2极化以减少炎症反应
收集处理12 h后PBS组、LPS组和LPS+hucMSC-Ex组细胞上清液,ELISA检测上清液中炎症因子IL-1β和IL-10的含量(图3),结果显示hucMSC-Ex组较LPS组促炎因子IL-1β分泌减少(P<0.05),抑炎因子IL-10分泌增加(P<0.01)。表明hucMSC-Ex可以减少小胶质细胞促炎因子和增加抑炎因子的分泌。

A:免疫荧光检测小胶质细胞标志物Iba1表达(×600);B:免疫印迹法检测小胶质细胞极化态标志物变化;C、D:qRT-PCR检测小胶质细胞IL-1β、IL-10的表达

图3 不同处理组小胶质细胞上清液中细胞因子的变化
3 讨论
由于脑部功能的复杂性,神经退行性疾病的治疗一直是个难题,主要原因在于组织难以再生和持续性神经炎症等。已有文献报道,干细胞移植可用来治疗神经退行性疾病[12-14],而外泌体非细胞疗法与干细胞治疗相比具有减少免疫排斥、利于保存、取用方便和减少炎症等优势。小胶质细胞是中枢神经系统主要的免疫细胞,本研究聚焦于hucMSC-Ex促进小胶质细胞极化,降低神经炎症研究。
小胶质细胞可分为三种状态,即M0静息态、由LPS和(或)IFN-γ激活的M1极化态小胶质细胞、由IL-4和(或)IL-13激活的M2极化态小胶质细胞[15]。M1极化态小胶质细胞释放大量的促炎性因子(IL-1β、TNF-α等),氧化还原分子(氧化酶、iNOS等),趋化因子和MHC-I等,可作为M1极化态的标志物[16-17];M2极化态小胶质细胞则诱导Arg1、Ym1和MMR表达,可作为M2极化态的标志物[18]。本研究结果发现hucMSC-Ex能够促进LPS诱导的小胶质细胞iNOS蛋白减少、Arg1蛋白增加、IL-1β mRNA减少和IL-10 mRNA增加,且上清液中促炎因子IL-1β减少、抑炎因子IL-10增加,同时也发现hucMSC-Ex能够减少NF-κB的活化。NF-κB被认为是炎症介质的中心转录因子,在小胶质细胞极化和其介导的中枢神经炎症反应过程中起着至关重要的作用[19-20]。在创伤性脑损伤研究中发现,ω-3PUFA通过SIRT1介导的HMGB1/NF-κB途径的去乙酰化作用调节小胶质细胞极化来减弱炎症反应[21]。在急性缺血性脑卒中的研究中发现,Notch信号可通过使NF-κB通路蛋白泛素化,进而影响小胶质细胞极化态转变[22]。故我们猜想hucMSC-Ex有可能也是通过减少NF-κB的活化而发挥转变小胶质细胞极化态的作用。以上结果表明hucMSC-Ex能够促进M1小胶质细胞向M2极化以减少炎症因子分泌,为治疗炎症相关神经退行性疾病提供新的治疗方法。
该研究探讨了hucMSC-Ex可能通过抑制NF-κB信号促进炎症型小胶质细胞向抑炎表型转化,但其进一步的作用机制仍需深入探讨。因不同药物单独或联合刺激,M1极化态小胶质细胞显示不同的功能。因此,使用不同药物单独或联合刺激小胶质细胞,hucMSC-Ex能否诱导其向非炎症型极化以及其中的具体机制需要进一步研究。后继研究中,我们将hucMSC-Ex应用于动物模型中,从体内外两方面,进一步探讨hucMSC-Ex在治疗神经退行性疾病中的作用。
