间充质干细胞外泌体调控氧化应激减轻D-氨基半乳糖/脂多糖诱导的急性肝损伤
2020-07-21赵佳伟施敏郑金旭
赵佳伟, 施敏, 郑金旭
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 上海交通大学医学院附属同仁医院消化内科, 上海 213300; 3. 江苏大学附属医院呼吸内科, 江苏 镇江 212001)
急性肝损伤是一种严重影响人生命健康甚至危及生命的疾病,其发病多与氧化应激的发生相关,在氧化应激发生时,肝脏内活性氧水平大幅度上升[1]。活性氧能够通过脂质过氧化、蛋白质变性方式造成细胞的损伤和变性[2],研究表明间充质干细胞外泌体能够修复受损组织[3-4]。本研究旨在考察间充质干细胞外泌体对D-氨基半乳糖(D-galactosamine hydrochloride, D-GalN)/脂多糖(lipopolysaccharides, LPS)诱导的急性肝损伤模型小鼠的治疗效果。从细胞和动物水平考察外泌体减轻氧化应激、保护肝脏的效果,为急性肝损伤的治疗提供新的思路。
1 材料与方法
1.1 试剂和仪器
DMEM、RMPI 1640培养基、α-MEM、胎牛血清、青霉素/链霉素双抗溶液(美国Gibco公司),胰酶(北京兰博利德公司),醋酸双氧铀(北京中镜科仪技术有限公司),L02人肝细胞系(上海中科院细胞库),CD9兔抗小鼠单克隆抗体、CD63小鼠抗小鼠单克隆抗体、山羊抗兔二抗、山羊抗小鼠二抗(英国Abcam公司),BCA蛋白定量试剂盒(美国Thermo Scientific公司),小鼠成骨诱导分化培养试剂盒(赛业生物有限公司),丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)测定试剂盒(日本Toshiba公司),电泳仪(美国Bio-Rad公司),多色荧光凝胶成像仪(以色列DNR公司),CCK-8试剂盒、二氯二氢荧光素-乙酰乙酸酯(2′,7′-dichlorofluorescin diacetate, DCFH-DA)活性氧荧光探针、D-GalN、LPS、超氧化物歧化酶活性检测试剂盒、丙二醛含量检测试剂盒、过氧化氢酶活性检测试剂盒(北京索莱宝科技有限公司),JEM-1400透射电镜(日本电子株式会社)、尼康A1型激光共聚焦显微镜(日本Nikon公司),Vectra荧光显微镜(美国Perkin Elmer公司),NTA纳米颗粒跟踪分析仪(德国Particle Metrix公司),全自动生化分析仪(日本Toshiba公司)。
1.2 骨髓间充质干细胞的分离、培养和鉴定
采用全骨髓法提取骨髓间充质干细胞。5~6周的雌性Balb/c小鼠处死后消毒备用,取出小鼠的股骨和胫骨,将骨髓冲出,转移至50 mL无菌离心管,1 500 r/min离心5 min。加入红细胞裂解液将红细胞裂解,重复洗涤2次。获取的细胞接种在6孔板内,然后将细胞放入培养箱中静置。培养48~72 h后第1次给细胞换液,培养至第10~14 d时,进行细胞传代。利用流式细胞仪对间充质干细胞表面的CD29、CD31、CD44、和CD117蛋白进行鉴定。使用成骨诱导分化培养基诱导干细胞的成骨分化。
1.3 间充质干细胞的外泌体提取
预先使用超速离心机100 000×g离心4 h去除胎牛血清中的外泌体。取传代至第三代的间充质干细胞接种于10 cm细胞培养皿中,收集间充质干细胞的细胞上清液。300×g离心10 min去除细胞,2 000×g离心10 min去除死细胞,10 000×g离心30 min去除细胞碎片,100 000×g离心2次各70 min,最终获得外泌体[5]。利用BCA试剂盒测定外泌体的浓度。获得的外泌体短期4℃储存,长期-80℃冻存。
1.4 透射电镜下观察外泌体形态
取1滴外泌体滴加在普通碳支持膜铜网上,室温静置5 min,之后吸去多余液体,室温静置风干,滴加10 μL醋酸双氧铀溶液负染1 min。再次吸去多余液体,室温风干后在透射电镜下观察外泌体的形态。
1.5 纳米颗粒追踪分析仪检测外泌体粒径
使用双蒸水稀释收集的外泌体(1 ∶5 000~1 ∶ 20 000)至适宜浓度后上机检测,每次上样量不少于3 mL,调整参数设置方案后对样品的粒径和电位进行检测。
1.6 蛋白质印迹法鉴定外泌体表面标志蛋白
配制10%的分离胶和5%的浓缩胶,每孔上样约30 μg。分别使用90 V和120 V的恒定电压进行电泳。恒定电压100 V的条件下电转1 h,转膜结束后取出PVDF膜,放于5%脱脂牛奶封闭液中,脱色摇床上常温封闭1 h。一抗选用兔抗小鼠CD9抗体(1 ∶ 2 000)和小鼠抗小鼠CD63抗体(1 ∶ 1 000),放入4℃冰箱孵育过夜。二抗选用辣根氧化酶标记的山羊抗兔(1 ∶ 3 000)和山羊抗小鼠二抗(1 ∶2 000),脱色摇床上室温放置1 h。滴加DAB发光液显色并拍照。
1.7 L02细胞内活性氧含量检测
L02肝细胞传代后接种在玻璃底的24孔板内,培养基使用RMPI 1640(10%血清和1%双抗),分为对照组,H2O2损伤(PBS)组,H2O2损伤+Exo(Exo)组,除对照组外其他组均加入0.2 mmol/L的H2O2溶液。共同孵育24 h后,置换含有DCFH-DA 活性氧荧光探针的培养基,按说明书进行操作后放置于荧光显微镜下观察。
1.8 CCK-8法检测L02细胞活性
L02肝细胞传代后接种在96孔板内,每孔约8 000个细胞,分别加入0,0.5,1,2.5,5,10,15,20 μg/mL Exo纳米颗粒,细胞培养箱内培养24或48 h,使用CCK-8试剂盒检测细胞活性。另外,96孔板内接种L02细胞后,培养基使用含0.2 mmol/L的H2O2溶液,同时加入0,1,2.5,5,10 μg/mL Exo纳米颗粒,检测Exo对受自由基损伤的L02细胞的保护作用。
1.9 丙二醛含量检测
称取约0.1 g肝脏组织,加入1 mL提取液进行冰浴匀浆; 8 000×g4℃离心10 min,取上清液,置冰上待测。依次加入丙二醛检测工作液、蒸馏水、样本和试剂,混合液在100℃水浴中保温60 min后,置于冰浴中冷却,10 000×g常温离心10 min。最后吸取200 μL上清液于96孔板中检测450、532和600 nm处的光密度(D)值。
1.10 过氧化氢酶含量检测
称取约0.1 g肝脏组织,加入1 mL提取液进行冰浴匀浆; 8 000×g4℃离心10 min,取上清液,置冰上待测。过氧化氢酶检测工作液37℃水浴15 min,96孔板中加入10 μL样本和190 μL工作液,立即混匀并计时,记录240 nm下初始1 min和2 min后的D值(D1和D2)。
1.11 超氧化物歧化酶含量检测
称取约0.1 g肝脏组织,加入1 mL提取液进行冰浴匀浆; 8 000×g4℃离心10 min,取上清液,置冰上待测。依次加入样品和试剂盒中的试剂。充分混匀,37℃水浴30 min后,560 nm处测定各管D值。
1.12 动物实验
SPF级5~6周雌性Balb/c小鼠30只,体重为(20±2)g,购自北京维通利华实验动物技术有限公司,动物合格证号1118032100038。小鼠在适宜条件下适应性饲养1周,自由饮食。
肝损伤模型制备:配制50 g/L 的D-GalN溶液以及1 g/L 的LPS溶液,放置于4 ℃备用,现配现用。Balb/c小鼠分为3组,分别为对照组,D-GalN/LPS肝损伤组(PBS组),D-GalN/LPS肝损伤Exo治疗组(Exo组)。PBS组和Exo组小鼠每只按照500 mg/kg D-GalN以及10 μg/kg LPS的比例混合后腹腔注射D-GalN/LPS的混合溶液,对照组腹腔注射等体积的PBS缓冲液。模型制备后立即给予治疗,Exo组尾静脉给予2.5 mg/kg小鼠体重的外泌体,PBS组和对照组尾静脉给予等体积的PBS缓冲液。8 h后在肝损伤达到高峰时处死小鼠,收集血清检测转氨酶水平,取出小鼠肝脏用于HE染色。
1.13 统计学分析
2 结果
2.1 小鼠骨髓间充质干细胞的鉴定
小鼠骨髓间充质干细胞原代细胞培养到第3代之后纯度较高,此时间充质干细胞标志物CD29、CD44呈阳性表达,阳性率大于95%,CD31和CD117 呈阴性表达(图1A)。
间充质干细胞具有分化能力,用成骨分化培养基培养间充质干细胞,3周后进行茜素红染色,显微镜下观察到成骨分化后的细胞外面的沉积钙结节与茜素红染液结合,钙结节被染成深红色(图1B)。
2.2 外泌体的鉴定
外泌体为粒径50~150 nm的囊泡,电镜下表现为椭圆形或“茶托形”(图2A、2B)。在可视化操作界面下,能够观察到纳米颗粒分散较为均一,没有明显的团聚现象(图2C)。蛋白印迹实验观察到CD9的一条条带,而CD63由于蛋白磷酸化的关系,通常含有两个条带(图2D)。

A:流式细胞术检测;B:成骨分化染色(×100)

A:外泌体透射电镜(×30 000);B:外泌体粒径电位;C:粒径追踪分析(×300);D:蛋白质印迹检测CD63和CD9表达
2.3 L02细胞活性氧水平及细胞活性的考察
结果表明,H2O2刺激后,PBS组L02细胞在共聚焦显微镜下表现出明显的荧光信号,强于对照组,而Exo治疗组的荧光信号明显下降,说明Exo治疗组中细胞内活性氧水平下降(图3A)。
不同浓度外泌体与L02细胞共同孵育24或48 h,细胞活性没有明显改变(图3B),说明间充质干细胞外泌体对细胞本身没有毒性。将L02细胞与0.2 mmol/L的H2O2溶液共同孵育,并在培养基中加入不同浓度的间充质干细胞外泌体,结果表明,相较于H2O2刺激组,加入10 μg/mL外泌体后L02细胞活性明显增加(t=9.731,P<0.05),见图3C。
2.4 外泌体缓解D-GalN/LPS诱导的小鼠肝损伤
由图4A可见,模型小鼠的肝脏中出现了大量的脂肪变性和炎症细胞浸润,相较于对照组有明显的肝脏损伤;Exo组能够减轻肝脏的损伤,减少肝脏内细胞的脂肪变性和炎症细胞浸润,说明外泌体对急性肝损伤小鼠具有良好的治疗作用。小鼠血清转氨酶检测结果表明,PBS组丙氨酸转氨酶、天冬氨酸转氨酶水平较对照组升高(t=10.55,P<0.01;t=9.16,P<0.01),而在外泌体治疗后,相较于PBS组,Exo组丙氨酸转氨酶水平明显降低(t=9.048,P<0.05),天冬转氨酶水平也明显下降(t=8.328,P<0.05),见图4B、4C。

A:L02细胞活性氧荧光探针检测活性氧;B:外泌体对L02细胞的毒性检测;C:外泌体改善H2O2导致的L02细胞活性下降
2.5 外泌体改善肝脏氧化应激损伤
PBS组丙二醛水平较对照组明显升高(t=4.294,P<0.05),表明肝脏受到了氧化应激损伤,Exo组较PBS组丙二醛水平显著下降(t=4.644,P<0.05);PBS组过氧化氢酶和超氧化物歧化酶的活性较对照组明显下降(t=6.822,P<0.05;t=4.119,P<0.05),Exo组过氧化氢酶水平较PBS组显著上升(t=5.104,P<0.05),超氧化物酶水平较PBS组升高(t=3.450,P<0.05),见图5。

A:各组肝脏组织HE染色;B:丙氨酸转氨酶检测;C:天冬氨酸转氨酶检测;a:P<0.01,与对照组比较;b:P<0.05,与PBS组比较
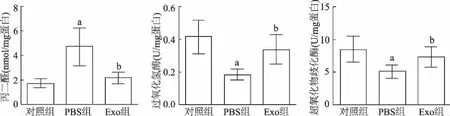
a:P<0.05,与对照组比较;b:P<0.05,与PBS组比较
3 讨论
急性肝损伤多表现为肝功能急剧下降,严重时甚至完全丧失,同时并发其他脏器的功能障碍。国内病因大多与肝炎病毒的感染有关,在欧美国家则主要归因于过量饮酒,其他因素如有毒的化学物质、脂肪肝和药物也可以引起急性肝脏损伤[6-7]。在氧化应激发生时,体内氧化剂和抗氧化剂水平发生紊乱,导致肝脏内活性氧水平大幅度上升。活性氧造成细胞和组织的严重损伤。因此,有必要寻找一种能够清除活性氧,保护肝脏免受损伤,促进肝脏损伤修复的治疗方法[8]。
多项研究表明,间充质干细胞对于多种组织脏器的损伤具有修复功能,Cheng等[9]在顺铂诱导的肾脏损伤小鼠模型中使用了间充质干细胞治疗,发现间充质干细胞能够通过分泌一系列有效的细胞因子,促进肾脏的损伤修复,减少顺铂导致的肾小管细胞毒性。间充质干细胞治疗具有明显的治疗效果,但也存在一些隐患。一方面是间充质干细胞的大小,在全身血管中流动存在一定的困难,在体循环过程中可能会滞留在肺部血管导致肺栓塞[10-11];另一方面是细胞的活性,间充质干细胞输入到活体组织后,细胞活性得不到维持。[11]。
外泌体作为天然分泌的纳米级囊泡,具有多种生物学功能,近年来愈发受到国内外研究者的关注[12-14]。Gangadaran等[15]研究发现间充质干细胞的外泌体能够通过激活血管内皮生长因子受体来加速四肢缺血性损伤的恢复过程。本研究选用间充质干细胞外泌体作为治疗急性肝损伤的药物。首先,进行间充质干细胞的培养、外泌体的收集与鉴定;其次,考察间充质干细胞外泌体对肝细胞的保护作用;最后,动物实验结果表明,间充质干细胞外泌体对肝损伤小鼠肝脏组织具有保护作用,降低肝脏的转氨酶水平,下调丙二醛含量,提高过氧化氢酶和超氧化物酶的活性。
间充质干细胞外泌体在氧化应激损伤中发挥着重要的损伤修复作用,能够对肝细胞损伤、心脏损伤、肾脏损伤和神经元损伤等产生修复作用[16]。Jiang等[17]研究发现,脐带间充质干细胞来源的外泌体通过抑制氧化应激损伤保护CCl4诱导的肝损伤,但未对深层次机制做出解释。Yan等[18]则发现人脐带间充质干细胞来源的外泌体能够改善CCl4诱发的小鼠肝衰竭,减少肝脏细胞的氧化应激损伤和凋亡,从机制上来说,干细胞来源的外泌体内含有谷胱甘肽过氧化物酶,能够分解体内的过氧化物,减少自由基带来的损伤,外泌体通过递送谷胱甘肽过氧化物酶减少肝脏细胞的氧化应激损伤以及细胞凋亡。Wang等[19]的研究表明,间充质干细胞外泌体能够促进心肌梗死大鼠模型中心脏的损伤修复,这一组织损伤修复作用可能与外泌体内含有的生物活性物质相关,这些生物活性物质能够激活受体细胞下游的信号通路,从而发挥组织修复作用。Lin等[20]研究表明,脂肪间充质干细胞来源的外泌体能够保护缺血再灌注损伤肾脏的组织结构和功能,减少缺血再灌注导致的氧化应激损伤,下调了氧化应激和细胞凋亡相关蛋白的表达,进一步研究表明这一作用依赖于外泌体促进血管新生的功能,增加了肾脏的血液流动。
综上,本研究结果显示间充质干细胞外泌体能够通过调控氧化应激来保护肝脏细胞,减少肝脏损伤,促进肝脏组织的修复,为急性肝损伤的治疗提供了新的思路。
