白藜芦醇通过PI3K/Akt/GSK-3β通路对6-OHDA致帕金森病小鼠神经退行性病变改善的作用研究
2020-07-21杨小鸥杨国伟刘志孝
杨小鸥,杨国伟,刘志孝,孙 静
帕金森病(Parkinson′s disease)是一种常见的中枢神经系统退行性疾病,老年人群发病率位居第二位,仅次于阿尔茨海默病[1],其病理特征主要是中脑黑质区域致密部多巴胺能神经元变性或缺失,导致纹状体多巴胺能神经元减少及Lewy氏小体形成[2-3]。临床主要表现为静止性震颤、运动迟缓、肌肉僵硬等一系列运动功能障碍[4]。糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)是一种高度保守的丝氨酸/苏氨酸蛋白激酶[5],主要依赖于其对底物的磷酸化作用,参与细胞增殖、凋亡等过程,在帕金森病发展过程中起重要作用[6-7]。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶(Akt)信号转导通路是近年来发现的,参与调控细胞凋亡的一条重要信号通路,其活化后使GSK-3β失活,从而避免细胞凋亡的发生[8-9]。白藜芦醇是广泛存在于各种水果、蔬菜中的一种多酚类化合物[10],具有抗炎、抗氧化应激及抗凋亡作用[11],且有研究证实其通过多种途径对帕金森病等神经退行性疾病具有一定的保护作用[12],但白藜芦醇通过PI3K/Akt/GSK-3β通路改善帕金森病的神经退行性病变报道较少。本研究探讨白藜芦醇通过PI3K/Akt/GSK-3β通路改善6-羟基多巴胺(6-OHDA)所致帕金森病小鼠神经退行性病变,从而为白藜芦醇的临床使用提供可靠依据。
1 材料与方法
1.1 实验动物 SPF级C57BL/6雄性小鼠,10~11周龄,体重20~25 g,购自济南朋悦实验动物繁殖有限公司,动物批号:SCXK(鲁)20170001,饲养于沈阳医科大学实验动物中心洁净动物实验室恒温恒湿SPF级条件下,高压灭菌饮用水和饲料,自由摄取。
1.2 实验试剂 白藜芦醇购自湖南正清生物有限公司;TUNEL试剂盒购自北京碧云天生物科技有限公司;磷酸化蛋白激酶(p-Akt)鼠源单抗、磷酸化糖原合成酶激酶3(p-GSK-3β)兔源单抗、PI3K兔源单抗、甘油醛-3-磷酸脱氢酶(GAPDH)鼠源单抗、抗兔二抗、抗鼠二抗均购自美国Cell Signaling公司;Caspase-3及内参引物由上海生工生物工程有限公司合成;实验所用其他试剂购自上海生工生物公司。
1.3 动物分组 将30只SPF级C57BL/6小鼠随机分为正常组、6-OHDA致病组和白藜芦醇治疗组(Res治疗组),每组10只。Res治疗组小鼠在造模前3 h按照20 mg/kg剂量给予灌胃,此后每日均按此标准灌胃1次,持续至造模后2周;6-OHDA致病组和正常组均给予等量生理盐水灌胃。
1.4 6-OHDA致帕金森病小鼠模型建立 将6-OHDA在避光条件下溶解于含0.02%抗坏血酸生理盐水(NS)溶液中,调整浓度为2 μg/μL。随机选取20只实验小鼠,以0.15%的戊巴比妥按照0.2 mL/kg腹腔注射麻醉。小鼠麻醉后固定于立体定位仪装置上,头皮剪开,暴露头骨。选择黑质致密部,将装有6-OHDA溶液的微量注射器插入,推动速度为1 μL/min,每只小鼠脑内注射两个位点,每个位点注射2 μL,停止注射4 min后拔针,以免试剂外泄。注射完毕后将小鼠从立体定位仪上取下,并缝合头皮。正常组小鼠脑内注射同等剂量生理盐水。
1.5 组织取材 造模后2周将小鼠处死,分离脑组织黑质,一部分固定于多聚甲醛中,24 h后石蜡包埋,制备5μm厚度组织切片;另一部分置于-80 ℃冰箱保存。
1.6 观察指标
1.6.1 行为学观察 造模2周后,给予各组小鼠0.5 mg/mL吗啡腹腔注射,以诱导小鼠旋转,观察行为变化,并记录小鼠旋转圈数。
1.6.2 TUNEL染色观察脑黑质内多巴胺神经元凋亡 组织石蜡切片脱蜡、水化,磷酸盐缓冲液(PBS)漂洗,之后在3%H2O2中浸洗,加组织蛋白酶K去除蛋白,加TUNEL反应溶液,室温避光孵育1 h后用PBS洗涤,加入信号转化剂,之后用3,3二氨基联苯胺四氯化碳(DBA)显色处理,最后每个样本上加苏木素,15 s后迅速擦拭,光学显微镜下观察细胞核染色情况。
1.6.3 逆转录-聚合酶链反应(RT-PCR)检测实验小鼠脑黑质内Caspase-3基因表达 取脑黑质组织约50 mg,Trizol提取总RNA,进行逆转录反应。取2 μL RNA进行PCR扩增,内参GAPDH引物序列,上游:ATGCTATTGCGATAGCGATC;下游:ATCGGATTCGATCGATCGA。Caspase-3引物序列,上游:TCGATCGATCGGCAAATCGA;下游:TCGATCGACGTTGCATGCATT。扩增条件:94 ℃预变性2 min,1个循环;94 ℃变性30 s,55 ℃退火30 s,55 ℃退火30 s,72 ℃延伸2 min,36个循环;72 ℃总延伸6 min。取5 μL PCR扩增产物进行琼脂糖凝胶电泳,观察电泳条带,分析目的基因和参比基因的条带灰度值。
1.6.4 蛋白印迹法(Western Blot)检测实验小鼠脑黑质内p-GSK-3β、PI3K、p-Akt蛋白含量 将脑黑质组织剪成小块,加入蛋白裂解液,提取蛋白质,离心取上清液,取50 μg总蛋白进行钠十二烷基的硫酸盐聚丙烯酰胺凝胶(SDS-PAGE)电泳,随后转移至聚偏二氟乙烯(PVDF)膜,5%脱脂牛奶封闭,加一抗,同时以GAPDH为内参,4 ℃孵育过夜,TBST缓冲盐溶液洗涤,根据一抗种属加入相应二抗,室温孵育1 h,ECL显色,将胶片扫描后使用Bandscan5.0软件进行蛋白灰度分析。

2 结 果
2.1 帕金森病动物模型建立 本研究采用右侧纹状体注射方法建立帕金森病动物模型,造模后第14天皮下注射吗啡诱发小鼠旋转,结果显示,正常组小鼠无任何行为学改变,6-OHDA致病组和Res治疗组小鼠注射吗啡5 min后诱发向右侧旋转,6-OHDA致病组小鼠30 min内向右旋转圈数为(203.37±8.32)圈,Res治疗组为(102.53±10.03)圈,两组比较差异有统计学意义(P<0.05),说明白藜芦醇能改善6-OHDA所致行为异常。
2.2 TUNEL检测帕金森病小鼠脑黑质内多巴胺神经元凋亡 光学显微镜下各组细胞核染色图像见图1。6-OHDA致病组小鼠脑黑质内多巴胺神经元凋亡率高于正常组(P<0.05),Res治疗组小鼠脑黑质内巴胺神经元凋亡率低于6-OHDA致病组(P<0.05),说明白藜芦醇能有效抑制PD小鼠脑黑质内巴胺神经元凋亡。详见图2。
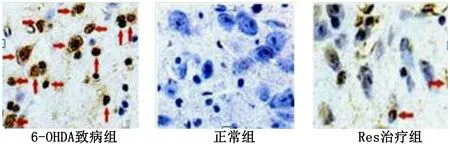
图1 光学显微镜下各组细胞核染色图像
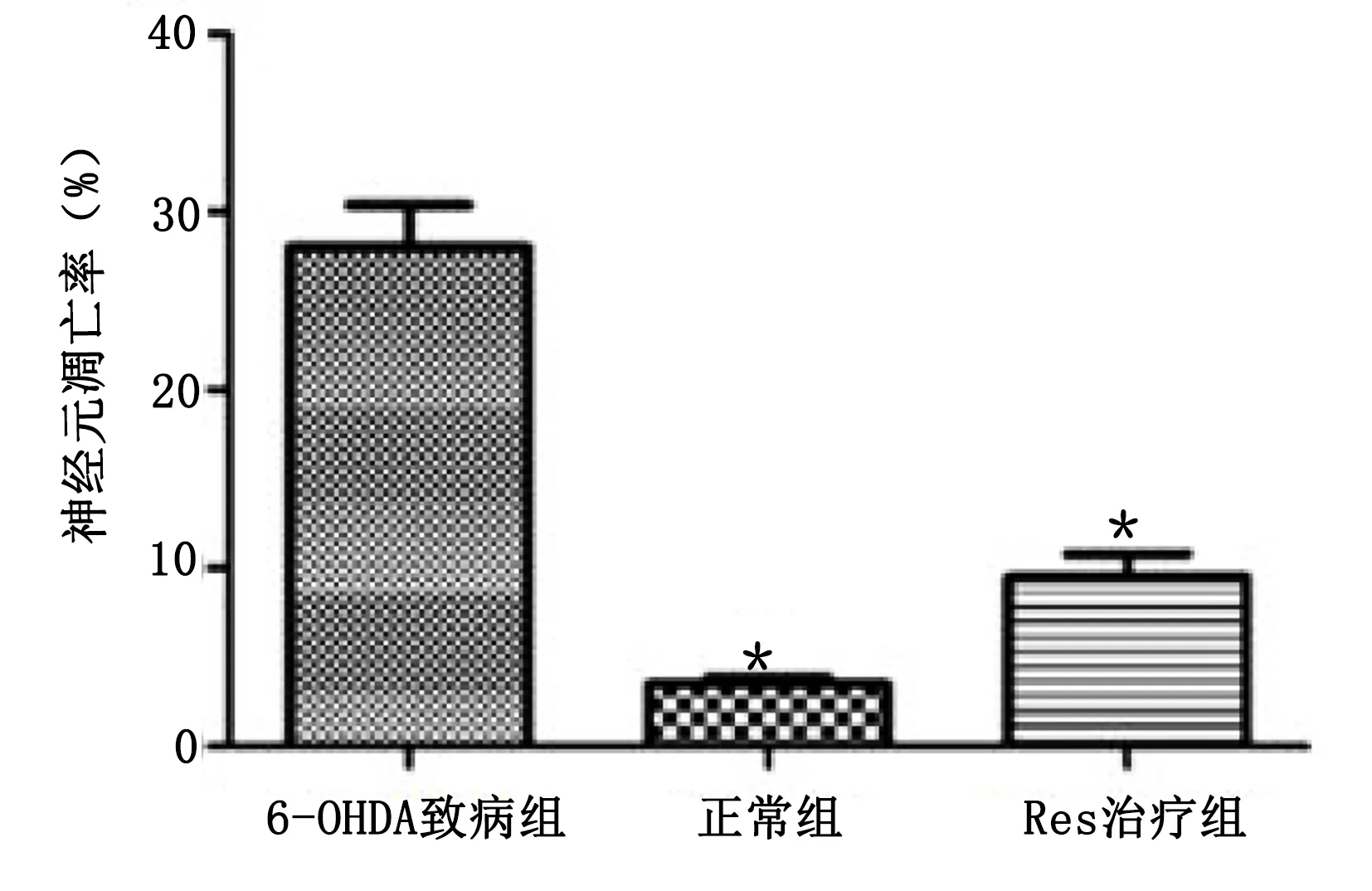
与6-OHDA致病组比较,*P<0.05。
2.3 RT-PCR检测实验小鼠脑黑质内Caspase-3含量 6-OHDA致病组小鼠脑黑质内Caspase-3含量较正常组增加(P<0.05),Res治疗组小鼠脑黑质内Caspase-3表达较6-OHDA致病组明显降低(P<0.05)。说明白藜芦醇能抑制PD小鼠脑黑质内Caspase-3含量。详见图3。
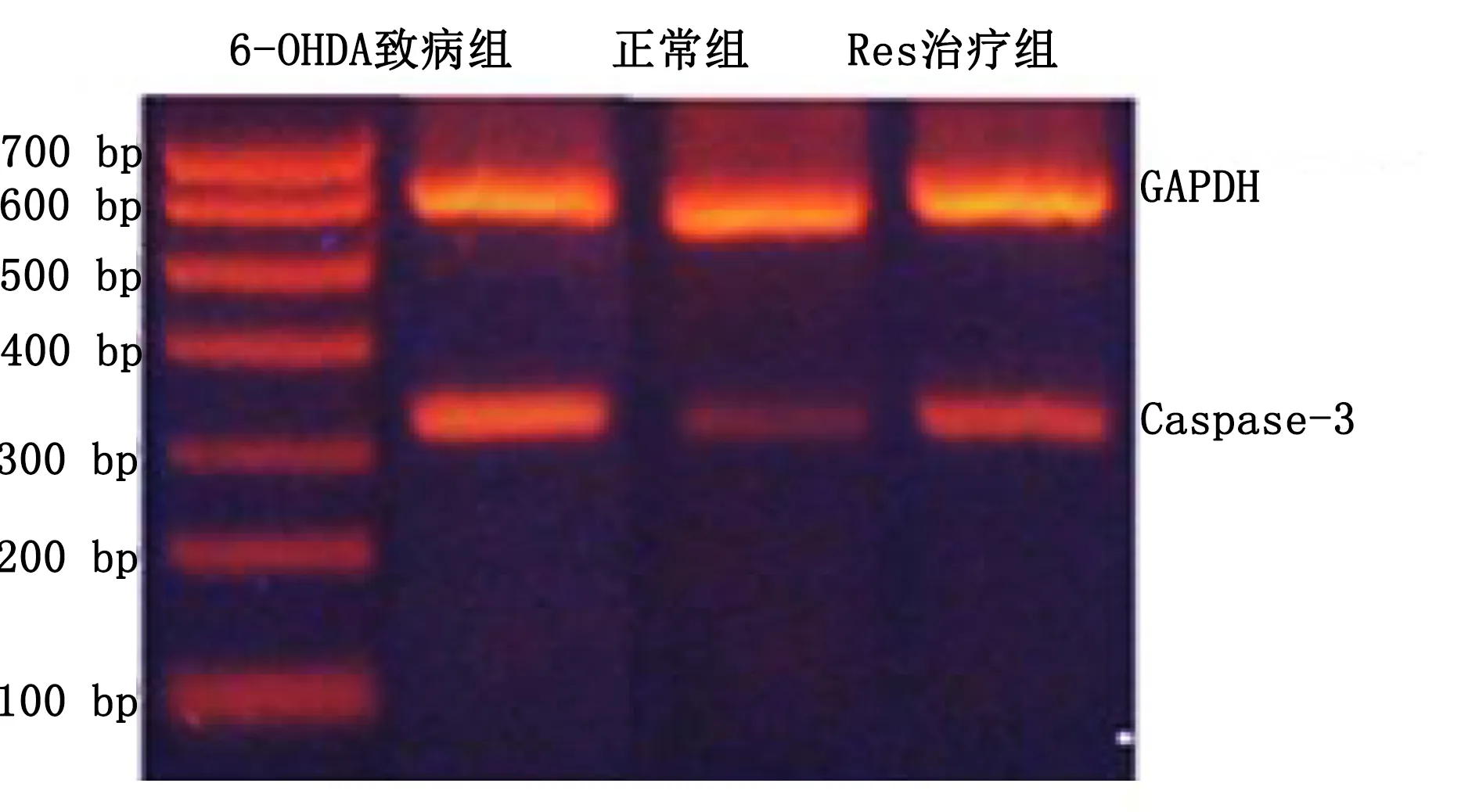

与6-OHDA组比较,*P<0.05。
2.4 Western Blot检测实验小鼠脑黑质内PI3K蛋白含量 6-OHDA致病组小鼠脑黑质内PI3K蛋白含量低于正常组(P<0.05),Res治疗组小鼠脑黑质内PI3K蛋白含量较6-OHDA致病组小鼠增加(P<0.05)。详见图4。
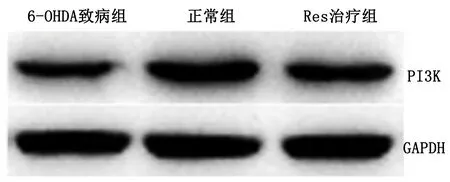
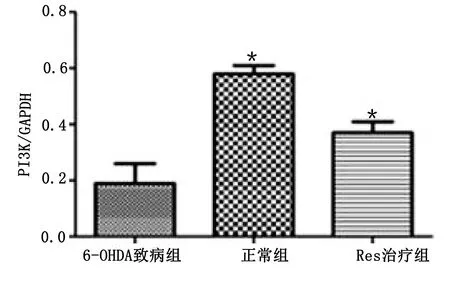
与6-OHDA致病组比较,*P<0.05。
2.5 Western Blot检测实验小鼠脑黑质内p-GSK-3β蛋白含量 6-OHDA致病组小鼠脑黑质内p-GSK-3β蛋白含量低于正常组(P<0.05),Res治疗组小鼠脑黑质内p-GSK-3β蛋白含量较6-OHDA致病组小鼠提高(P<0.05)。详见图5。
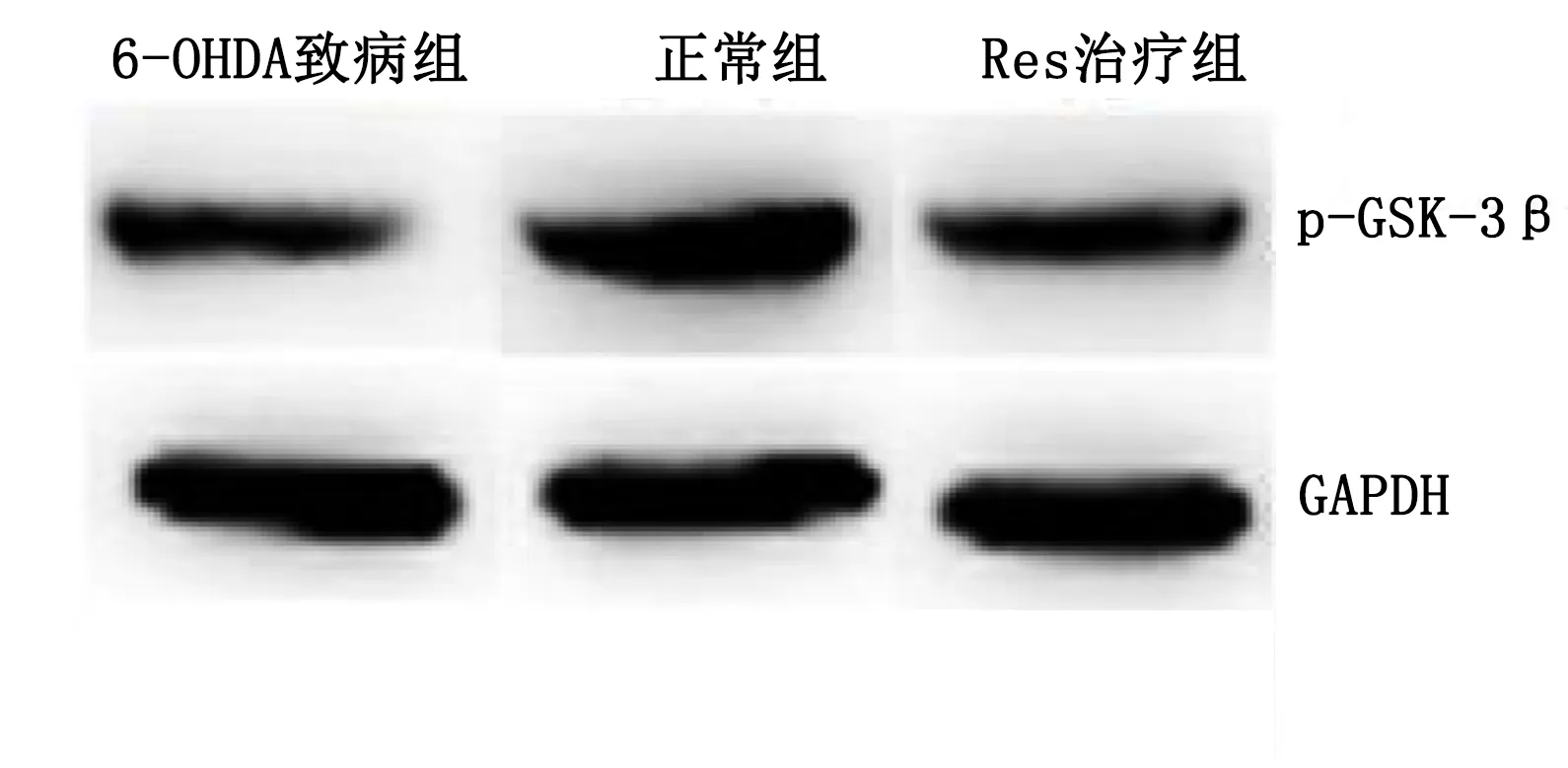
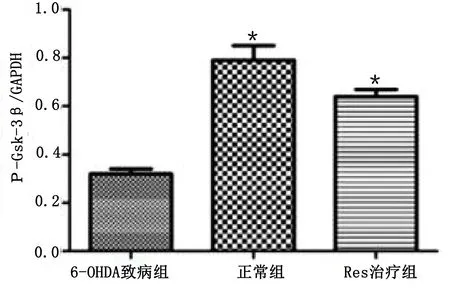
与6-OHDA致病组比较,*P<0.05。
2.6 Western Blot检测实验小鼠脑黑质内p-Akt蛋白含量 6-OHDA致病组小鼠脑黑质内p-Akt蛋白含量较正常组降低(P<0.05),Res治疗组小鼠脑黑质内p-Akt蛋白含量较6-OHDA致病组升高(P<0.05)。详见图6。
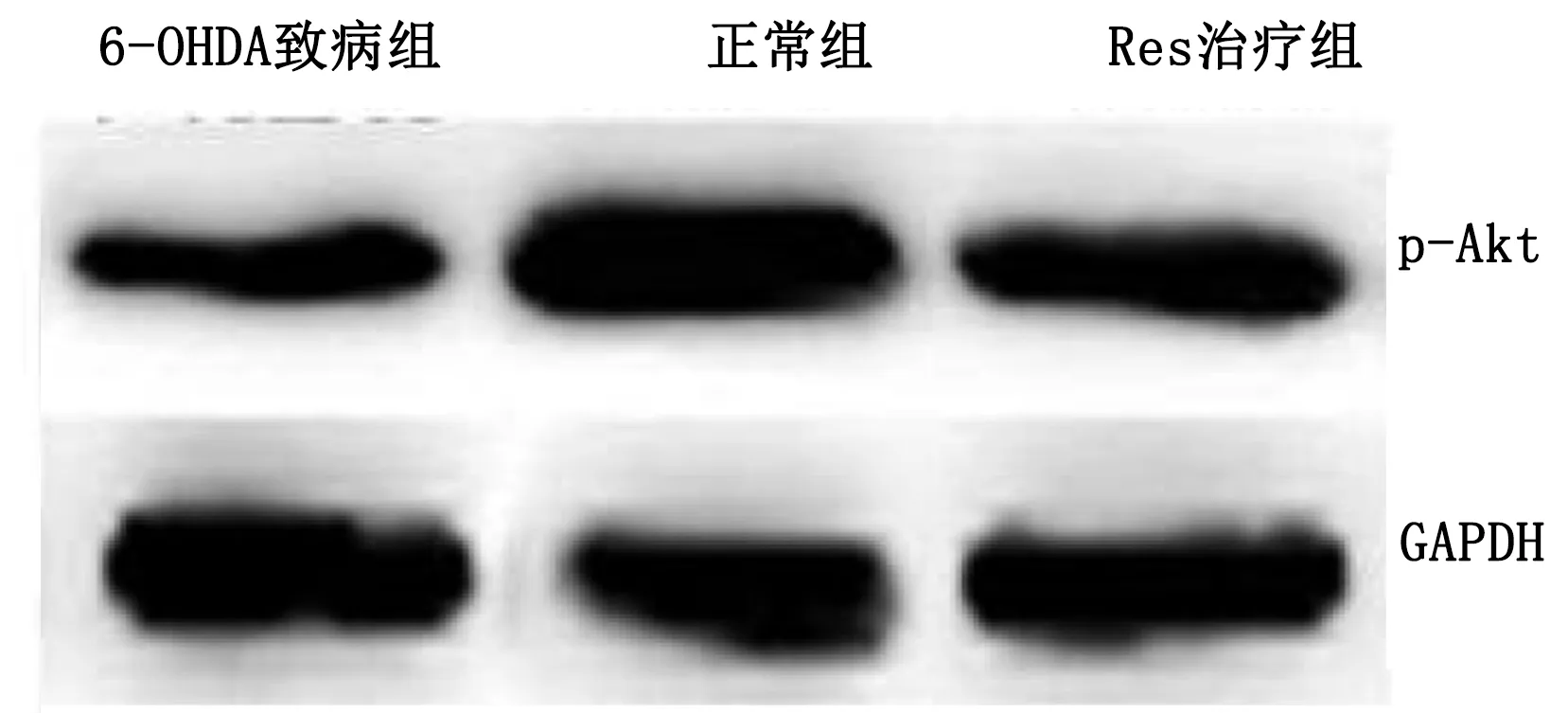
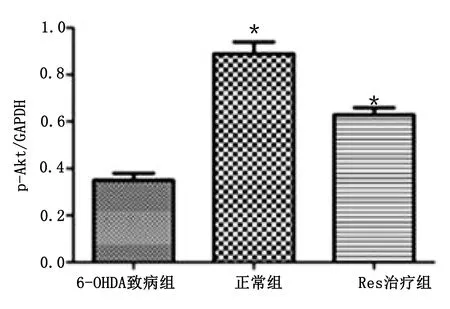
与6-OHDA致病组比较,*P<0.05。
3 讨 论
帕金森病是老年人群发病率较高的一种中枢神经退行性疾病,其发病原因复杂,与遗传、感染、免疫功能失调等因素均有关[1-2]。白藜芦醇是广泛存在于各种水果、蔬菜中的一种多酚类化合物[10-11],相关研究证实,白藜芦醇通过缓解线粒体功能障碍、激活ERK通路、激活沉默信息调节因子(SIRT1)蛋白等多种途径对帕金森病起到神经保护作用[12-13]。
有研究发现,细胞凋亡引起的脑黑质纹状体内多巴胺能神经元缺失是引发帕金森病的一个重要原因[14]。早期研究发现,帕金森病病人脑内凋亡的神经元数量较正常人增加[15],有学者使用TUNEL染色法在因帕金森病死亡病人脑内发现凋亡神经元存在[6]。本研究使用6-OHDA诱导小鼠建立帕金森病模型,造模成功后,实验小鼠出现运动功能障碍,同时TUNEL染色显示6-OHDA致病组小鼠脑黑质内多巴胺能神经元凋亡率高于正常组。
Caspase在细胞凋亡过程中发挥关键作用,是所有凋亡途径的关键效应器,RT-PCR检测结果发现,6-OHDA致病组小鼠脑黑质内凋亡蛋白Caspase-3含量增加,说明帕金森病小鼠脑内Caspase-3被激活,从而引发多巴胺能神经元凋亡。白藜芦醇治疗后,帕金森病小鼠运动功能障碍得到显著改善,脑黑质内Caspase-3含量被显著抑制,且多巴胺神经元凋亡比例较6-OHDA致病组小鼠下降。说明白藜芦醇能抑制帕金森病小鼠脑黑质内Caspase-3含量,降低多巴胺神经元凋亡,从而改善神经退行性病变。
GSK-3β在中枢神经系统中广泛表达,与神经凋亡相关的神经退行性疾病密切相关,如帕金森病[5]、阿尔茨海默病等[6]。有研究发现,GSK-3β在细胞活动中与多个信号通路密切相关,其活化受到多种机制调控,其中N端第9位丝氨酸残基(Ser9)被磷酸化时,GSK-3β活性被抑制[16]。帕金森病发病过程中,GSK-3β活化上调多巴胺能神经内Caspase-3含量,从而促进细胞凋亡的发生[15]。有研究发现,GSK-3β抑制剂可抑制Caspase-3表达,从而抑制多巴胺神经元凋亡[15]。本研究结果发现,与正常组相比,6-OHDA致病组脑黑质内p-GSK-3β含量降低;Res治疗组小鼠脑黑质内p-GSK-3β含量较6-OHDA致病组提高,说明白藜芦醇对帕金森病小鼠脑黑质内多巴胺神经元凋亡及Caspase-3含量的抑制作用可能通过提高p-GSK-3β含量实现。
PI3K/Akt信号转导通路是近年来发现的、参与细胞凋亡调控的一个重要信号通路[5]。PI3K通过磷酸化Akt蛋白Ser473位点使Akt活化,而活化后的Akt通过p-GSK-3β的Ser9位点抑制GSK-3β活性,避免细胞凋亡的发生[6-7]。相关研究发现,在帕金森病发展过程中,使用PI3K抑制剂wortmannin阻断PI3K/Akt通路,解除p-GSK-3β,加重多巴胺神经元凋亡[14-15]。本研究结果发现,6-OHDA致病组小鼠脑黑质内PI3K和Akt磷酸化水平较正常小鼠均降低,经白藜芦醇干预后,PI3K和Akt磷酸化水平均升高,说明白藜芦醇能激活帕金森病小鼠脑黑质内PI3K/Akt通路,从而减弱GSK-3β活性,减少多巴胺神经元凋亡。
综上所述,本研究证实白藜芦醇能有效改善由6-OHDA诱导的帕金森病小鼠模型运动功能障碍,并降低脑黑质内多巴胺神经元凋亡,这种抑制作用可能通过激活PI3K/Akt/GSK-3β信号通路,抑制GSK-3β活性而实现。
