COX-2 和Ki-67 在甲状腺癌组织表达及临床意义
2020-07-21赵贤宝
陈 亮 赵贤宝 傅 超
甲状腺癌是常见的一种头颈部恶性肿瘤。目前,甲状腺癌术前诊断主要依据针吸细胞学及甲状腺彩超检查,但具有明显的局限性,并且容易出现假阴性。环氧化酶(COX)又称为前列腺素H 合成酶,参与机体的各种生理过程,研究显示,COX-2 在多种恶性肿瘤中过表达,而其在甲状腺癌中研究甚少。Ki-67抗原作为应用最广泛的肿瘤细胞增殖标志,与肿瘤细胞有丝分裂关系相关[1-2]。本研究旨在探讨COX-2和Ki-67 在甲状腺癌组织表达及临床意义。
1 临床资料
1.1 一般资料 选择浙江省义乌市中心医院肿瘤科2017 年6 月—2019 年6 月行手术治疗的甲状腺癌患者的甲状腺癌组织作为观察组,共87 例。甲状腺癌依据《2010 年版甲状腺肿瘤治疗指南》[3]中相关诊断标准。选择同期手术治疗的甲状腺良性病变的正常甲状腺组织83 例作为对照组。本研究通过医院伦理委员会审核。
1.2 纳入和排除标准 纳入标准∶(1)符合甲状腺癌诊断标准,且经临床表现、影像学检查及术后病理证实为甲状腺癌;(2)患者均行手术治疗并获得知情同意;(3)年龄≥60 岁且≤80 岁。排除标准∶(1)临床资料不完整;(2)术前接受放疗或化疗者;(3)合并其他恶性肿瘤;(4)手术禁忌者。
2 方 法
2.1 免疫组化法测定COX-2 和Ki-67 表达阳性率取甲状腺癌组织标本和正常甲状腺组织标本,4%甲醛固定,常规石蜡包埋,连续切片约为3μm,采用二甲苯脱蜡梯度乙醇脱水。将切片放于10mM、250mL 的柠檬酸缓冲液(pH=6)中,再将其放于高压锅(100℃)中煮沸30min 修复抗原,操作标准按照免疫组织化学SP 试剂盒(福州迈新生物试剂公司,批号1610272、1607131)严格进行,采用DAB 显色,苏木精复染脱水,透明封固。COX-2 和Ki-67 结果判定[3]∶分别于高倍镜下取不同视野5 个,计数阳性细胞数200 个,取平均值计算阳性率。COX-2 和Ki-67均于细胞核以及细胞质中表达[3]∶(1)着色程度∶以无色为计分0 分,以淡黄色为计分1 分,以棕黄色为计分2 分,以褐色与黑色为计分3 分;(2)阳性细胞计数∶以阳性细胞<10%为计分1 分,以阳性细胞11%~50%为计分2 分,以阳性细胞51%~75%为计分3 分,以阳性细胞>75%为计分4 分。阳性细胞所占百分比及染色程度相乘∶其中以计分<3 分为(-),以计分≥3分为(+)。
2.2 Western blot 测定COX-2 和Ki-67 蛋白表达灰度值 取甲状腺癌组织标本和正常甲状腺组织标本加入细胞裂解液,匀浆裂解约35min,以离心转速10000r/min,离心半径15cm 离心5min,收集上清液进行蛋白定量。取30μg 总蛋白进行SDS-PAGE,加入一抗COX-2 和Ki-67 孵育1h,再加入辣根过氧化物酶标记的免疫球蛋白G(IgG)二抗孵育1h,采用化学发光、显影、定影,以β-actin 蛋白作为内参照。兔抗人单克隆抗体COX-2 和兔抗人多克隆抗体Ki-67来源于北京中杉金桥生物技术开发有限公司(批号1602181、1608292)。
2.3 统计学方法 应用SPSS 22.0 统计软件。计量资料以均数±标准差() 表示,采用t 检验;计数资料采用χ2检验。P<0.05 为差异有统计学意义。
3 结果
3.1 两组研究对象一般资料比较 观察组87 例,男20 例,女67 例;年龄60~78(69.43±5.64)岁;病程(3.17±0.76)年;TNM 分期[3]∶Ⅰ~Ⅱ期53 例,Ⅲ~Ⅳ期34 例;包膜浸润30 例;淋巴结转移28 例。对照组83例,男16 例,女67 例;年龄62~79(70.31±6.27)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
3.2 两组甲状腺组织COX-2 和Ki-67 表达阳性率比较 观察组COX-2 和Ki-67 表达阳性率高于对照组(P<0.05)。见表1。
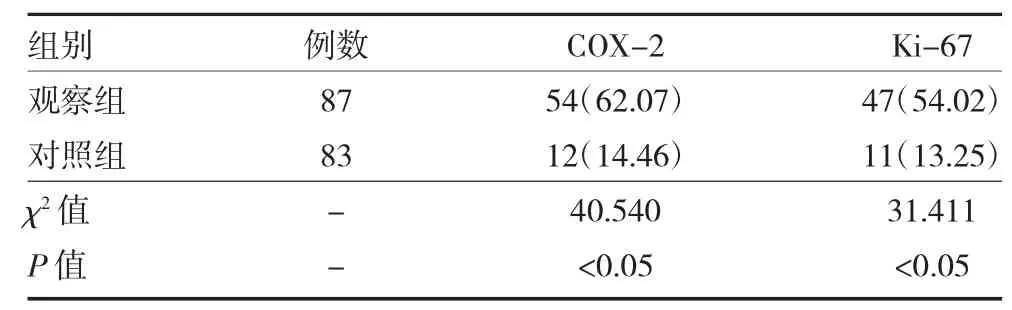
表1 两组甲状腺组织COX-2 和Ki-67 表达阳性率比较[例(%)]
3.3 两组甲状腺组织COX-2 和Ki-67 蛋白表达灰度值比较 观察组COX-2 和Ki-67 蛋白表达灰度值高于对照组(P<0.05)。见表2、图1。
3.4 不同病理特征甲状腺癌组织COX-2 和Ki-67表达阳性率比较 不同性别、年龄和TNM 分期COX-2 和Ki-67 表达阳性率比较差异无统计学意义(P>0.05);有包膜浸润和淋巴结转移COX-2 和Ki-67 表达阳性率高于无包膜浸润和淋巴结转移(P<0.05)。见表3。
表2 两组甲状腺组织COX-2 和Ki-67 蛋白表达灰度值比较()

表2 两组甲状腺组织COX-2 和Ki-67 蛋白表达灰度值比较()
注∶观察组为甲状腺癌组织;对照组为正常甲状腺组织;COX-2 为环氧化酶-2
3.5 不同病理特征甲状腺癌组织COX-2 和Ki-67蛋白表达灰度值比较 不同性别、年龄和TNM 分期COX-2 和Ki-67 蛋白表达灰度值比较差异无统计学意义(P>0.05);有包膜浸润和淋巴结转移蛋白表达灰度值高于无包膜浸润和淋巴结转移(P<0.05)。见表4。
4 讨论
COX-2 蛋白诱导型酶,其在细胞受刺激启动炎性反应或机体出现肿瘤病变时急速合成,而其在细胞组织静息时一般不表达[4]。COX-2 参与机体多个病理生理过程,并且热休克蛋白、维甲酸、癌基因和脂多糖等多种因素均可诱导COX-2 合成[5]。近年研究显示,多种恶性肿瘤中发现COX-2 高表达,认为其可能与肿瘤发生、发展存在相关性[6-7]。此外,COX-2 过表达可抑制细胞凋亡且促进细胞增殖,从而使细胞增殖和凋亡间平衡失调,进一步促进肿瘤走向恶性[8]。Ki-67 抗原主要由两条多肽链组成,基因定位于10 号染色体,Ki-67 与细胞有丝分裂密切相关,其表达除G0 期以外的所有时期,于细胞周期G1 期开始,并且于S 期及G2 期逐渐增加至M 期达巅峰,目前是细胞增殖能力应用最广泛并且最具代表性的一种肿瘤标志物[9-10]。临床研究显示,Ki-67 高表达不仅与肿瘤的生物学形成相关,并且与临床预后密切相关[11]。Ki-67 在乳腺浸润性导管癌中与雌激素受体呈负相关,其可能与肿瘤分化程度相关[12]。研究发现,Ki-67 在甲状腺癌研究中可反映甲状腺癌细胞的增殖活性,可作为评估甲状腺癌生物学行为以及恶性程度的一种重要指标[13]。本研究结果显示,观察组COX-2 和Ki-67 表达阳性率和蛋白表达灰度值高于对照组(P<0.05),有包膜浸润和淋巴结转移COX-2和Ki-67 表达阳性率与蛋白表达灰度值高于无包膜浸润和淋巴结转移(P<0.05)。提示甲状腺癌组织COX-2 和Ki-67 表达升高,COX-2 和Ki-67 异常表达可能参与甲状腺癌的发生和发展过程,且与淋巴转移和包膜浸润相关,可作为判断甲状腺癌预后参考指标。

表3 不同病理特征甲状腺癌组织COX-2 和Ki-67 表达阳性率比较[例(%)]
表4 不同病理特征甲状腺癌组织COX-2 和Ki-67 蛋白表达灰度值比较()

表4 不同病理特征甲状腺癌组织COX-2 和Ki-67 蛋白表达灰度值比较()
