新型冠状病毒肺炎对心血管系统影响
2020-07-21鲁旭然侯晓彤孙立忠潘友民王守凤赵欣艳
杨 毅 鲁旭然 刘 楠* 侯晓彤 孙立忠 吴 龙 潘友民 王守凤 赵欣艳
(1.首都医科大学附属北京安贞医院心外科危重症中心 北京市心肺血管疾病研究所,北京 100029; 2. 首都医科大学附属北京安贞医院心脏外科 北京市心肺血管疾病研究所 北京市大血管疾病诊疗研究中心, 北京 100029; 3. 华中科技大学同济医学院附属协和医院心脏大血管外科, 武汉 430022; 4. 华中科技大学同济医学院附属同济医院外科大血管外科, 武汉 430030)
世界卫生组织(World Health Organization,WHO)[1]已将新型冠状病毒肺炎(COVID-19)病原体正式命名为2019冠状病毒病(corona virus disease 2019,COVID-19)。新型冠状病毒属于β冠状病毒,其基因特征与严重急性呼吸综合征(severe acute respiratory syndrome,SARS)的冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)以及中东呼吸综合征(Middle East Respiratory Syndrome,MERS) 的冠状病毒(Middle East Respiratory Syndrome coronavirus,MERSr-CoV)有所区别,对新型冠状病毒理化特性的认识多来自对 SARSr-CoV和 MERSr-CoV的研究。截至目前COVID-19的病死率低于SARS和MERS。SARS病死率为9.6%(774/8 098)[2],MERS病死率为34%(858/2 494)[3-4]。COVID-19死亡病例中,湖北省死亡病例占95.8%,80%以上为60岁以上老年人,75%以上患有心脑血管疾病、糖尿病等一种以上基础疾病[5]。此类患者同时也是心血管疾病的高发人群。在早期发布的41例COVID-19病例中(诊断日期截至2020年1月2日),合并心血管疾病和高血压的患者分别占15%,且5例患者出现了心肌损伤(12%),32%的患者需要在重症监护室(intensive care unit,ICU)接受治疗[6]。一项对1 291例资料完整SARS患者的研究[7]结果显示,SARS患者中合并心脑血管病的比例约为17%,而其中发展为重症和多器官障碍综合征(multiple organ dysfunction syndrome,MODS)的危险分别是无基础病者的1.819倍和1.974倍,有心脑血管疾病的SARS患者重症构成比和MODS发生率分别为58.18%和27.27%。提示心脑血管疾病患者感染冠状病毒后发展为危重症概率较大。而在目前最大规模COVID-19流行病学分析研究[8]报道中(诊断日期截至2020年2月11日),共报告72 314例病例,其中确诊病例44 672(61.8%),确诊病例中,死亡1 023例,粗病死率为2.3%,未报告合并症患者的粗病死率约为0.9%,有合并症患者的病死率则高很多,心血管疾病患者高达10.5%,糖尿病为7.3%,慢性呼吸道疾病为6.3%,高血压病为6.0%。感染2019-nCoV后,合并心血管疾病或糖尿病、高血压等慢性病的患者病死率较高。
既往有心血管系统基础疾病患者在感染新冠病毒后,发展为重型和危重型的可能性更高,病死风险也明显增加,需要在诊疗中对心血管系统可能受到的损伤加以重视。本文即对病程中心血管系统可能受损的机制进行初步探讨。
1 病毒直接损伤心肌
和流感病毒、柯萨奇病毒等一样,冠状病毒对心肌的损伤在既往研究[9-11]中也有报道,部分SARS 患者会出现心律失常和心肌损伤标志物异常。在一项对2003年6 例SARS死亡患者心脏组织及其中1 例死者的心脏传导系统进行的病理研究[9]中,研究者应用HE染色、组织化学及核酸原位杂交等方法,发现患者的心脏损伤表现为心肌细胞空泡变性、萎缩和少数心肌细胞肌浆溶解,Macchiavello染色结果显示心肌细胞胞质内偶见病毒包涵体;核酸原位杂交结果显示少部分心肌细胞及心脏传导系统特化心肌细胞内呈现冠状病毒阳性杂交信号(图1,2),提示SARS-CoV不仅能够感染心肌细胞, 而且可感染心脏传导系统中的特化心肌细胞,为解释临床上SARS 患者心肌及传导系统受损出现心律失常和心肌酶谱异常提供了一定的病理学依据。2016年关于MERS-CoV引起病毒性心肌炎的1例病例报道[10]中,60岁男性患者出现肺炎和充血性心力衰竭,入院第1天即发现肌钙蛋白-I(troponin-I,Tn-I)升高及左心室收缩功能障碍,痰标本MERS-CoV阳性,心血管磁共振显示急性心肌炎表现。Huang等[6]发现早期的41例COVID-19患者中有5例(12%)Tn-I升高,41例的Tn-I中位数3.4 pg/mL,此5例患者被考虑存在急性心肌损伤。
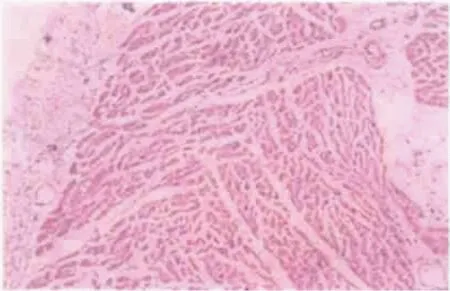
图1 心内膜及心肌间质[9] Fig. 1 Mild edema of endocardium and myocardial interstitium (HE,100×)Vasodilation, lymphocyte infiltration, a small amount of atrophy and vacuolar degeneration of myocardial fibers, rarely focal myolysis.
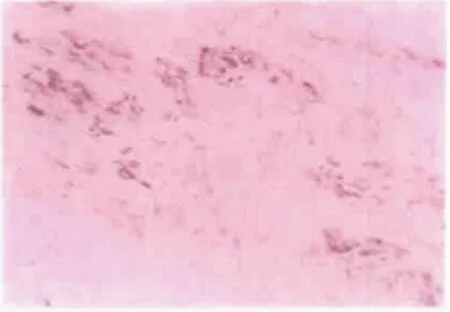
图2 窦房结内部分特化心肌细胞胞质内SARS-CoV RNA杂交阳性Fig.2 SARS-CoV RNA hybridization positive in the cytoplasm of some special myocardial cells in sinoatrial node (nucleic acid in situ hybridization staining, 100×)[9] SARS-CoV: severe acute respiratory syndrome coronavirus.
另外Li等[11]发现肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)中的重要调节酶血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2),是冠状病毒损伤细胞的重要介质:产生大量 ACE2 的组织细胞 (如心脏、肺、肾脏等)与产生SARS-CoV表面分子的细胞可以互为融合,这些细胞比普通细胞更易受SARS-CoV感染,应用ACE2的抗体可减缓细胞内SARS-CoV复制,证明了ACE2是SARS-CoV的功能性受体,也部分解释了拥有ACE2的心肌细胞内可出现病毒包涵体。ACE2主要的作用是拮抗ACE与血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)的作用,水解AngⅡ生成血管紧张素1~7(Ang1~7),而后者有舒张血管,抗生长、抗增生和调节凋亡,调节血压、抗动脉粥样硬化形成和改善心功能等重要作用,如果ACE2途径受到严重影响,其拮抗RAAS系统的心血管保护作用也可能会被削弱。且由于其不仅分布于肺部,心脏和肾脏更是ACE2主要分布组织[12],故其介导的冠状病毒组织损伤不仅可发生于肺部,心脏等脏器的直接损伤更是不容小觑。Oudit等[13]通过鼠的动物研究和SARS患者的尸检发现,SARS-CoV感染可导致心肌损伤并伴随着ACE2表达的明显降低,35% (7/20)的SARS-CoV感染者心肌组织中发现了病毒的RNA,同时发现明显的巨噬细胞浸润和心肌损伤,且这些患者组织中ACE2表达明显降低。而小鼠肺部感染人SARS-CoV也可导致ACE2依赖性心肌感染,ACE2表达同样显著降低,证实了ACE2在介导SARS-CoV心脏感染中的重要作用,提示由于病毒结合的消耗及RAAS过度激活可造成ACE2的下调。SARS及MERS的冠状病毒通过S蛋白与宿主细胞上的不同受体结合,SARS病毒的受体主要是ACE2,MERS病毒的受体主要是二肽基肽酶4[14]。以上发现均基于SARS或者MERS冠状病毒的既有研究[12-14],目前尚无COVID-19患者病理证据支持。Xu等[15]在关于2019-nCoV的S蛋白与人ACE2相互作用进化分析及模型研究中发现,2019-nCoV的S精氨酸序列与其他两种冠状病毒相比虽出现明显变化,却在受体结合结构域(receptor binding domain,RBD)上具有几乎相同的三维结构,从而在与ACE2相互作用界面上保持了相似的范德华力和静电性质,与人ACE2分子仍能强烈相互作用结合,这一结合途径造成了重大的公共健康风险。故ACE2成为了一把双刃剑,本身其具有心血管保护作用,降低左室后负荷,拮抗动脉粥样硬化,但随着冠状病毒的侵入,其心血管保护作用不能再充分发挥,且介导病毒损伤细胞,特别是心脏与肺,直接间接均造成循环与呼吸受损。
2 COVID-19合并症或伴随情况对心血管系统的影响
2.1 呼吸困难
截至2020年1月2日,Huang等[6]的研究中,有41例入院患者具有实验室确认的2019-nCoV感染,发病时的常见症状为发烧(98%),咳嗽(76%),有22名患者出现了呼吸困难(55%),从发病到呼吸困难的中位时间为8 d,全部41例患者均患有肺炎,合并症中急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)12例占比 29%。Nanshan等[16]的回顾性单中心研究中,纳入了2020年1月1日至2020年1月20日在武汉金银滩医院诊治的所有2019-nCoV病例99例,其中82名(83%)患者出现发烧的临床表现,81名(82%)患者咳嗽,31名(31%)患者呼吸急促,影像学检查结果发现74例(75%)患者表现出双侧肺炎, 1例患者(1%)出现有气胸,17例(17%)患者发展为ARDS,其中11例(11%)患者在短时间内恶化并死于MODS。而随后Guan等[17]扩大样本量,截至2020年1月29日,从552家医院中提取了1 099例经实验室确认的2019-nCoV ARD患者的数据。发现发烧(87.9%)和咳嗽(67.7%)是最常见的症状。合并症中肺炎达到79.1%,ARDS占3.4%,症状方面呼吸短促占18.6%。以上研究均提示2019-nCoV感染导致的肺炎可造成患者出现呼吸急促、呼吸困难、肺部渗出甚至ARDS,肺部病变可引起明显的气体交换障碍,影响通气/血流比,出现低氧血症。早期呼吸急促时其实呼吸动力学即已经发生改变,胸腔内压随着呼吸力学的变化也会影响血流动力学,增加心室负荷,特别是对有心血管基础疾病患者。待出现化验可见的低氧血症时,患者往往已经在呼吸代谢方面出现失衡,此时潜在心血管系统病变也可能恶化,呼吸困难不能排除有心功能下降的复合因素混杂。同时明显的低氧血症,增加无氧酵解,乳酸堆积,出现代谢性酸中毒和氧自由基生成,破坏细胞膜的磷脂层,随着病程继续,细胞内的钙离子浓度明显升高,启动包括细胞凋亡在内的一系列细胞损伤,心肌细胞面临缺血、缺氧和细胞损害的严重打击。
2.2 炎性反应
冠状病毒如SARS-CoV或MERS-CoV的高致病性病理生理学机制目前尚未完全清楚,但是早期研究[18]显示冠状病毒可造成体内炎性反应上调,血清中促炎细胞因子,如白细胞介素(interleukin,IL)-1B、IL-6、IL-12、干扰素γ(interferon-γ,IFN-γ)、干扰素诱生蛋白10(interferon-inducible protein-10,IP-10)和单核细胞趋化蛋白-1(monocytechemoattractantprotein-1,MCP-1) 的大量增加与肺部炎性反应程度及广泛的肺损伤相关。MERS-CoV感染还可引起促炎细胞因子[IFN-γ、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL- 15和IL-17]的明显升高[19]。Huang等[6]的研究中,与对照组健康成人血浆相比较,感染2019-nCoV的患者无论是否入住ICU其血浆细胞因子或趋化因子如IL-1B、IL-1RA、IL-7、IL-8、IL-9、IL-10、碱性成纤维细胞因子、粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)、巨粒细胞集落刺激因子(granulomacrocytic colony stimulating factors,GM-CSF)、IFN-γ、IP-10、MCP-1、巨噬细胞炎性蛋白1A(macrophage inflammatory protein 1A,MIP-1A)、MIP-1B、血小板源性生长因子(platelet derived growth factor,PDGF)、TNF-α和血管内皮生长因子(vascular endothelial growth factor,VEGF)都有所升高,可能导致激活T辅助细胞1(Th1)反应,另外入住ICU组患者血浆IL2、IL-7、IL-10、GCSF、IP-10、MCP-1、MIP-1A、TNF-α浓度明显高于非入住ICU患者,提示细胞因子风暴与疾病严重程度有关。然而2019-nCoV感染也上调了抑制炎性反应的T辅助细胞2(Th2)细胞因子的分泌(如IL-4和IL-10)[6]。这与SARS-CoV感染不同[18]。需要进一步的研究来探索2019-nCoV感染的Th1和Th2作用甚至体内炎性反应程度机制。尸检或活检研究将是了解这种疾病的关键。Nanshan等[16]研究同样提示,99例COVID-19患者中,降钙素原升高者6例(6%),IL-6增加者51例(52%),血清铁蛋白增加者62例(63%)。Guan等[17]的研究中也发现感染2019-nCoV 患者中较大比例(60.7%)出现C反应蛋白(C-reactive protein,CRP)升高,此外降钙素原≥0.5 ng/mL的比例也达到5.5%。以上研究均提示2019-nCoV感染后可引起明显的炎性反应,类似全身炎性反应综合征(system inflammatory reaction syndrome,SIRS) 能够造成多脏器功能损伤。目前病例报道[18-19]中某些重症患者或病情突然急剧恶化者被临床医生考虑有可能与体内炎性风暴相关,但以上临床思路尚需要检验等加以佐证。另外COVID-19的低氧血症与炎性反应的关系亦不能忽略。研究[20]显示,缺氧会造成内皮细胞发生应激反应,包括细胞增生、迁移、炎性反应和凋亡,缺氧也会造成氧自由基生成增加,以上炎性反应细胞浸润、细胞因子的释放、氧自由基损伤和细胞凋亡如发生于心肌或冠状脉内皮细胞,则会直接导致心肌损伤或冠状动脉血运受阻。研究[21]显示持续高浓度的炎性因子TNF-α可改变肌膜蛋白,从而破坏心肌细胞,并促进和维持大量单核巨噬细胞、自然杀伤细胞和杀伤性T淋巴细胞等向心肌浸润,导致心肌局灶性坏死和纤维化。另一种重要的炎性因子IL-6也可通过一系列反应促进中性粒细胞释放超氧阴离子、穿孔素及抑制内皮细胞合成释放一氧化氮等机制引起或加重心肌损伤[22]。病毒感染通过炎性反应损害心肌,并造成组织渗出有效循环容量不足,外周血管阻力变化,最终影响循环。而感染性休克对心肌的抑制也不能忽视,此类患者6 h内会约有20%出现左心室功能障碍,到发病后1~3 d该合并症发生率可增加至60%[23],直接造成心肌顿抑心功能下降。以上炎性风暴或者感染性休克打击心血管系统及全身多脏器功能,引发MODS从而造成病情积重难返,应该早期加以关注,保护各器官系统包括心血管系统少受累及。
2.3 凝血异常、发热及应激状态
无论是炎性反应还是严重感染发生SIRS后,患者均可能出现凝血异常,炎性反应可造成高凝状态,微栓子形成,微循环障碍,器官衰竭并消耗大量的凝血物质包括血小板与凝血因子,进一步启动弥散性血管内凝血后患者进入危重状态。Nanshan等[16]在对99例COVID-19患者的临床观察中发现,血小板增加的患者4例(4%)降低者12例(12%),活化部分凝血活酶时间(activated partial thromboplastin time,APTT)延长6例(6%),缩短16例(16%),凝血酶原时间(prothrombin time,PT)延长5例(5%),缩短30例(30%),D二聚体(D-dimer)增加36例(36%)。一项对41例患者的研究[6]中,入住ICU患者入院时凝血酶原时间和D-二聚体浓度明显高于非ICU患者,即重症患者凝血异常表现更为明显。Guan等[17]则发现D-dimer增加的患者高达46.4%。当患者表现出高凝倾向时,心血管系统风险明显增加,可出现冠状动脉系统血栓形成以及微循环障碍。
COVID-19患者在病程中可出现发热症状,而发热本身可以造成患者心率增快、心律失常,心脏每搏输出量下降,心肌做功与耗氧量增加,氧供需平衡失调,乏氧代谢的心肌组织不堪重负,故应对此情况造成的心律失常的心功能变化予以关注。
另外,缺氧、病毒感染、疾病特别是重症状态对情绪和认知能力的影响(恐惧、抑郁、焦虑等)均是应激的典型因素,会导致大量的儿茶酚胺分泌,造成心律失常、血管收缩等,从而出现应激性心肌病甚至创伤后应激障碍(post-traumatic stress disorder,PTSD)。Nanshan等[16]的回顾性单中心研究中,99例感染2019-nCoV病例中有9例出现意识混乱,对此类患者特别是重症、高龄女性应该关注,避免应激刺激心血管系统造成脆弱的循环雪上加霜。
3 治疗用药的心血管反应
《新型冠状病毒感染的肺炎诊疗方案(试行第六版)》[2]中治疗用药推荐:干扰素、洛匹那韦、利托那韦、利巴韦林、磷酸氯喹、阿比多尔等,但目前以上药物的有效性还都没有确切的研究结果和数据。其中氯喹说明书批准适应证为恶性疟、间日疟等疟疾。也用于肠外阿米巴病的治疗,还有抗风湿作用。除了治疗疟疾以外,磷酸氯喹表现出了一定的抗病毒作用。由于氯喹可以改变内吞体的pH值, 对通过内吞体途径侵入细胞的病毒感染具有一定的抑制作用,如博尔纳病病毒、禽白血病病毒、寨卡病毒等。氯喹还可以抑制病毒基因表达从而影响病毒复制,比如人免疫缺陷病毒1(human immunodeficiency virus 1,HIV-1)。另外,氯喹还是一种的自噬抑制剂,可以通过影响自噬反应进而干扰病毒的感染复制,如禽流感H5N1病毒。但是氯喹不良反应也有提示:偶可引起窦房结抑制,导致心律失常、休克,严重时可发生阿-斯综合征,而导致死亡。故在使用时候需对高危患者进行心电监测。
阿比多尔(曾用名阿比朵尔)是一类非核苷类抗抗流感病毒药物,属于血凝素酶抑制剂。作用机制主要是通过激活体内2,5-寡聚腺苷酸合成酶(抗病毒蛋白),特异性抑制病毒脂质囊膜与宿主细胞膜的接触、黏附及融合阻断病毒基因穿入细胞核,抑制病毒DNA和RNA合成。另外,阿比多尔还可以诱导干扰素生成,发挥广谱抗病毒作用。但需要注意的是,阿比多尔制剂的人体生物等效性试验[24]中,服药3 h后部分健康受试者出现心动过缓的情况。如与磷酸氯喹合用需密切监测心脏不良反应。
洛匹那韦、利托那韦适用于与其他抗反转录病毒药物联合用药,治疗HIV-1感染。在SARS治疗期间使用此类药物早期治疗的患者类固醇使用减少,医院感染减少,病毒载量减少,外周血淋巴细胞计数升高,临床疗效明显良好。但其心血管不良反应包括:可引起总胆固醇和三酰甘油浓度较大幅度升高;在对接受蛋白酶抑制剂治疗的HIV感染患者的观察[24]中,有新发糖尿病、原有糖尿病加重和高血糖的病例;还有轻度的无症状性PR间期延长,如患者存在结构性心脏病和原有传导系统异常或应用可引起PR间期延长的药物(如维拉帕米或阿扎那韦),在应用洛匹那韦、利托那韦后偶有2度或3度房室传导阻滞发生,且其是细胞色素P450异构体CYP3A的抑制剂,不建议与心血管治疗用药如利伐沙班、阿托伐他汀联合用药。故对于有基础心脏疾病患者,应用此药物需定期监测血脂、血糖,并与必要时进行心电监测,调整心血管常规用药以避免不良反应或药物间相互作用造成的循环影响。
另外关于血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitors,ACEI)及血管紧张素受体拮抗剂(angiotensin receptor blocker,ARB)在疫情中的使用问题,有研究[13]显示由于冠状病毒结合的消耗及RAAS过度激活可造成ACE2的下调,即保护性RAAS轴下调,此系统过度的反应可导致更严重的心血管损伤、肺损伤等。由此分析疫情期间应用ACEI反而具有重要的保护作用。但李红芳等[25]考虑ACEI、ARB类药物在抑制ACE、血管紧张素受体1(angiotensin receptors 1,AT1)发挥降压作用的同时会反射性增加ACE2的表达,故笔者分析ACEI及ARB的应用可能会上调病毒对细胞的攻击,甚至有可能增加重症风险。但以上观点目前并无定论,且并无有力证据支持,鉴于此,欧洲高血压学会(European Society of Hypertension,ESH)指南[26]认为目前没有证据表明高血压与COVID-19发病风险增加相关,因比,高血压患者应采取与其他同年龄段、相同合并症患者相同的预防措施;对于病情稳定的COVID-19合并高血压患者,或者有发病风险的高血压患者,应该依据2018 ESH指南[26]的建议使用ACEI或ARB类药物,不支持在COVID-19患者中差异化使用RAAS阻滞剂(ACEI或ARB);对于症状严重或合并脓毒症的患者,是否继续使用RAAS阻滞剂或其他降压药物应遵循现行指南,并根据患者具体情况做出个体化决定。
综上所述,面对COVID-19的新形势与新挑战,大部分研究均有一定局限性,COVID-19相关心血管损伤的机制并不完全清楚。但医务工作者需要有意识对此疾病造成的各系统损伤加以关注,并警惕高危因素及时早期阻断损害发生。目前最大样本研究[17]发现COVID-19患者男性多于女性,50岁以上患者约44%,此类人群也是心血管疾病高发人群。而上述研究[6,8]也提示合并心血管疾病的患者发展为重症甚至死亡概率较高。故需要从冠状病毒本身对心血管系统的损害和与ACE2之间的互相作用入手分析[6,9-15],并重视其间接通过炎性反应、凝血异常、发热、应激等持续打击心血管系统,造成循环的失代偿,进而造成严重不良后果。建议对高危患者常规进行心电、心肌标志物、血浆脑利钠肽、超声心动等监测,必要时可进行无创或有创中心静脉压、中心静脉血氧饱和度、心排出量等监测。在进行呼吸支持时,同步考虑呼吸衰竭及呼吸力学改变对心脏前后负荷影响,并优化处理策略。出现心律失常首先分析成因,对因处理优先,应用镇痛镇静及抗心律失常等药物也需要考虑对循环的影响。COVID-19推荐用药也可能有一定的心血管不良反应,老年人有基础疾病者或合并用药时需更加注意。长期卧床患者需要评估深静脉血栓风险和及时加以干预。
