GPIHBP1基因敲除小鼠在严重高三酰甘油血症急性胰腺炎导致肺损伤研究中的应用
2020-07-21徐有青崔纯莹赵志刚
柳 鑫 徐有青 崔纯莹 赵志刚*
(1. 首都医科大学附属北京天坛医院药学部,北京 100070; 2. 首都医科大学附属北京天坛医院消化内科,北京 100070; 3. 首都医科大学药学院,北京 100069)
急性胰腺炎(acute pancreatitis,AP)是发生在胰腺内部和胰腺外周的一种急性炎性反应。胰腺腺泡内聚集的溶酶体酶与消化酶,催化胰蛋白酶原生成胰蛋白酶,导致腺泡细胞裂解[1]。急性胰腺炎会引起器官衰竭,在急性炎性反应阶段,胰腺内小叶动脉括约肌受损,发生局部性狭窄,血流量减少,胰腺组织发生坏死,胰腺外器官受损,引起肺、肾脏与肝脏等多器官功能紊乱,这是导致重症急性胰腺炎发病与死亡的原因之一[2],在美国,每年每10万成年人中,约有40例急性胰腺炎患者死于器官功能障碍[3]。
严重高三酰甘油血症导致急性胰腺炎易感性增加,在急性胰腺炎的诱发因素中占比达到近10%[4]。流行病学调查[5]显示,当患者的血浆三酰甘油浓度高于1 000 mg/dL与2 000 mg/dL时,发生急性胰腺炎的比例分别为5%和10%~20%。在体内脂质代谢过程中,脂蛋白脂酶(lipoprotein lipase,LPL)作为三酰甘油水解的限速酶[6],其发挥作用依赖于糖基化磷脂酰肌醇锚定高密度脂蛋白结合蛋白1(glycosylphosphatidylinositol-anchored high-density lipoprotein binding protein 1,GPIHBP1)[7]。GPIHBP1在血管内皮下与LPL结合,作为其发挥脂解作用时的重要锚定结合蛋白,当GPIHBP1基因发生功能缺失性突变,将导致LPL无法正常发挥脂质分解作用,引起血浆三酰甘油浓度极度升高[8]。
目前,有关GPIHBP1基因敲除小鼠应用于急性胰腺炎的研究尚未见报道,严重高三酰甘油血症急性胰腺炎是否会引起急性肺损伤,也未明确。本研究拟采用GPIHBP1基因敲除小鼠进行实验,建立急性胰腺炎动物模型,探讨严重高三酰甘油血症时急性胰腺炎与肺损伤的关系。
1 材料与方法
1.1 实验动物及主要试剂
GPIHBP1基因敲除小鼠,由美国Jackson实验室提供,为C57BL/6J背景,8周龄,雄性小鼠;对照为同窝野生型小鼠。实验动物饲养于北京大学医学部,实验动物许可证号:LA2010-059,环境温度为20~24 ℃,正常日光周期,自由进食及饮水,保持垫料干燥。
雨蛙素购自美国Sigma公司,生化试剂盒(淀粉酶、三酰甘油、总胆固醇与血糖等试剂盒)购自中生北控生物科技公司。
1.2 动物分组及基因型鉴定
实验分为2组:WT组(野生型)和GPIHBP1-/-组(GPIHBP1基因敲除),每组6只。采用PCR鉴定和血脂分析(血浆三酰甘油浓度测定),双重筛选确认基因型。所采用引物见表1。监测体质量,禁食12 h,内眦取血,检测血浆葡萄糖与脂质含量。

表1 基因型鉴定的引物序列
1.3 急性胰腺炎诱导
两组小鼠自由饮水状态禁食12 h,腹腔注射雨蛙素(50 μg/kg),1次/h,连续注射7次,诱导胰腺炎,24 h 后处死小鼠,采用PBS灌流,取胰腺与肺组织,进行形态分析。
1.4 血浆淀粉酶活性检测
禁食12 h后,在不同时间点(0、9、12及24 h),内眦采血,肝素抗凝,高速离心(4 ℃,12 000 r/min,60 min),小心吸取下层澄清液3 μL入96孔板,加入淀粉酶工作液100 μL,37 ℃孵育3 min,入酶标仪分别于605 nm波长处读取不同时间点(1 min末、2 min 末、3 min末)的A值,计算淀粉酶活性(U/L)= [A值(3 min)-A值(1 min)]/2×3 245×稀释倍数,当[A值(3 min)-A值(1 min)]/2>0.3时,用去离子水稀释测定,每组样品测定3次,取平均值。
1.5 胰腺与肺组织染色与病理评估
取胰腺与肺组织,分别给予25%~100%(体积分数)乙醇浸泡10 min,脱水,二甲苯浸泡,至组织透明,加入液态石蜡,在60 ℃保温30 min,采用石蜡切片,用二甲苯脱蜡,无水乙醇洗脱二甲苯,分别使用苏木精-伊红染色1 min,二甲苯洗脱处理后,中性树胶封片,采集图像,分别进行胰腺与肺组织病理评分(表2,3)。

表2 胰腺组织病理评分标准
表3 肺组织病理评分标准
1.6 肺泡灌洗
给予1%(质量分数)异戊巴比妥钠腹腔注射麻醉小鼠,经气管插管,行肺泡灌洗,灌入0.9%(质量分数)氯化钠注射液500 μL/次,共6次,抽吸计回收量。收集灌洗液于离心管中,回收率>80%为合格标本。取10 μL用于细胞计总数,细胞悬液滴于计数板上,使悬液自由充满盖片下方间隙,勿留气泡,在光镜下观察并数出四角大格内的细胞数,压线时只计上线和右线的细胞,然后按下式计算出细胞总数:细胞数=(四大格中的细胞总数/4)×104/mL;回收液细胞总数=每毫升细胞数×回收肺泡灌洗液总量。
1.7 统计学方法
2 结果
2.1 基因型鉴定与血脂浓度
为了鉴定基因型,本研究设计两对引物,其中一对引物设计在敲除片段上,野生型在517 bp处有一亮条带显示,而敲除小鼠无亮带显示,另一对引物设计在敲除片段的上游与下游,在野生小鼠中,由于PCR产物较长,无法有效获得PCR产物,而在敲除小鼠中,由于删除一段后在801 bp处可见一亮条带(图1)。GPIHBP1-/-小鼠体质量及血糖值与WT小鼠比较,差异无统计学意义(P>0.05,图2A、B),GPIHBP1-/-小鼠血浆三酰甘油与总胆固醇浓度均明显高于WT小鼠,差异有统计学意义(P<0.05,图2C、D)。
图1 GPIHBP1-/-小鼠基因型鉴定Fig.1 Genotype identification of GPIHBP1-/- miceGPIHBP1: glycosylphosphatidylinositol-anchored high-density lipoprotein binding protein 1.
图2 GPIHBP1-/-小鼠血浆脂质升高Fig.2 GPIHBP1-/- mice showed higher plasma levels of lipidsA: body weight; B: glucose; C: triglyceride; D: total cholesterol;n=6,*P<0.05; WT: wild type; GPIHBP1:glycosylphosphatidylinositol-anchored high-density lipoprotein binding protein 1.
2.2 血浆淀粉酶活性检测
随着时间变化,GPIHBP1-/-小鼠与WT小鼠血浆淀粉酶活性均发生明显改变(F时间=21.359,P=0.004),但组间差异无统计学意义(F组间=0.203,P=0.668)(图3)。
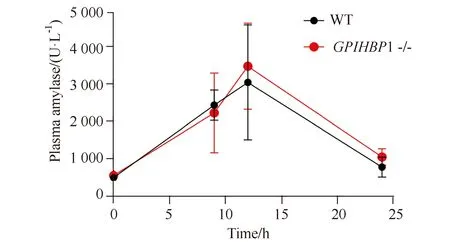
图3 GPIHBP1-/-小鼠血浆淀粉酶活性Fig.3 Amylase activity in GPIHBP1-/- mice WT: wild type; GPIHBP1: glycosylphosphatidylinositol-anchored high-density lipoprotein binding protein 1.
2.3 胰腺与肺病理损伤
与WT小鼠相比,GPIHBP1-/-小鼠胰腺水肿病变显著,小叶内部有较宽间隙,炎性细胞于叶间积聚(图4)。胰腺病理评分比较,GPIHBP1-/-小鼠明显高于WT小鼠,差异有统计学意义(P<0.05)(表3)。
肺组织病理切片HE染色结果显示,GPIHBP1-/-小鼠较WT小鼠肺组织病理改变较显著,光镜下可见肺泡间隔内毛细血管扩张充盈,炎细胞浸润明显,偶
见支气管壁增厚、气道上皮坏死、糜烂和气道壁炎细胞浸润、杯状上皮化生、平滑肌细胞增生肥大等表现(图5)。对肺组织肺泡间隔内炎细胞浸润指标进行病理评分,GPIHBP1-/-小鼠高于WT小鼠,差异有统计学意义(P<0.05)。
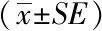
表3 两种小鼠胰腺组织和肺组织病理学评分
图4 GPIHBP1-/-小鼠胰腺病理损伤明显加重Fig.4 Pathological damage of pancreas in GPIHBP1-/- mice significantly aggravated(HE staining,Scale bar=200 μm)A: WT mice; B: GPIHBP1-/- mice; WT: wild type; GPIHBP1: glycosylphosphatidylinositol-anchored high-density lipoprotein binding protein 1.
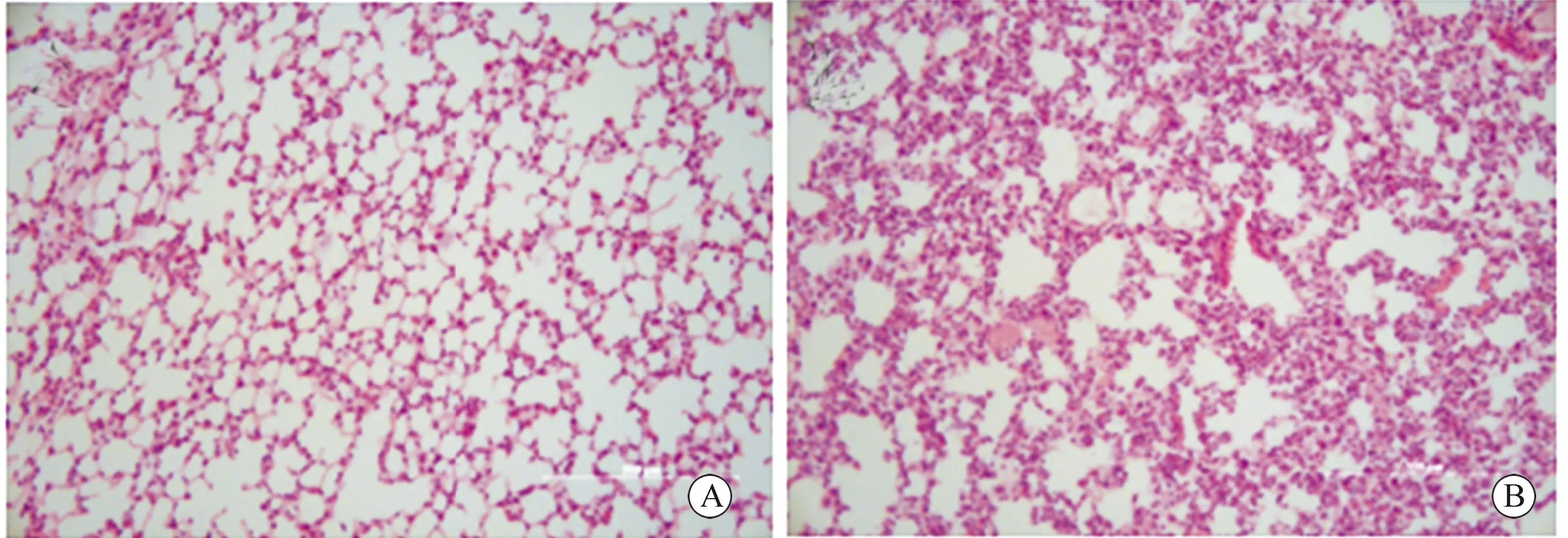
图5 GPIHBP1-/-小鼠肺病理损伤显著加重Fig.5 Pathological damage of lungs in GPIHBP1-/- mice significantly aggravated(HE staining, Scale bar=200 μm)A: WT mice; B: GPIHBP1-/- mice; WT:wild type; GPIHBP1: glycosylphosphatidylinositol-anchored high-density lipoprotein binding protein 1.
2.4 GPIHBP1-/-急性胰腺炎小鼠肺泡灌洗液细胞计数
对诱导急性胰腺炎后的GPIHBP1-/-小鼠与WT小鼠分别行支气管插管和肺泡灌洗,对肺泡灌洗液细胞进行计数(图6),GPIHBP1-/-小鼠支气管肺泡灌洗液中细胞总数百分比较WT小鼠增加1.63倍,差异有统计学意义(P<0.05)。

图6 GPIHBP1-/-小鼠肺泡灌洗液细胞总数增加Fig.6 Total number of cells in alveolar lavage increased in GPIHBP1-/- mice*P<0.05; WT:wild type; GPIHBP1: glycosylphosphatidylinositol-anchored high-density lipoprotein binding protein 1.
3 讨论
本研究中GPIHBP1基因缺失导致的严重高三酰甘油血症小鼠,急性胰腺炎易感性增高,肺组织病理明显改变,急性肺泡炎性反应加重,肺泡间隔内中性粒细胞增多。
在探索严重高三酰甘油血症急性胰腺炎与肺损伤病理改变时,本研究采用了一种特殊的基因工程动物模型:GPIHBP1基因敲除小鼠。GPIHBP1基因敲除后,可导致血浆三酰甘油升高10倍以上(超过1 000 mg/dL),且不影响动物的全身状态,繁殖容易,存活率高,是一种较为理想的严重高三酰甘油血症小动物模型。给予雨蛙素诱导急性胰腺炎后,GPIHBP1基因敲除小鼠的血浆淀粉酶活性随时间发生明显变化,尽管组间差异无统计学意义,但在临床中也确有相关报道[9-10]。高三酰甘油血症胰腺炎患者的血浆淀粉酶活性在正常范围内波动,血浆淀粉酶活性可能并不是一个较灵敏的生物标志物,对于临床诊疗意义不大。
在急性胰腺炎进展过程中产生的大量炎性细胞因子,是引起胰腺外组织产生炎性反应的重要原因之一[11]。其病理进程可分为三个阶段,局部刺激引起钙离子释放,酶原激活,胰腺细胞受损,出现早期症状如上腹部疼痛;进而在损伤的腺泡细胞内部,出现酶原活化的正反馈调节,胰腺自身逐渐被消化,炎性反应向胰腺外组织扩散;在炎性反应进一步扩散中,血管通透性升高,胰腺内外募集的多种炎性反应因子进一步侵袭胰腺外组织。其中,肺组织最早出现病理改变[12]。肺损伤在急性胰腺炎患者中发生率较高,这也是导致急性胰腺炎并发多器官功能障碍的重要原因。当患者出现急性胰腺炎合并急性肺损伤或急性呼吸窘迫综合征时,病死率达到30%~40%[13]。本实验结果表明,GPIHBP1基因缺失引起的严重高三酰甘油血症,在诱发急性胰腺炎后伴有肺损伤病理改变,肺泡灌洗液中细胞数目增多。
磷脂酶A2含量增加与肺损伤具有一定的相关性[14]。在生理状态下,II型肺细胞产生的表面活性物质能够维持肺泡稳定性,如果肺表面活性物质的数量与功能发生改变,肺组织的结构与功能会随之发生病变[15]。急性胰腺炎时释放大量炎性反应因子及多种生物活性物质,包括磷脂酶A2,后者能水解肺泡表面活性物质。严重高三酰甘油血症时急性胰腺炎易感性增加,可能与游离脂肪酸增多及炎性反应密切相关[5]。另一方面,严重高三酰甘油血症时内皮细胞功能发生紊乱,多种炎性反应因子如磷脂酶A2募集于血液中及内皮细胞下[16],这可能也是严重高三酰甘油血症时急性胰腺炎并发肺损伤的重要机制之一。
通过建立急性胰腺炎肺损伤模型,对进一步探讨急性胰腺炎时的肺损伤病理机制,以及改善临床症状与降低病死率尤为重要[17-18]。目前,临床对症治疗主要集中于两方面:抑制炎性反应与改善肺功能。临床前研究及临床试验[19-20]尝试通过药物调节炎性反应降低肺损伤,但均未获得实质性进展。近些年,重症急性胰腺炎合并肺损伤的病死率有所下降,主要缘于重症监护病房(intensive care unit,ICU)护理对肺通气功能的改善。但是,在急性胰腺炎的实验动物模型中,尚缺乏能够有效改善肺损伤的治疗手段,而在临床实践中,也缺乏有效措施来抑制急性胰腺炎引起的全身性炎性反应。
本研究应用GPIHBP1基因缺失的严重高三酰甘油血症小鼠模型,诱导急性胰腺炎,胰腺与肺组织病理损伤均明显加重,初步证实GPIHBP1基因敲除小鼠可作为理想的严重高三酰甘油血症动物模型,用于进一步的肺损伤发病机制研究,对进一步调节急性胰腺炎引起的远端组织器官功能紊乱,以及促进临床转化,具有一定的临床理论与实用价值。
