SIRT1对糖尿病胃轻瘫小鼠胃排空的影响及机制
2020-07-21周冬梅
郑 晗 周冬梅,2 苗 蓓,3 李 伟,2*
(1.徐州医科大学第一临床学院,江苏徐州 221004;2.徐州医科大学附属医院内分泌科,江苏徐州 221002;3.徐州医科大学附属医院消化内科,江苏徐州 221002)
糖尿病胃轻瘫(diabetic gastroparesis,DGP)是以腹胀、早饱、厌食、嗳气、恶心、体质量下降等为典型表现的糖尿病慢性合并症之一。DGP严重降低糖尿病患者的生活质量,多达50%的DGP患者出现明显的焦虑和/或抑郁(伴腹痛者尤甚)[1]。另外,DGP会加重糖尿病患者血糖控制难度,增加患者的住院率,加重患者的经济负担[2]。因此,探究DGP的发病机制并找到行之有效的防治办法对糖尿病患者而言尤为重要。
氧化应激被认为是糖尿病各种慢性合并症的统一发生机制[3],在DGP发病过程中发挥着重要作用[4]。Cajal间质细胞(interstitial cells of Cajal,ICC)是胃慢波活动的起搏细胞,可以生成和传播调节胃肠平滑肌收缩的电信号。研究[4]显示,DGP的发生与氧化应激所致ICC网络受损有关。
沉默信息调节因子1(silent information regulator 1,SIRT1)是一种细胞烟酰胺腺嘌呤二核苷酸依赖性脱乙酰基酶,主要通过使许多类型的关键转录因子和辅因子脱乙酰化,如:P53、核因子- κB(nuclear factor κB,NF-κB)、O型叉头转录因子盒蛋白(forkhead box protein,FOXO)和过氧化物酶体增生物激活受体共激活因子1(peroxisome proliferator activated receptor gamma coactivator,PGC-1),参与细胞周期停滞和衰老,这些因素可能会影响与诸如糖尿病等代谢性疾病有关的细胞途径[5],SIRT1与糖尿病及相关性疾病的发生、发展有关。SIRT1可以通过改善线粒体的氧化代谢,并在氧化应激下正向调节线粒体功能,以抵御氧化损伤[6]。因此,上调SIRT1可能改善糖尿病小鼠的胃排空延迟。
血红蛋白氧合酶-1(heme oxygenase-1,HO-1)被认为是可以对抗氧化应激的重要的细胞防御机制[7],HO-1的转录是由多种氧化还原依赖性信号通路如促分裂原活化蛋白激酶(mitogen activated protein kinase,MAPK),信号传导及转录活化因子3(signal transducer and activator of transcription 3,STAT3),特别是转录因子核因子E2相关性因子2(nuclear factor erythroid 2 related factor 2,Nrf2)诱导的[8]。BTB-CNC异体同源体1(BTB and CNC homology 1,Bach1)作为一种重要的转录抑制因子,可以通过竞争性抑制Nrf2与抗氧化反应元件(antioxidant response element,ARE)的偶联,进而下调抗氧化因子HO-1的基因转录[9]。SIRT1也可以调控HO-1基因转录[10]。因此,上调SIRT1可能通过下调组织中Bach1蛋白浓度,进一步调控HO-1的基因转录,从而发挥抗氧化作用。这可能成为DGP防治的新的靶点。
白藜芦醇(resveratrol,Res)是一种非黄酮类多酚化合物,具有显著的抗氧化活性。Res也是SIRT1的激活剂,可调节细胞周期,线粒体生物合成以及脂质和碳水化合物代谢,其抗氧化、抗炎、抗癌和心血管保护作用已在实验[11]中得到证实,但是Res作为SIRT1激活剂是否可以改善DGP小鼠的胃排空延迟,尚未见文献报道。
本实验主要探究SIRT1对DGP小鼠胃排空影响以及可能的作用机制,为临床预防和治疗DGP患者提供新的思路。
1 材料与方法
1.1 实验动物
6周雄性C57BL/6J小鼠,体质量20~23 g,购于济南朋悦实验动物繁育有限公司,实验动物许可证号:SCXK(鲁)2019-0003。室温(23±1) ℃,12 h光照周期,自由饮水摄食。该研究得到徐州医科大学动物实验伦理委员会的批准,伦理委员会审批号:2016036。
1.2 药物与试剂
Res(美国MCE公司),链脲佐菌素(streptozotocin,STZ)(美国Sigma公司);小鼠抗兔SIRT1多克隆抗体(美国Proteintech公司),小鼠抗兔Bach1多克隆抗体(美国ABclonal公司),小鼠抗兔c-kit多克隆抗体(美国Affinity Biosciences公司),小鼠抗兔HO-1多克隆抗体(美国Affinity Biosciences公司);丙二醛(malondialdehyde,MDA)试剂盒(江苏凯基生物技术公司 ),超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(江苏凯基生物技术公司 )。
1.3 分组、造模
实验前适应性饲养1周。6周龄C57BL/6J小鼠采用随机数字表法分为空白组、模型组、溶剂对照组和Res组。除空白组小鼠以外,其余小鼠按160 mg/kg一次性腹腔注射STZ[以1%(质量分数)溶于枸橼酸钠缓冲液中,现配现用],保证充足的饲料和饮用水。空白组小鼠腹腔注射等量的枸橼酸钠缓冲液。造模72 h 后采集尾静脉血检测随机血糖,随机血糖≥ 16.7 mmol/L为模型制备成功。
1.4 药物干预
模型建立成功后进行药物干预,Res组小鼠按照30 mg·kg-1·d-1的剂量给予SIRT1激活剂Res溶解于DMSO中,注射时0.9%(质量分数)氯化钠注射液稀释腹腔注射,溶剂对照组给予等量的DMSO 0.9%(质量分数)氯化钠注射液溶液腹腔注射,干预6周。
1.5 固体胃排空法检测胃排空
干预6周后,所有小鼠禁食、不禁水20~24 h,给予小鼠已知量的食物,自由进食3 h。3 h结束时,剩余食物称质量,以确定食物摄入量。小鼠再次禁食禁水4 h。4 h后,颈椎脱臼法处死小鼠,取出胃组织,测量整个胃的质量,沿胃大弯剪开胃组织,0.9%(质量分数)氯化钠注射液清洗胃内容物,滤纸吸干水分后测量胃净重。胃排空率按以下公式计算:胃排空率(4 h内)=(1-胃内残留食物质量/食物摄入量)×100%。
1.6 取材
将取出的胃组织沿胃小弯剪开,取胃窦部位,一部分用4%(质量分数)中性甲醛固定24 h后,石蜡包埋,进行免疫组织化学染色,另一部分,液氮速冻,于-80 ℃ 冰箱保存,用于Western blotting实验。
1.7 免疫组织化学染色
将石蜡包埋的胃窦组织切成6 μm切片,常规脱蜡再水化,按照二步法检测试剂盒步骤进行染色,一抗为兔抗SIRT1多克隆抗体(1∶200)或兔抗Bach1多克隆抗体(1∶100),用PBS代替一抗做阴性对照。DAB显色后,封片,在显微镜下进行观察。摄片后,用Image J软件分析结果,测得积分吸光度值(integrated optical density,IOD)代表阳性表达的强度,IOD=吸光度(A)×面积。
1.8 Western blotting检测
将新鲜冷冻胃窦组织剪碎后加入裂解液RIPA与酶抑制剂PMSF,进行匀浆(冰上进行),约5 min。将匀浆液在4 ℃下,12 000 r/min,离心15 min,收集上清液,BCA法测蛋白浓度。等量蛋白样品经十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)后,将分离出的蛋白转移的PVDF膜上,用3%(质量分数)BSA封闭2 h,加入一抗4 ℃ 孵育过夜。所用一抗如下:SIRT1抗体(1∶1 000)、Bach1抗体(1∶1 000)、HO-1抗体(1∶1 000)、c-kit抗体(1∶1 000)、β-actin抗体(1∶10 000)。次日TBST清洗后加入一抗种属特异性二抗(1∶1 000)室温孵育1 h,再次洗膜后用ECL显像试剂盒显影,置于凝胶成像仪中照相,并用Image J软件分析条带。
1.9 比色法检测组织总超氧化物歧化酶(total superoxide dismutase,T-SOD)活力以及MDA含量
将新鲜组织匀浆(冰上进行)后,4 ℃下4 000 r/min离心15 min,取上清液分别按照SOD试剂盒和MDA试剂盒步骤测定胃组织中的T-SOD活力以及MDA含量。
1.10 统计学方法
2 结果
2.1 各组小鼠的一般情况
空白组小鼠精神状态良好,反应灵敏,毛色亮泽,进食饮水正常,对抓取抵抗明显;模型组和溶剂对照组小鼠体型消瘦,食量减少,腹部胀满,毛色干枯无光伴有脱毛,活动迟缓,与空白组相比,体质量明显下降,血糖明显升高(P<0.05);Res组小鼠饮水及食量均增加,活动性增强,一般情况较模型组和溶剂对照组有改善,体质量及血糖与模型组和溶剂对照组小鼠相比,差异无统计学意义(P>0.05,表1、2)。
2.2 各组小鼠的胃排空率
与空白组相比,模型组和溶剂对照组小鼠的胃排空率明显下降(P<0.05);与模型组和溶剂对照组小鼠相比,Res组小鼠胃排空率明显升高(P<0.05);溶剂对照组与模型组小鼠间的差异无统计学意义,详见表3。
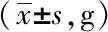
表1 各组小鼠的体质量变化
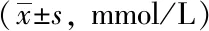
表2 各组小鼠随机血糖浓度变化
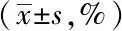
表3 各组小鼠的胃排空率
2.3 免疫组织化学检测各组小鼠胃窦组织中SIRT1、Bach1蛋白浓度
以细胞中出现黄色或棕黄色颗粒为阳性表达。免疫组织化学结果显示,SIRT1和Bach1主要在胞核内表达(图1)。用Image J软件分析免疫组织化学结果测得IOD值,与空白组小鼠相比,模型组和溶剂对照组小鼠胃组织中的SIRT1蛋白浓度明显下降,Bach1蛋白浓度明显升高(P<0.05);与模型组和溶剂对照组小鼠相比,Res组小鼠胃组织中的SIRT1蛋白浓度明显升高,Bach1蛋白浓度明显下降(P<0.05);模型组与溶剂对照组小鼠间比较,差异无统计学意义(表4)。
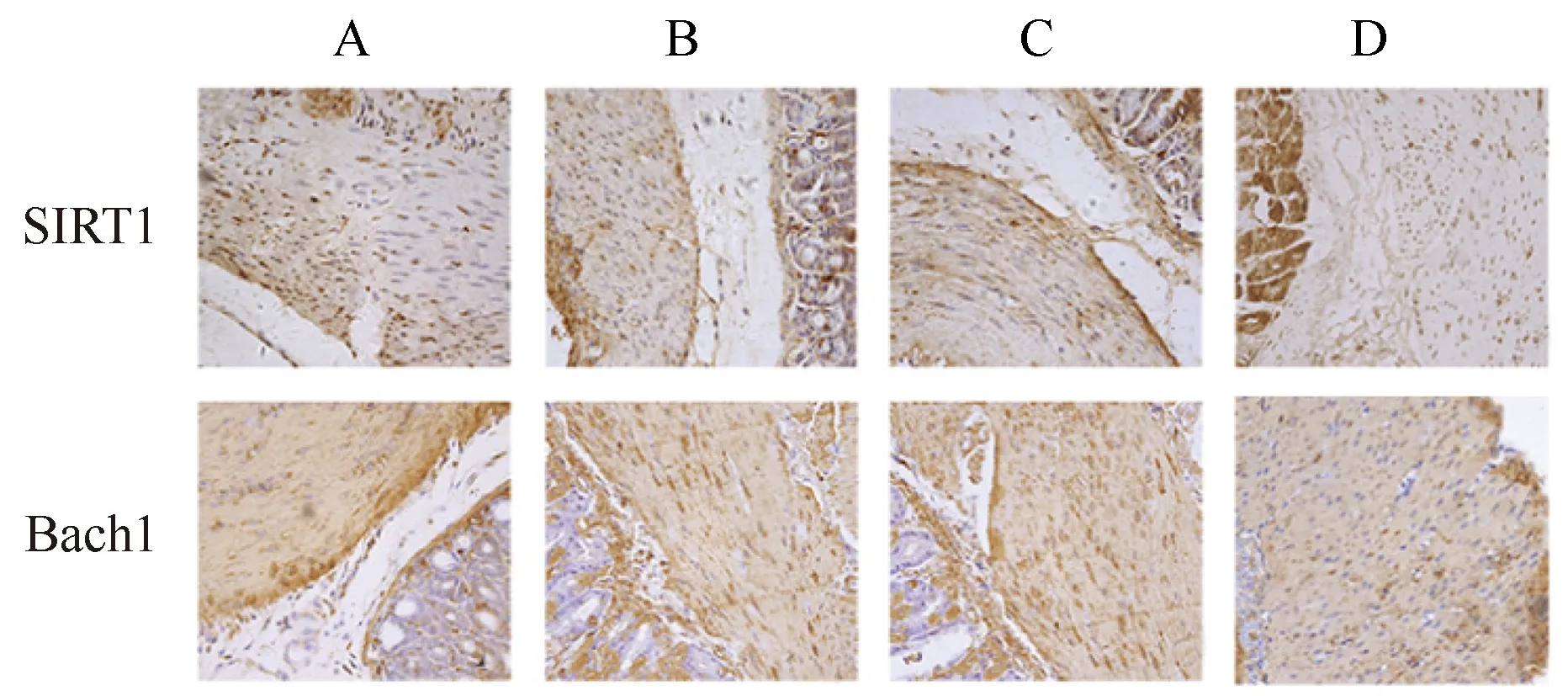
图1 各组小鼠胃窦组织SIRT1、Bach1表达Fig.1 Expression of SIRT1 and Bach1 in gastricantrum tissue of mice in each group(SP,40×)A: Blank group; B: Model group; C: Solvent control group; D: Res group; SIRT1: silent information regulator 1; IOD: integrated optical density; Res: resveratrol.
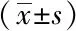
表4 SIRT1和Bach1在各组小鼠胃窦组织中的IOD值
2.4 Western blotting法检测各组小鼠胃窦组织中SIRT1、Bach1、c-kit以及HO-1蛋白浓度
Western blotting法检测结果显示,与空白组相比,模型组小鼠和溶剂对照组小鼠胃组织中的SIRT1、c-kit以及HO-1蛋白浓度明显下降,Bach1蛋白浓度明显升高(P<0.05),与模型组和溶剂对照组相比,Res组小鼠胃组织中SIRT1、c-kit以及HO-1蛋白浓度明显升高,Bach1蛋白浓度明显下降(P<0.05);模型组和溶剂对照组小鼠之间的差异无统计学意义(图2)。
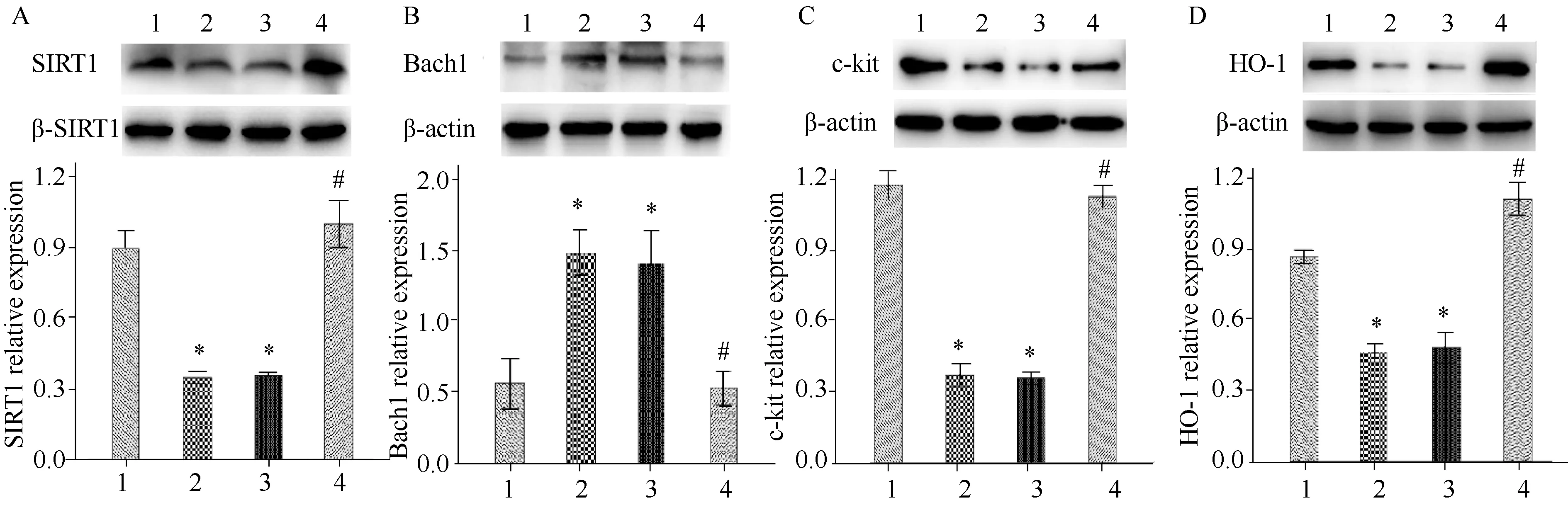
图2 各组小鼠胃窦组织SIRT1、Bach1、c-kit和HO-1浓度Fig.2 SIRT1, Bach1, c-kit and HO-1 protein levels in gastric antrum tissue of mice in each groupA: SIRT1 protein level; B: Bach1 protein level; C: c-kit protein level; D: HO-1 protein level; 1: Blank group; 2: Model group; 3: Solvent control group; 4: Res group; *P<0.05 vs Blank group, #P<0.05 vs Model group; Res: resveratrol; SIRT1: silent information regulator 1; HO-1: heme oxygenase-1; Res: resveratrol.
2.5 各组小鼠胃窦组织氧化应激相关因子MDA含量和T-SOD活力
与空白组小鼠相比,模型组和溶剂对照组小鼠胃组织中MDA含量明显升高,T-SOD活力明显下降(P<0.05);与模型组和溶剂对照组小鼠比较,Res组小鼠胃组织中的MDA含量下降,T-SOD活力升高(P<0.05);模型组小鼠与溶剂对照小鼠组间的差异无统计学意义(P>0.05,表5)。
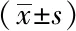
表5 各组小鼠胃窦组织MDA含量和T-SOD活力
3 讨论
氧化应激是DGP发病的重要机制之一[4, 12]。持续的高血糖状态导致细胞线粒体内产生过多的阴离子自由基,当超过细胞内抗氧化防御系统的清除能力时,就会在细胞线粒体内积累,积累的自由基可以作用于脂质发生过氧化反应,从而引起组织损伤。MDA是脂质过氧化反应的终产物之一,它会引起蛋白质、核酸等生物大分子的交联聚合,产生细胞毒性。SOD是机体酶抗氧化系统的一员,能清除超氧阴离子自由基,保护细胞免受氧化损伤。持续的糖尿病高血糖状态会导致体内自由基和脂质过氧化醛的产生增加,糖尿病相关氧化应激介导的器官功能损害是导致多种慢性合并症的关键因素[3],血清MDA浓度的升高与胃排空延迟密切相关[13]。ICC是胃慢波运动的起搏细胞,对胃肠动力的维持至关重要[14]。研究[4, 15]显示,DGP的发病与氧化应激所致的ICC减少有关。HO-1是机体重要的抵抗氧化应激的防御因子之一,研究[4]显示,在胃排空延迟的非肥胖型糖尿病(non-obese diabetic mice,NOD)小鼠的胃组织中发现HO-1上调的消失以及ICC标志物酪氨酸激酶受体(tyrosine kinase receptor,c-kit)表达的减少,但是在胃排空正常的NOD小鼠中未发现这种现象,施用HO-1诱导剂可以保护ICC网络免受氧化应激损伤,并使延迟的胃排空正常化[4]。本实验结果证实了模型组小鼠胃排空延迟,且该组小鼠胃组织中HO-1上调的缺失同时伴随着c-kit表达的减少,此外,本研究中胃排空延迟的小鼠胃组织中的MDA浓度明显升高,且T-SOD活力显著下降,氧化及抗氧化失衡,氧化应激浓度升高。以上证据表明糖尿病小鼠胃组织中较高的氧化应激浓度是ICC网络损伤的重要原因之一,最终会导致糖尿病小鼠胃排空率的下降。
研究[16]显示,SIRT1广泛参与基因调节,基因组稳定性维持,细胞凋亡、自噬、衰老、增生和肿瘤发生,主要通过使组蛋白和非组蛋白靶标脱乙酰基,在组织稳态和许多疾病的表观遗传调控中也具有关键作用。对糖尿病动物模型的研究[17-19]显示,低浓度的SIRT1会加重氧化应激损伤,而激活SIRT1可以减轻这种损伤:一项针对小鼠糖尿病心肌病的研究[20]显示,SIRT1下调会使心肌细胞中PGC-1α和HO-1的浓度降低,心肌活性氧产生增加,导致糖尿病性心肌病;另外,上调SIRT1可以通过激活Nrf2/HO-1通路减轻氧化应激,来改善糖尿病肾病的缺血再灌注损伤[21]。由此可见,HO-1是SIRT1发挥抗氧化作用重要的下游因子之一。本研究中STZ诱导的DGP小鼠胃组织中SIRT1表达减少,进一步导致HO-1上调的缺失,因此,SIRT1蛋白浓度的下调可能参与了DGP的发生与发展,但引起SIRT1下调的具体机制有待进一步研究。相较模型组,给予SIRT1激活剂的糖尿病小鼠的胃排空率以及胃组织中的c-kit表达显著升高,SIRT1及其下游因子HO-1的蛋白浓度也明显升高,表明上调SIRT1可以保护糖尿病小鼠胃组织中的ICC网络,并维持小鼠正常的胃排空,这与其上调HO-1有关;另外,与模型组小鼠相比,给予SIRT1激活剂的糖尿病小鼠胃组织中MDA含量明显下降,T-SOD活力显著升高,提示上调SIRT1还可以通过抑制组织中的过氧化反应,并提高T-SOD活力来发挥抗氧化能力。
Bach1主要通过与小Maf癌蛋白形成异二聚体,并与小Maf识别元件(antioxidant response element,ARE)结合以抑制靶基因(包括编码HO-1的基因)表达[22]。在缺乏Bach1的小鼠中,HO-1在许多组织中以较高浓度组成性表达,这表明Bach1在HO-1表达的负调控中起主要作用[23]。在高氧诱导小鼠胚胎成纤维细胞衰老模型中,Bach1蛋白表达明显升高,一定程度上阻止了抗氧化转录因子Nrf2的核积累,导致细胞氧化应激浓度升高,从而加速细胞衰老[24]。另外一项针对肺纤维化小鼠的研究[25]发现,Bach1敲除后,抗氧化因子(如HO-1和谷胱甘肽过氧化物酶1)表达增加,肺泡和间质细胞的炎性浸润以及肺结构的破坏显著减弱。Bach1缺乏对氧化应激诱导的细胞损伤具有预防作用,缺乏Bach1的小鼠可以使四氧嘧啶诱导的胰岛β细胞的凋亡减少,而这种保护作用的机制归因于HO-1的上调[22]。以上证据表明,Bach1可能是组织细胞出现氧化应激损伤的关键环节,其可以成为预防糖尿病及其相关性疾病的可能的治疗靶标。本实验结果显示,胃排空延迟的糖尿病小鼠胃组织中Bach1浓度升高,提示Bach1可能是DGP发病的关键因子。笔者假设DGP小鼠胃组织中SIRT1蛋白浓度下降可能是组织中Bach1高浓度的重要原因之一,本实验中给予SIRT1激活剂的小鼠胃组织中Bach1浓度较DGP小鼠相比明显下降,HO-1表达显著升高,因此,可以认为SIRT1维持糖尿病小鼠正常胃排空的机制可能与其下调Bach1蛋白浓度,进一步促进抗氧化因子HO-1基因转录有关。
此外,本研究给予Res干预可以改善DGP小鼠的胃排空延迟,但是并未使糖尿病小鼠的血糖浓度下降,这是否与实验动物种类以及激活剂剂量和疗程有关尚未可知。在本实验条件下,上调SIRT1维持糖尿病小鼠正常的胃排空的作用不是通过影响血糖途径实现的。
综上所述,上调SIRT1可以通过调控Bach1和HO-1浓度,保护DGP小鼠胃组织中的ICC网络免受氧化损伤,并改善DGP小鼠胃排空延迟。此项研究为DGP患者的防治提供了新的理论依据。
