综合干预后多囊卵巢综合征不孕患者应用来曲唑促排卵的临床效果
2020-07-21豆竹丽阮祥燕王宾红张露平
豆竹丽 阮祥燕,2* 鞠 蕊 王宾红 秦 爽 许 新 杨 瑜 张露平
(1.首都医科大学附属北京妇产医院内分泌科,北京 100026;2.德国图宾根大学妇产医院妇女健康部与妇女健康研究中心,图宾根D-72076,德国)
多囊卵巢综合征 (polycystic ovary syndrome, PCOS) 是一种常见的生殖内分泌紊乱性疾病,以慢性无排卵、雄激素过高的临床或生物化学表现、卵巢多囊样改变为特征[1],常伴有胰岛素抵抗和肥胖,在育龄期女性的患病率高达6%~21%[2],约占排卵障碍性不孕患者的75%[3]。其病因尚不明确,临床表现高度异质性,目前尚无特效药物,治疗主要是个性化对症治疗[4],对有生育要求但持续无排卵或稀发排卵的PCOS不孕患者,促排卵药物治疗是关键的治疗方法。目前,来曲唑(letrozole,LE)是诱导排卵的一线用药。PCOS中有 50% 以上的患者合并超重或肥胖[5],生活方式干预是PCOS患者首选的基础治疗,此外还包括口服短效复方口服避孕药(combined oral contraceptive, COC) 降低雄激素浓度及手术治疗等,因单用效果欠佳,往往联合应用。目前关于促排卵前预处理方案,各家报道不一。本研究探讨个体化营养指导、减重及口服屈螺酮炔雌醇片(Ⅱ) (优思悦,Yaz)综合干预后采用来曲唑治疗多囊卵巢综合征不孕患者的临床效果,旨在为PCOS患者促排卵前的处理方案提供科学依据。
1 对象和方法
1.1 研究对象
选取 2019 年 3 月至 2019 年 9 月就诊于首都医科大学附属北京妇产医院内分泌科的 144 例多囊卵巢综合征不孕患者作为研究对象。纳入标准:①年龄20~40岁;②有生育要求;③符合2018年中华医学会《PCOS中国诊疗指南》[4],参照 2003年欧洲生殖和胚胎医学会与美国生殖医学会(ESHRE/ASRM) 鹿特丹专家会议推荐的PCOS诊断标准[6];④患者输卵管通畅,男方精液正常,未避孕未孕1年以上。排除标准:①肝肾功能异常:丙氨酸氨基转移酶≥100 IU/L或总胆红素≥40 μmol/L,血肌酐>133 μmol/L;②其他脏器功能不全;③有恶性肿瘤现病史;④过敏体质;⑤有精神病史或药物/酒精滥用史;⑥有血栓形成的病史(如:深静脉血栓形成、肺栓塞、心肌梗死、脑血管意外等);⑦在临床试验前3个月内参加过其他临床试验者。
按照组间基本特征均衡可比的原则,将入选患者分为观察组与对照组。观察组96例患者:年龄24~39岁,不孕年限1~6年;对照组48例患者:年龄23~39岁,不孕年限1~10年。分组后两组患者年龄、不孕年限,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,伦理批准文号:2020-KY-012-01,且所有患者对治疗过程充分知情并签署知情同意书。
1.2 治疗方法
观察组患者接受个体化营养指导、减重及口服优思悦3个月后采用来曲唑治疗。优思悦(每片含炔雌醇20 μg和屈螺酮3 mg,及4片安慰剂)在药物撤退性出血或月经来潮第5天开始口服,每晚1片,1次/d,连续用药28 d,不停药继续口服下一盒,共3个周期。服药期间根据个体化营养报告给予合理的饮食指导和减重,综合干预完成后采用来曲唑治疗:月经周期第3天口服来曲唑片(江苏恒瑞公司,2.5 mg/片),每次2片,1次/d,连续用药5 d,月经周期第8~10天开始经阴道B超监测卵泡发育,每2~3 d 监测1次,直至发现最大卵泡直径≥15~16 mm 时,改为每1~2天监测1次。若卵泡直径≥18 mm则皮下注射达必佳(GnRH-a,德国辉凌公司)0.1 mL,并指导患者同房,注射24~48 h后经阴道B超证实患者是否排卵,并给予地屈孕酮(达芙通,荷兰雅培公司)20 mg/d 支持,共14 d,14 d后查血人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG)判断是否妊娠。患者若未妊娠,重复上述来曲唑治疗。对照组患者未接受综合干预,其他治疗同观察组。两组患者促排卵治疗最多为4 个周期。
1.3 观察指标
(1)身高、体质量:患者脱掉鞋、帽等,限穿单衣单裤,以免影响测量数据,两手自然下垂,并在放松时测量身高与体质量;
(2)体质量指数(body mass index, BMI):BMI=体质量(kg)/身高2(m2);
(3)腰围:取站位,双脚分开约25~30 cm,平稳呼吸时,在髂前上棘与第 12 肋下缘连线的中点水平测量腰围;
(4)臀围:在臀部最突出部测量周径;
(5)血清相关指标:治疗前于月经周期第2~4天,或月经不规律者在超声检查中未发现直径≥10 mm的卵泡时进行抽血,治疗3个周期后在撤退性出血的第2~4天抽血。患者空腹12 h,晨8~10时肘静脉采血5 mL。监测指标包括卵泡刺激素 (follicle-stimulating hormone, FSH)、黄体生成素 (luteinizing hormone,LH)、总睾酮 (total testosterone,TT)、游离睾酮(free testosterone,FT) 以及抗苗勒管激素 (anti-Müllerian hormone, AMH)。
1.4 统计学方法
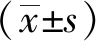
2 结果
2.1 两组基线资料比较
两组患者治疗前不孕年限、身高、体质量、BMI、腰围、臀围、LH、FSH、AMH浓度比较差异均无统计学意义(P>0.05),详见表1。
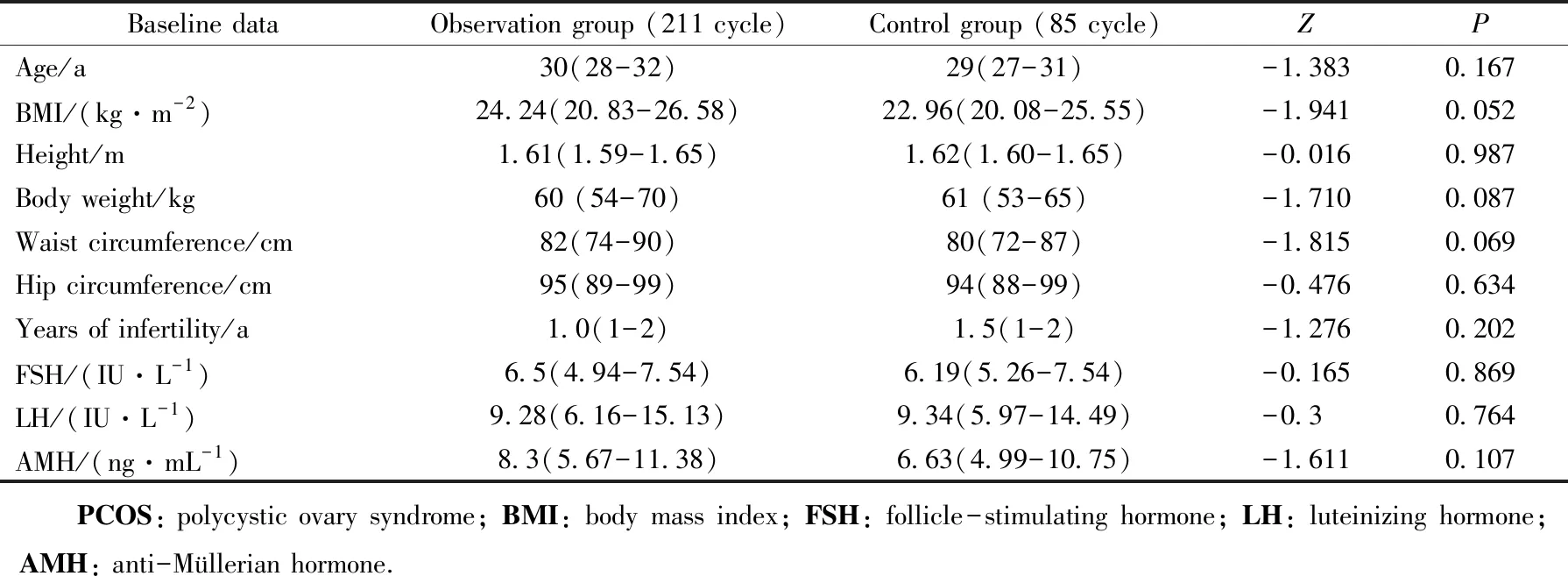
表1 两组PCOS不孕患者基线数据比较
2.2 观察组综合干预前后性激素水平比较
观察组综合干预3个月后LH、FSH、LH/FSH、TT、FT、AMH均明显降低,与干预前比较差异有统计学意义(P<0.05);腰围较综合干预前有所减低,但差异无统计学意义 (P=0.224),详见表2。
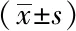
表2 观察组综合干预前后性激素相关指标的比较
2.3 两组患者治疗后排卵率比较
观察组96例患者共监测211个排卵周期,对照组48例患者共监测85个监排周期,观察组患者周期排卵率为87.2%(184/211),高于对照组的75.3%(64/85),差异有统计学意义(P<0.05)。详见表3。
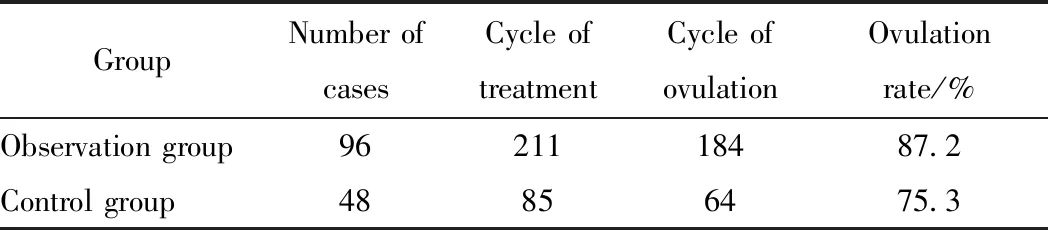
表3 两组PCOS不孕患者的排卵率比较
2.4 按BMI分层后两组患者治疗后排卵率比较
根据促排卵前BMI分成两层,在BMI<24 kg/m2的患者中,观察组的排卵率(91.9%)高于对照组(71.4%),差异有统计学意义(P<0.05)。而BMI≥24 kg/m2的患者中,两组的排卵率比较差异无统计学意义(P>0.05),详见表4。
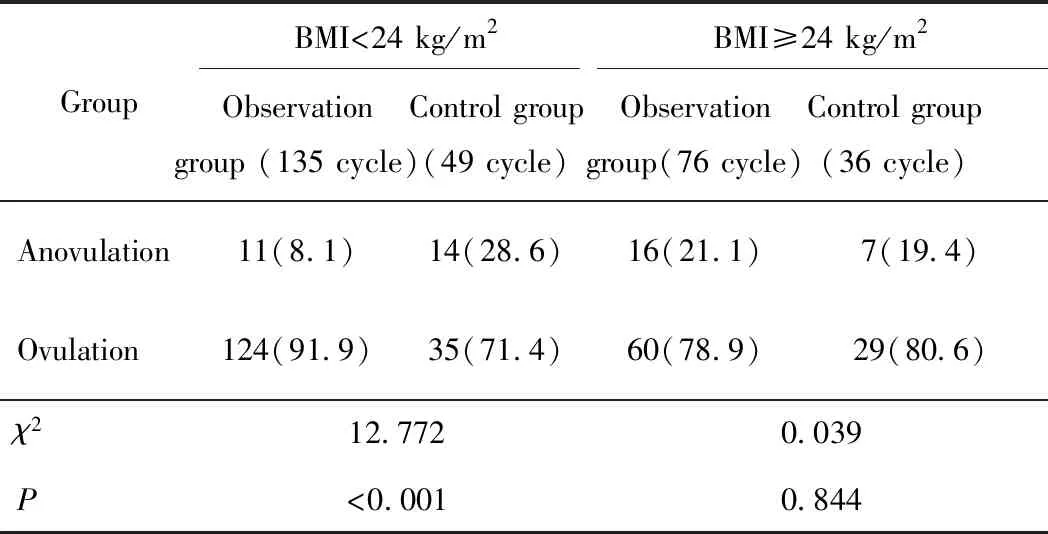
表4 促排卵前不同BMI的两组PCOS不孕患者促排卵结局的比较
3 讨论
多囊卵巢综合征的特点是临床和生物化学高雄激素血症、月经紊乱和排卵障碍。相关的代谢紊乱包括胰岛素抵抗 (insulin resistance, IR)、肥胖及糖脂代谢异常。目前研究[7]显示,下丘脑-垂体-卵巢(hypothalamus-pituitary-ovary,HPO) 轴的紊乱被认为是PCOS发病原因之一,主要表现为LH与FSH分泌异常,进而导致卵泡选择障碍,募集的卵泡停滞在小窦卵泡阶段,形成优势卵泡的机制丢失,从而导致卵巢内卵泡发育及排卵障碍。PCOS患者往往合并肥胖,尤其是腹型肥胖,肥胖可以导致排卵率的降低,引起IR和代偿性高胰岛素血症,胰岛素可直接作用和刺激LH分泌增加卵巢雄激素的产生,进一步加重高雄激素血症。这种内分泌紊乱反过来又可以加重腹型肥胖[8],从而形成肥胖、胰岛素抵抗和高雄激素三者之间的恶性循环。
来曲唑是目前临床首选的促排卵方法。对于PCOS不孕患者,尤其是超重或肥胖者,生活方式的调整是促排卵前的初始治疗,其次为药物治疗,包括激素类避孕药、胰岛素增敏剂或奥利司他等,此外还包括手术治疗,目前有关促排卵前预处理的方案单用效果往往不满意,临床上倾向于联合应用,但尚未形成共识。
针对上述情况,本研究募集96例PCOS不孕患者在接受个体化营养指导、减重及优思悦综合干预治疗3个月后采用来曲唑促排卵治疗,共211个促排卵周期,对照组48例PCOS患者,共85个促排卵周期,两组患者的基线指标具有可比性,结果显示:观察组的排卵率为87.2%(184/211),显著高于对照组75.3%(64/85) (P<0.05)。该研究的结果高于本团队柳顺玉等[9]之前对单纯屈螺酮炔雌醇片预处理的78.1%。患者综合干预前后各项指标的比较显示:LH、FSH、LH/FSH、TT、FT较治疗前显著下降 (P<0.05),腰围较治疗前亦有所下降,但差异无统计学意义。本研究结果提示综合预处理可以改善激素浓度,降低高雄激素状态,与闵敏等[10]之前的结果相一致。本研究还分析了综合干预对AMH浓度的影响,AMH[11]是由直径 5~8 mm窦前卵泡和小窦状卵泡的颗粒细胞分泌的,因此 AMH 浓度与小生长卵泡有很强的相关性。AMH除了评估PCOS严重程度、预后及区分疾病的主要表型外[12-14],还可能预示其诱导排卵或控制性超促排卵 (controlled ovarian hyperstimulation, COH)中卵巢的反应情况[15]。既往的研究[16-18]提示基础血清AMH增高是PCOS不孕患者促排卵治疗后未排卵或COH中卵巢反应的预测因子。本研究结果显示:综合干预后AMH较治疗前显著下降 (P<0.05),进而导致排卵率的升高,与上述结果一致。关于AMH的诊断截断值,由于PCOS患者的具体表型、种族差异以及各实验室方法的不同,目前尚无统一定论[19]。
此外,有关BMI对来曲唑促排效果上目前尚有争议。张素萍等[20]在比较71例肥胖型组90个周期与82例非肥胖型组97个周期对来曲唑的研究中指出:两组间优势卵泡数、排卵数、周期排卵率、单卵泡排卵率、双卵泡排卵率、多卵泡排卵率、卵泡发育不良发生率上差异均无统计学意义(P>0.05)。山惠枝等[21]探讨BMI对于PCOS患者体外受精/卵胞浆内单精子注射 (in-vitro fertilization/intracytoplasmic sperm injection, IVF/ICSI) 治疗过程及结局的影响中指出BMI升高可能会影响lVF/ICSI助孕的PCOS患者促排卵反应,导致促性腺激素(gonadotropins,Gn)用量增加、Gn促排天数延长[22]。本研究进一步对促排卵前的BMI进行分析,按照BMI值(亚洲标准)分为2组:偏瘦/正常体质量组 (BMI<24 kg/m2)和超重/肥胖组(BMI≥24 kg/m2)。对促排卵前体质量分层后结果显示促排卵前BMI<24 kg/m2的患者中,观察组的排卵率显著高于对照组 (P<0.05)。而BMI≥24 kg/m2的患者中,两组的排卵率差异无统计学意义(P>0.05)。该研究与山惠枝等[21]的研究结果一致,进一步印证了BMI升高会负向影响PCOS的促排卵过程,进一步强调了促排卵前体质量控制的重要性。
综上所述,在进行来曲唑促排治疗的PCOS不孕患者,促排前的综合干预处理能够改善患者的激素浓度,通过降低AMH、LH、LH/FSH等,进而增加卵巢的反应性,提高来曲唑的排卵率,尤其是体质量指数控制在正常或偏低的患者效果尤为显著。
