围绝经期及绝经后女性基于腰椎定量电子计算机断层扫描测定的内脏脂肪与糖脂代谢的相关性
2020-07-21张露平阮祥燕王宾红AlfredMueck
张露平 阮祥燕 ,2* 鞠 蕊 秦 爽 王宾红 许 新 杨 瑜 Alfred O. Mueck,2
(1. 首都医科大学附属北京妇产医院内分泌科,北京 100026;2. 德国图宾根大学妇产医院妇女健康部与妇女健康研究中心,图宾根 D-72076,德国)
肥胖主要表现为脂肪组织的过度积聚,与糖代谢紊乱、高血压、血脂异常等代谢综合征的发生密切相关[1-2]。脂肪组织包括皮下脂肪组织 (subcutaneous adipose tissue, SAT)和内脏脂肪组织(visceral adipose tissue, VAT),VAT和SAT无论在解剖位置、分子结构以及对人体内分泌代谢调控方面都存在很大差异[3]。与SAT相比,VAT的代谢活性更强。近年来研究[4]显示,与总体脂肪增加相比,局部脂肪的分布与代谢紊乱的发生有着更为密切的关系。女性绝经过渡期伴随着下丘脑-垂体-卵巢轴的改变,体内的脂肪会重新分布,表现为脂肪组织从四肢向躯干转移,腹部脂肪增加,尤其是内脏脂肪增加[5]。本研究通过腰椎定量电子计算机断层扫描(quantitative computed tomography,QCT)测定围绝经期与绝经后女性腹腔内脂肪面积,研究VAT与糖脂代谢的关系,旨在进一步探讨内脏脂肪与糖脂代谢间的关系。
1 对象与方法
1.1 研究对象
选择2018年9月至2020年2月期间在首都医科大学附属北京妇产医院内分泌科就诊,自愿参加本研究并接受腰椎QCT检查的围绝经期与绝经后期女性185人为研究对象。根据2011 STRAW+10的生殖衰老分期标准[6],围绝经期是指绝经过渡期直至绝经后1年(包括:-2期,-1期,+1a期),绝经后期是指绝经1年之后的时期(包括:+1b期,+1c期,+2期),其中围绝经期114人,依据内脏脂肪面积的标准分为内脏型肥胖组37人和正常组77人;绝经后期71人,内脏型肥胖组36人和正常组35人。排除标准:①近3个月口服减肥药、过度减重(>5%体质量)、腹部手术者;②近3个月服用激素或者影响骨代谢的药物;③合并甲状腺功能减退或者亢进、皮质醇增多症等影响内分泌代谢疾病者;④合并肝肾疾病以及恶性疾病影响全身代谢者。
1.2 方法
1.2.1 人体测量学指标
身高、体质量、体质量指数(body mass index, BMI)= 体质量(kg)/身高2(m2)、腰围、臀围。
1.2.2 腹腔内脏脂肪的测量
采用腹部CT扫描仪,对第二至第四腰椎(L2-L4)水平进行横断面CT扫描,获得腰椎骨密度(bone mineral density,BMD)的测量值,同时利用专业的QCT分析软件测量腹部总脂肪面积 (total adipose tissue, TAT) 及内脏脂肪面积 (visceral adipose tissue, VAT), 然后两者相减得出皮下脂肪面积 (subcutaneous adipose tissue, SAT)。CT测定腹部内脏脂肪≥100 cm2定义为内脏型肥胖[7],依据内脏脂肪面积的标准分为内脏型肥胖组(VAT≥100 cm2)和正常组。
1.2.3 血清学指标的测定
月经规律者取月经第2~5天,无规律者或闭经者任意时间,患者充分睡眠,于早晨8∶00~10∶00空腹肘静脉采血。卵泡刺激素(follicle stimulating hormone, FSH)、黄体生成素(1uteinizing hormone, LH)、雌二醇(estradiol, E2)采用美国拜耳公司生产的Centaur全自动化学发光免疫分析仪进行测定。空腹血糖 (fasting blood glucose, FBG),三酰甘油(triglyceride, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C)和载脂蛋白A、B(apolipoprotein A and B, Apo A 和Apo B)均采用美国Beckman Coulter公司生产的Synchron LX-20全自动生化检测仪测定;空腹胰岛素(fasting insulin, FINS)采用德国Siemens公司生产的ADVIA Centaur XP全自动化学发光免疫分析仪测定。
1.2.4 稳态胰岛素指数(homeostasis model assessment insulin resistance, HOMA-IR)
HOMA-IR=FBG (mmol/L)×FINS(mIU/L)/22.5。HOMA-IR作为评估胰岛素抵抗的常用指标。
1.3 统计学方法
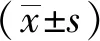
2 结果
2.1 内脏型肥胖组与正常组患者基本情况
2.1.1 围绝经期
内脏型肥胖组患者体质量、BMI、腰围、臀围及收缩压明显高于正常组,差异有统计学意义(P<0.05),而年龄、身高、舒张压、FSH及雌二醇浓度内脏型肥胖组与正常组间差异无统计学意义(P>0.05)。
2.1.2 绝经后期
内脏型肥胖组患者年龄、体质量、BMI、腰围、臀围、收缩压明显高于正常组,差异有统计学意义(P<0.05),雌二醇浓度明显低于正常组(P<0.05),而身高、舒张压及FSH,差异无统计学意义(P>0.05)。详见表1。
表1 内脏型肥胖组与正常组女性一般临床资料的比较
Tab.1 Comparison of basic clinical data between visceral obesity group and normal group
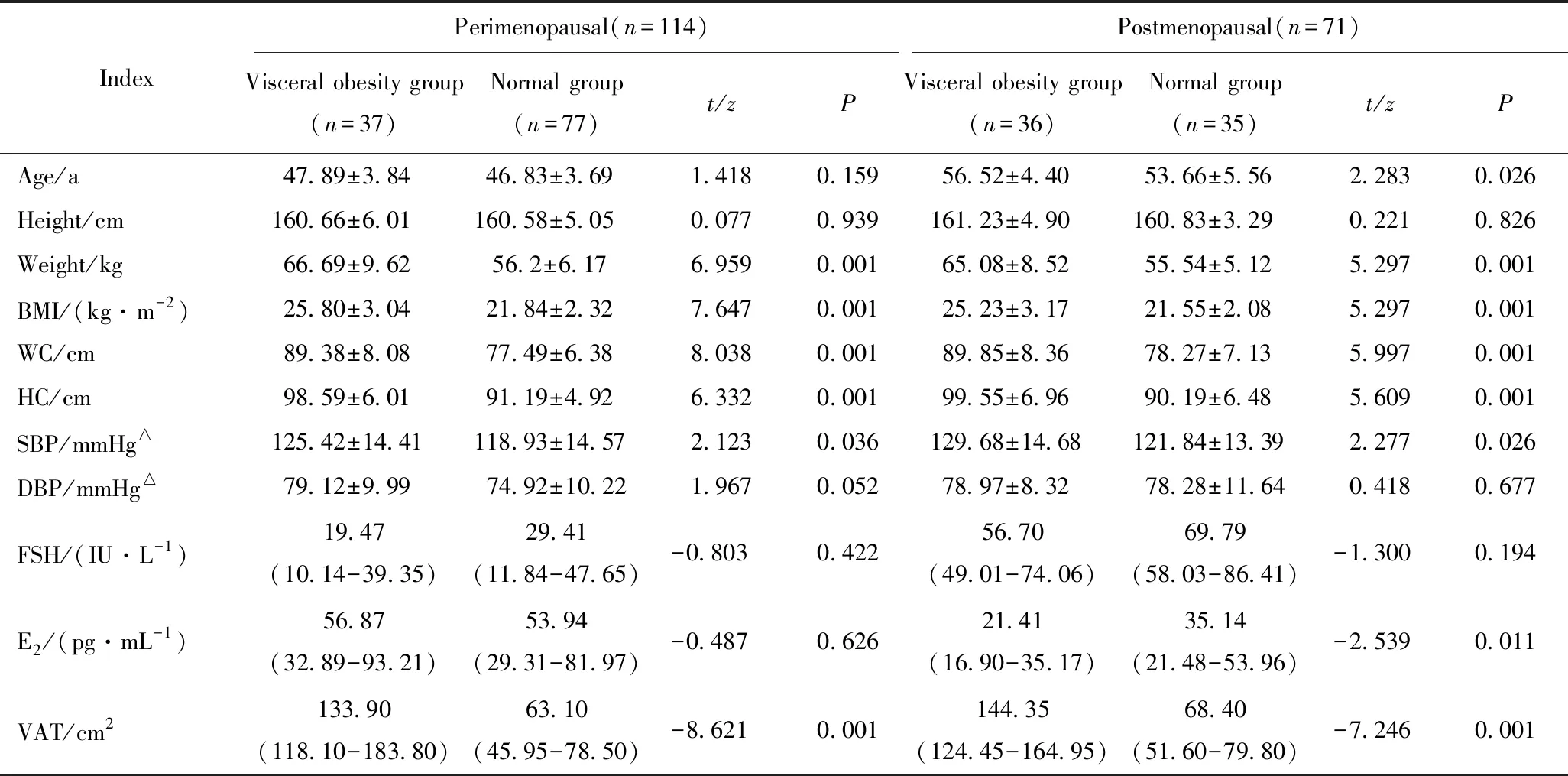
表1 内脏型肥胖组与正常组女性一般临床资料的比较
IndexPerimenopausal(n=114)Postmenopausal(n=71)Visceral obesity group (n=37)Normal group (n=77)t/zPVisceral obesity group(n=36)Normal group(n=35)t/zPAge/a47.89±3.8446.83±3.691.4180.15956.52±4.4053.66±5.562.2830.026Height/cm160.66±6.01 160.58±5.05 0.0770.939161.23±4.90 160.83±3.29 0.2210.826Weight/kg66.69±9.6256.2±6.176.9590.00165.08±8.5255.54±5.125.2970.001BMI/(kg·m-2)25.80±3.0421.84±2.327.6470.00125.23±3.1721.55±2.085.2970.001WC/cm89.38±8.0877.49±6.388.0380.00189.85±8.3678.27±7.135.9970.001HC/cm98.59±6.0191.19±4.926.3320.00199.55±6.9690.19±6.485.6090.001SBP/mmHg△125.42±14.41118.93±14.572.1230.036129.68±14.68121.84±13.392.2770.026DBP/mmHg△79.12±9.9974.92±10.221.9670.05278.97±8.3278.28±11.640.4180.677FSH/(IU·L-1)19.47 (10.14-39.35)29.41(11.84-47.65)-0.803 0.42256.70(49.01-74.06)69.79(58.03-86.41)-1.3000.194E2/(pg·mL-1)56.87(32.89-93.21)53.94(29.31-81.97)-0.487 0.62621.41(16.90-35.17)35.14(21.48-53.96)-2.5390.011VAT/cm2133.90(118.10-183.80)63.10(45.95-78.50)-8.621 0.001144.35(124.45-164.95)68.40(51.60-79.80)-7.2460.001
△:1 mmHg=0.133 kPa; BMI: body mass index; WC: waist circumference; HC: hip circumference; SBP: systolic blood pressure; DBP: diastolic blood pressure; FSH: follicle stimulating hormone; E2: estradiol; VAT: visceral adipose tissue.
2.2 内脏型肥胖组与正常组糖脂代谢指标的比较
2.2.1 围绝经期
内脏型肥胖组患者的空腹血糖、空腹胰岛素、HOMA-IR、三酰甘油浓度均高于正常组,HDL-C浓度低于正常组,差异有统计学意义(P<0.05);而总胆固醇、LDL-C、Apo A、Apo B的浓度,组间差异无统计学意义(P>0.05)。详见表2。
2.2.2 绝经后
内脏型肥胖组患者的空腹血糖、空腹胰岛素、HOMA-IR、LDL-C、Apo B浓度均高于正常组,HDL-C及Apo A 浓度低于正常组,差异有统计学意义(P<0.05);而总胆固醇及三酰甘油浓度,组间差异无统计学意义(P>0.05)。详见表2。
表2 内脏肥胖组与正常组女性糖脂代谢指标的比较
Tab.2 Comparison of glycolipid metabolism data between visceral obesity group and normal group
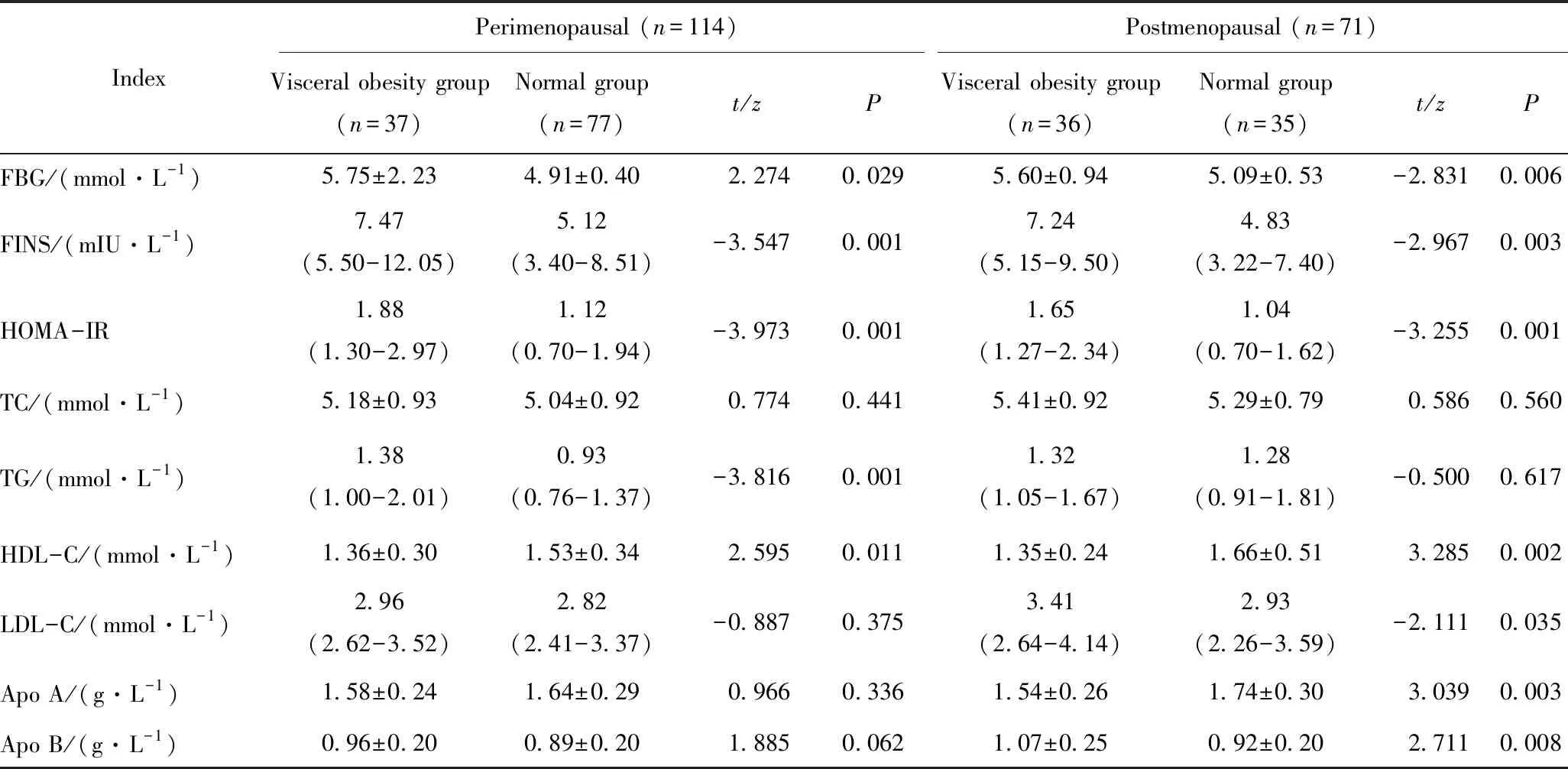
表2 内脏肥胖组与正常组女性糖脂代谢指标的比较
IndexPerimenopausal (n=114)Postmenopausal (n=71)Visceral obesity group (n=37)Normal group(n=77)t/zPVisceral obesity group (n=36)Normal group(n=35)t/zPFBG/(mmol·L-1)5.75±2.234.91±0.40 2.2740.0295.60±0.945.09±0.53-2.8310.006FINS/(mIU·L-1)7.47(5.50-12.05)5.12(3.40-8.51)-3.5470.0017.24(5.15-9.50)4.83(3.22-7.40)-2.9670.003HOMA-IR1.88(1.30-2.97)1.12(0.70-1.94)-3.9730.0011.65(1.27-2.34)1.04(0.70-1.62)-3.2550.001TC/(mmol·L-1)5.18±0.935.04±0.92 0.7740.4415.41±0.925.29±0.790.5860.560TG/(mmol·L-1)1.38(1.00-2.01)0.93(0.76-1.37)-3.8160.0011.32(1.05-1.67)1.28(0.91-1.81)-0.5000.617HDL-C/(mmol·L-1)1.36±0.301.53±0.34 2.5950.0111.35±0.241.66±0.513.2850.002LDL-C/(mmol·L-1)2.96(2.62-3.52)2.82(2.41-3.37)-0.8870.3753.41(2.64-4.14)2.93(2.26-3.59)-2.1110.035Apo A/(g·L-1)1.58±0.241.64±0.29 0.9660.3361.54±0.261.74±0.303.0390.003Apo B/(g·L-1)0.96±0.200.89±0.20 1.8850.0621.07±0.250.92±0.202.7110.008
FBG: fasting blood glucose; FINS: fasting insulin; HOMA-IR: homeostasis model assessment insulin resistance; TC: total cholesterol; TG: triglyceride; HDL-C: high density lipoprotein-cholesterol; LDL-C: low density lipoprotein-cholesterol; Apo A: apolipoprotein A; Apo B: apolipoprotein B.
2.3 内脏脂肪与各指标间相关性分析
2.3.1 围绝经期
VAT与空腹血糖、空腹胰岛素、HOMA-IR、三酰甘油及Apo B呈正相关,与HDL-C及Apo A呈负相关(P<0.05),关系的密切程度中等偏弱。未发现VAT与总胆固醇及LDL-C具有相关性(P>0.05),详见表3。
2.3.2 绝经后
VAT与空腹血糖、空腹胰岛素、HOMA-IR、Apo B呈正相关,与HDL-C及Apo A呈负相关(P<0.05),关系的密切程度中等偏弱。未发现VAT与总胆固醇、三酰甘油及LDL-C具有相关性(P>0.05),详见表3。
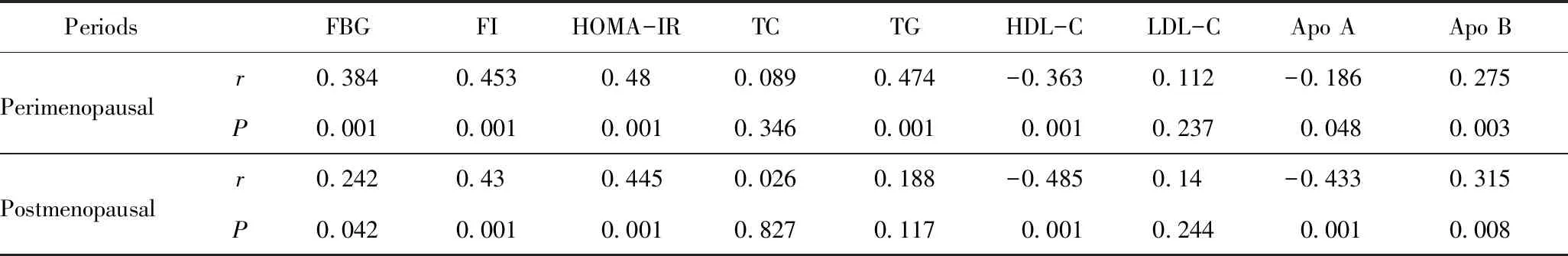
表3 围绝经期与绝经后期内脏脂肪面积与糖脂代谢的相关性分析
3 讨论
3.1 腹部脂肪的分布及内脏脂肪的功能
根据分布位置的不同,可将脂肪组织分为皮下脂肪和内脏脂肪,内脏脂肪主要分布在腹腔脏器周围,包括网膜脂肪、肠系膜脂肪、生殖周脂肪、后腹膜脂肪、肾周脂肪等。皮下脂肪主要分布在皮肤下层,包括臀部、大腿、背部和前腹壁皮下[8]。能量摄入过多超过皮下脂肪的储存能力时,可能会导致内脏脂肪增加,无论男女,内脏脂肪都会随着年龄的增长而增加[8]。女性随着激素浓度的变化伴随着脂肪的重新分布,皮下脂肪转化为内脏脂肪。临床实践显示,腹部VAT的聚集引起的肥胖又称为内脏型肥胖,CT是测量腹部脂肪的金标准方法,CT测定腹部VAT≥100 cm2定义为内脏型肥胖[7]。本研究结果显示,绝经后期女性内脏型肥胖组患者的年龄明显高于正常组(P<0.05) 。
此外,脂肪不仅是能量储存器官,也是具有内分泌功能的器官。脂肪细胞可以通过分泌多种激素和脂肪因子来调节机体代谢。与皮下脂肪相比,内脏脂肪具有更高的代谢活性,内脏脂肪对于心血管疾病、胰岛素抵抗、血脂异常的影响更大。因此,内脏型肥胖也已经成为代谢领域的研究热点。近年来的研究[9-10]表明肥胖和体质量增加所导致的代谢性疾病风险更多地与体脂分布有关,而不简单地与体脂总量有关。上腹部、中央或内脏型肥胖的人群比臀肌型、外周型肥胖的人群将面临更大的健康风险。
3.2 内脏脂肪对糖代谢的影响
与皮下脂肪相比,内脏脂肪增多更容易导致胰岛素抵抗[11],内脏脂肪代谢产物可以通过门静脉循环直接进入肝脏,由此产生过多的游离脂肪酸(free fatty acid, FFA)可以影响肝脏的糖代谢,胰岛素抵抗增强,导致机体对葡萄糖耐受下降。有研究[4]表明,FFA升高是Ⅱ型糖尿病的独立危险因素,而内脏脂肪的堆积正是FFA升高的主要途径。与此同时,内脏脂肪对胰岛素不敏感,葡萄糖利用率较低,这样会导致内脏脂肪更易被分解,导致FFA升高,形成一个恶性循环,影响了正常的糖代谢,骨骼肌及肝脏对胰岛素的敏感性降低,肝内糖异生和葡萄糖的输出增加等,从而引发血糖升高[12]。
本研究结果显示,无论是围绝经期还是绝经后期,内脏型肥胖组女性的空腹血糖、空腹胰岛素及HOMA-IR均显著高于正常组(P<0.05),而且内脏脂肪与空腹血糖、空腹胰岛素及HOMA-IR呈显著正相关(P<0.05)。可以看出,对于不同绝经状态的两组患者,内脏脂肪的堆积对于糖代谢的影响是一致的,这与既往研究[13-14]一致。国内也有研究[15-16]表明内脏型肥胖在胰岛素抵抗方面有着重要的影响,内脏脂肪与Ⅱ型糖尿病患者胰岛素介导的葡萄糖转化显著相关,内脏脂肪是胰岛素抵抗与Ⅱ型糖尿病的独立危险因素。
3.3 内脏脂肪对脂代谢的影响
与脂代谢有关的指标主要有血清脂质和脂蛋白等。血清脂质包括胆固醇、三酰甘油、磷脂和游离脂肪酸。脂蛋白是血脂在血液中存在、转运及代谢的形式。其中,高密度脂蛋白是血清中颗粒密度最大的一组脂蛋白,主要作用是将肝脏以外组织中的胆固醇转运到肝脏进行代谢,高密度脂蛋白的增高有利于外周组织清除胆固醇,而低密度脂蛋白是富含胆固醇的脂蛋白。脂蛋白中的蛋白部分称为载脂蛋白,Apo A是高密度脂蛋白的主要结构蛋白,Apo B是低密度脂蛋白中含量最多的蛋白质。人体在正常情况下,可以通过脂肪的合成及代谢维持体内脂质代谢的平衡。当体内脂肪过度堆积、分泌功能失常时,脂肪的分解会更活跃,内脏脂肪的过度聚集后会释放大量的游离脂肪酸进入血液,形成高游离脂肪酸血症,这些游离的脂肪酸为肝脏各种合成功能提供了底物,加之各种脂蛋白酶和各种脂肪酶的活性发生改变,加速合成胆固醇,出现血脂代谢异常,从而会导致胆固醇、三酰甘油的升高和HDL-C的降低[17]。
本研究结果显示,围绝经期女性,内脏型肥胖组的三酰甘油显著高于正常组,HDL-C浓度显著低于正常组。而绝经后女性,内脏型肥胖组LDL-C及Apo B浓度显著高于正常组,HDL-C及Apo A浓度显著低于正常组。虽然不同绝经状态人群内脏脂肪对于各种血脂代谢的影响不尽相同,但总体趋势仍然是一致的,内脏脂肪会引起致病性血脂增加,保护性血脂下降。本研究对VAT与脂代谢的相关性结果显示,不同绝经状态人群中,VAT与Apo B呈正相关,VAT与HDL-C及Apo A呈负相关。此外,在围绝经期人群中,VAT还与三酰甘油呈正相关。因此,内脏脂肪的蓄积与脂代谢的紊乱是密切相关的。这一观点也在很多研究[18-19]证实。
综上所述,内脏脂肪的蓄积是胰岛素抵抗、血糖代谢异常及脂代谢异常的危险因素,与不良的健康结局相关。减少内脏脂肪成为改进生活方式和药物治疗的目标[20]。因此,有必要通过生活方式的改变,包括适当体育活动、进行热量限制和健康的饮食结构等,有效减少内脏型肥胖,进而降低内脏型肥胖相关的慢性疾病发生的风险[21-22]。
